Benannte Stellen am Limit: So kommen Sie einfacher durch die IVDR-Konformitätsbewertung
Sie benötigen eine Konformitätsbewertung durch eine Benannte Stelle und warten seit Monaten auf eine Rückmeldung oder wurden womöglich sogar abgelehnt? Damit sind Sie nicht alleine!
Seit dem Inkrafttreten der neuen Verordnung benötigen zehnmal mehr IVDs als zuvor eine Prüfung und Bewertung durch eine Benannte Stelle, während es gleichzeitig weniger Stellen gibt, die für die IVDR benannt sind! Die daraus resultierenden Kapazitätsprobleme gehen zulasten vieler Hersteller.
Im Klartext bedeutet das: Es kommt durchaus vor, dass Benannte Stellen den Antrag eines Herstellers, bei dem Unsicherheit über den allgemeinen Aufwand oder Bedenken hinsichtlich eines positiven Ergebnisses bestehen, ablehnen oder in der Warteschlange weit nach hinten rücken lassen.
Erhöhen Sie Ihre Chance auf eine direkte Zusage mithilfe unserer IVDR Readiness Bescheinigung!
Minimieren Sie das Risiko einer Ablehnung durch eine Benannte Stelle – und damit der Gefährdung Ihres Marktzugangs

Wir führen eine Mock-Konformitätsbewertung Ihres QM-Systems und einer exemplarischen Technischen Dokumentation durch. Wenn beides eine entsprechende Qualität aufweist, stellen wir eine IVDR Readiness Bescheinigung aus, die Sie einer Benannten Stelle vorzeigen können.
Die unabhängige Prüfung durch unsere erfahrenen Expert:innen vermittelt Benannten Stellen die Sicherheit, dass keine größeren Lücken in der Dokumentation oder der Prozesslandschaft zu erwarten sind. Die IVDR Readiness Bescheinigung dient somit als Nachweis, dass Ihre Konformitätsbewertung effizient und ressourcenschonend durchgeführt werden kann.
Sparen Sie Zeit und Mühe bei der Antragsstellung, sodass einer reibungslosen Prüfung und Bewertung nichts mehr im Weg steht
Die Antragsstellung bei einer Benannten Stelle folgt strikten regulatorischen Vorgaben und kann aufgrund des Umfangs und der Komplexität einen hohen Aufwand verursachen. Unser Team unterstützt Sie gerne und stellt sicher, dass der Antrag korrekt ausgefüllt ist und die Einreichung so effizient wie möglich erfolgt.
Der Weg zur IVDR Readiness Bescheinigung
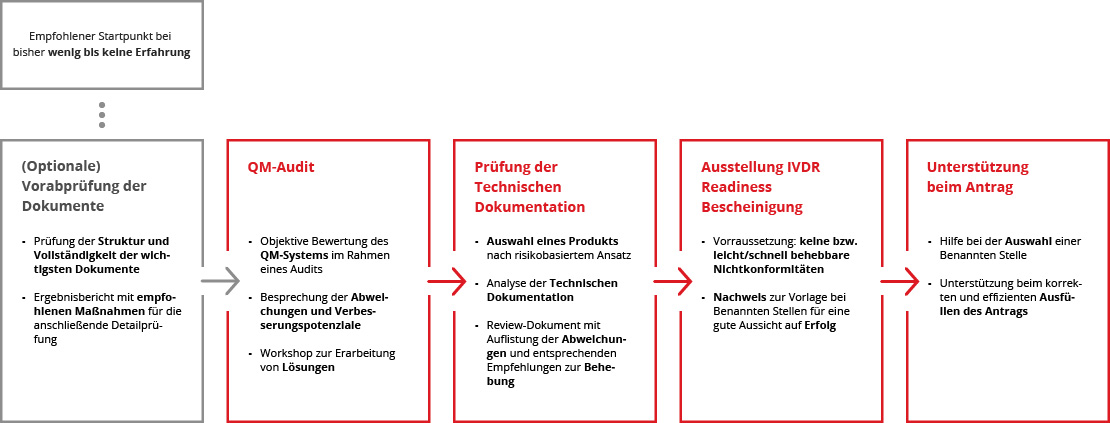
Können wir Ihnen damit behilflich sein? Melden Sie sich gerne über unser Kontaktformular, um ein kostenloses und unverbindliches Beratungsgespräch anzufordern. Eine:r unserer Business Analysts wird sich schnellstmöglich bei Ihnen melden, um in einem gemeinsamen Vorgespräch zu prüfen, ob und wie wir Ihnen am besten helfen können.

