Die ISO 9241 ist eine ganze Normenfamilie urspünglich zu den „Ergonomische Anforderungen für Bürotätigkeiten mit Bildschirmgeräten“. Inzwischen hat sich die Anwendbarkeit der ISO 9241 auch auf jede Form von Produkten weiterentwickelt.
Normen der ISO 9241 Familie
Zu den Mitgliedern dieser Norm zählen:
- ISO 9241-13 Benutzerführung
- ISO 9241-14 Dialogführung mittels Menüs
- ISO 9241-110 Grundsätze der Dialoggestaltung (ersetzt ISO 9241-10)
- ISO 9241-112 Grundsätze der Informationsdarstellung
- ISO 9241-125 Visuelle Informationsdarstellung
- ISO 9241-143 Formulardialoge
- ISO 9241-151 Browser-basierte Benutzungsschnittstellen
- ISO 9241-154 Sprachdialogsysteme
- ISO 9241-161 User-Interface-Elemente
- ISO 9241-171 Barrierefreiheit von Benutzungsschnittstellen
- ISO 9241-210 beschreibt den Prozess zur Gestaltung gebrauchstauglicher interaktiver Systeme
Beachten Sie, dass einige dieser Normen der ISO 9241-Familie noch nicht final freigegeben sind:
- Die 9241-112 ist ein erster Entwurf der neuen Norm „Grundsätze der Informationsdarstellung und allgemeine Empfehlungen“.
Hier werden Prinzipien und allgemeine Empfehlungen für die Informationsdarstellung ÜBER ALLE MODALITÄTEN HINWEG, also sehen, hören, fühlen (riechen, schmecken) gegeben.
- Die 9241-125 steht als neue Norm mit „Empfehlungen zur VISUELLEN Informationsdarstellung“ zur Verfügung.
Die 9241-112 und 9241-125 zusammen bilden damit den Nachfolger der ISO 9241-12.
Auch die 9241-161 gibt es erst als Normenentwurf.
ISO 9241-125
Die ISO 9242 gibt sehr konkrete Hinweise zur visuellen Informationsgestaltung. Sie nennt dazu Heuristiken und konkrete Gestaltungsregeln.
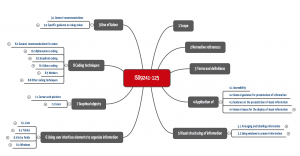
Abb. 1: Die ISO 9241-125 nennt Heuristiken und Regeln für die Gestaltung von Benutzungsschnittstellen (zum Vergrößern klicken)
Beispielsweise beschreibt die ISO 9241-125 wie Informationen zu kodieren und zu strukturieren sind. So geht z.B. das Kapitel 5.1 auf die Labels ein und gibt Hinweise zu:
- Positionierung
- Anordnung
- Gruppierung
- Formatierung
- Verwendung von Maßeinheiten
Die englische Fassung der ISO 9241-125:2017 ist bereits erschienen und beim Beuth-Verlag erhältlich. Die deutsche Fassung erscheint im April 2018.
Tipp
Machen Sie sich nicht die Arbeit, eigene Gestaltungsregeln zu definieren. Die ISO 9241-125 hat dies bereits getan. Ergänzen Sie bestenfalls Style-Guides, um Ihr Corporate-Design zu gewährleisten.
Inhalt der ISO 9241 und Bezug zur IEC 62366
Während die IEC 62366 eine Prozessnorm ist, die keine konkreten Anforderung an die Gestaltung von Benutzer-Produktschnittstellen stellt, gibt die ISO 9241 ganz konkrete Gestaltungrichtlinien. Diese betreffen die Gestaltung von Web-Anwendungen ebenso wie die Gestaltung von Formularen, kommandozeilenbasierten Benutzer-Produkt-Schnittstellen oder die Gestaltung von Menüs.
Die Prinzipien, die die ISO 9241 beschreibt, gehen aber weit über Bürotätigkeiten und Bildschirmgeräte hinaus. Sie lassen sich größtenteils auf alle interaktiven Systeme und damit auch auf Medizinprodukte übertragen. Falls es bei dem Medizinprodukt um eine standalone Software handelt, sogar nahezu vollständig.
Allerdings berücksichtigt die ISO 9241 im Gegensatz zur IEC 62366 nicht den Aspekt des Risikomanagements bzw. der Sicherheit von Anwendern und Patienten. Dennoch trifft die Aussage zu, dass gebrauchstaugliche Produkte, die Sicherheit von Anwendern und Patienten erhöhen bzw. Risiken für diese verringern.
Die ISO 9241 wird auch die konkrete Methodik beschreiben, mit der Hersteller die wirklichen Kundenanforderungen systematisch(!) ableiten können. Der Auditgarant beschreibt diese beeindruckende Methode bereits in vier Videotrainings, auch anhand konkreter Beispiele.
Videotrainings im Auditgarant ansehen
Die IEC 62366 verweist auf die ISO 9241 ohne jedoch konkrete Forderungen daraus zu übernehmen. Leider hat die IEC 62366 auch die Definitionen der ISO 9241 wie beispielsweise die des Begriffs „Gebrauchstauglichkeit“ nicht unverändert übernommen.
Wir haben ein Poster, das diese Normen listet und beschreibt, wie Sie den gebrauchstauglichkeitsorientierten Entwicklungsprozess gemäß IEC 62366 in den Entwicklungsprozess integrieren können:

Die heuristische Evaluation ist ein Verfahren, mit dem Usability-Experten die Gebrauchstauglichkeit von Produkten anhand von Heuristiken (dazu gleich mehr) beurteilen. Dieser Artikel zeigt, wie Sie heuristische Evaluationen nutzen können, um die regulatorischen Anforderungen ans Usability Engineering sehr schnell und kostengünstig zu erfüllen. Er verrät Ihnen auch, weshalb Sie die heuristische Evaluation nicht auf das (Medizin-)Produkt…
Weiterlesen
Der IEC TR 62366-2 ist ein „Technical Report“, den Medizinproduktehersteller als „Gebrauchsanweisung“ für die IEC 62366-1 nutzen können. Der Technical Report gibt konkrete Handlungsleitung beim Usability Engineering, um die Anforderungen der IEC 62366-1 zu erfüllen. Dieser Artikel verschafft Ihnen einen Überblick über den mehr als hundertseitigen IEC TR 62366-2.
Weiterlesen
Die IEC 62366 formuliert Anforderungen an die Hauptbedienfunktion von Medizinprodukten. Leider definiert sie den Begriff Funktion nicht und sorgt im Anhang für Verwirrung. Dieser Artikel liefert eine Definition und Beispiele nach. Inhaltsübersicht Definition „Hauptbedienfunktion“ » Was sind Funktionen? » Was heißt häufig und sicherheitskritisch? » Weitere relevante Definitionen » Update: Ich habe den Artikel zu den Hauptbedienfunktionen aktualisiert…
Weiterlesen
Die Nutzerbefragung nutzen viele Medizinproduktehersteller, um die Gebrauchstauglichkeit ihrer Produkte zu bewerten. Doch als einziges Methode angewendet sind Nutzerbefragungen nicht geeignet, um die regulatorischen Anforderungen zu erfüllen.
Weiterlesen



