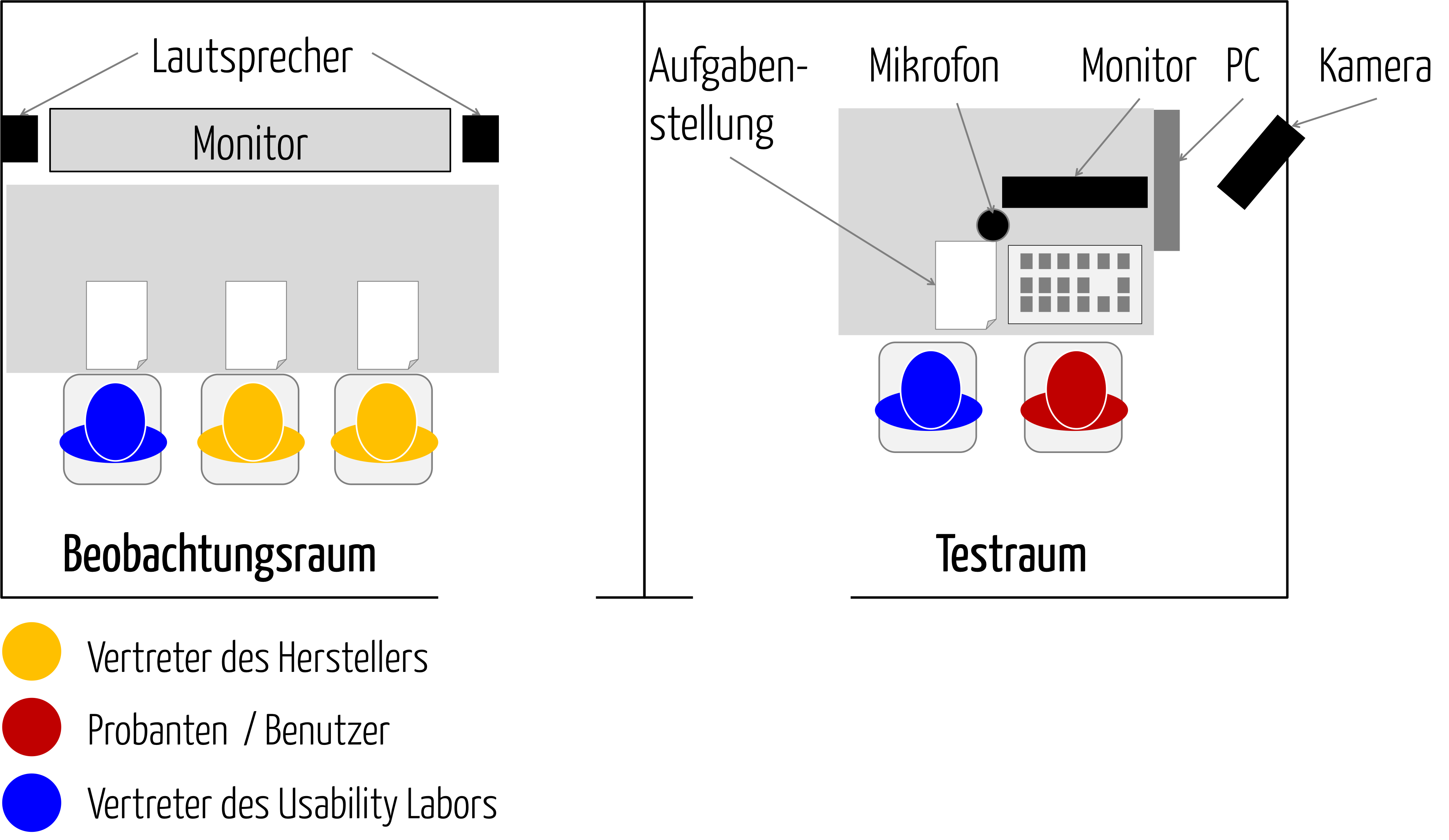
Summative Evaluierung: Auf diese Punkte müssen Sie achten
Der Begriff summative Evaluation lässt sich mit „abschließender Bewertung“ übersetzen. Eine summative Evaluation prüft am Ende der Entwicklungsphase, ob Anwender ein Produkt bzw. ein User Interface sicher bedienen können. Dieser Beitrag verschafft Ihnen einen Überblick über die regulatorischen Anforderungen an die “summative Bewertung“ (manchmal auch als „summative assessment“ bezeichnet) und gibt Ihnen Tipps, wie Sie…
Weiterlesen