Die Norm zum Usability-Engineering-Prozess, IEC 62366-1:2015, wurde seit ihrer Veröffentlichung im Jahr 2015 schon mehrfach angepasst. Korrekturen sind durch das Corrigendum von 2016 erfolgt. Mit dem Amendment aus dem Jahr 2020 (AMD1:2020) gab es nun weitreichende Änderungen, mit denen sich Hersteller von Medizinprodukten vertraut machen sollten.
Der folgende Artikel
- listet alle wichtigen Änderungen zu IEC 62366-1:2015 auf und erläutert diese,
- informiert Sie über den Stand der Harmonisierung.
1. Hintergrund und Zielsetzung der IEC 62366-1:2015
Der durch die IEC 62366-1:2015 beschriebene Usability-Engineering-Prozess soll sicherstellen, dass Risiken, die bei der Nutzung von Medizinprodukten entstehen können, minimiert werden. Die Norm richtet sich an Hersteller von Medizinprodukten und auch an technische Komitees, die für die Erstellung spezifischer Normen für Medizinprodukte verantwortlich sind.
Die IEC 62366-1:2015 ist die Nachfolgenorm der 62366:2007. Um den normativen Teil zu entschlacken, besteht die Neufassung der IEC 62366 aus zwei Teilen:
- der Norm selbst (IEC 62366-1) und
- dem informativen Technical Report (IEC 62366-2).
2. Die wesentlichen Änderungen durch AMD1:2020
Seit die IEC 62366-1 2015 veröffentlicht wurde, haben Expert:innen insgesamt 22 Probleme identifiziert. Diese wurden nun durch die Korrekturen behoben.
Zusammengefasst sind die wesentlichen Änderungen die Folgenden:
- Redaktionelle Änderungen
Viele Änderungen zu IEC 62366-1:2015 sind lediglich redaktioneller Natur; z. B. wurden Referenzen und Jahreszahlen aktualisiert und Textpassagen neu formuliert. - Anwendungsbereich
Der Anwendungsbereich der Norm hat sich geändert. Dieser umfasst nun nicht mehr nur physikalische Gefährdungen, sondern Gefährdungen jeglicher Art (u. a. auch psychische Gefährdungen). - Definitionen
Die Definitionen von „Begleitdokumentation“ und „Nutzungsumgebung“ wurden erweitert sowie die Definition des Begriffs „Benutzerprofil“ geändert. - Neue Begriffe
Es gab Anpassungen im Wortlaut der Norm, inklusive der Einführung neuer Begriffe. Unter anderem wurden die Begriffe „User Group“ sowie „Critical Task“ eingeführt und es wird nun der „Close Call“ erwähnt. - Neue Anforderungen
Neue Anforderungen gibt es für das Planen von Usability-Tests im Rahmen der summativen Evaluation und des Erfassens von Benutzungsschwierigkeiten. Diese müssen nun, zusätzlich zu Nutzungsfehlern, im Rahmen der summativen Evaluation erfasst werden. - Risikobeherrschung und Dokumentationspflicht
Die Risikobeherrschung wurde durch Trainings erweitert und die Dokumentationspflicht für das Anpassen des Usability-Engineering-Aufwandes aufgehoben.
- IEC 62366-1:2015 ist mittlerweile als sogenannte konsolidierte „Redline-Version“ (IEC 62366-1:2015+AMD1:2020 CSV) verfügbar, in die das Amendment eingearbeitet und die Änderungen gekennzeichnet wurden.
- Darüber hinaus wurde mittlerweile auch eine nationale Version veröffentlicht (DIN EN 62366-1:2021-08; VDE 0750-241-1:2021-08).
- Auch das Amendment AMD1:2020 selbst ist als Einzeldokument erhältlich.
Eine Übersicht über das Thema Gebrauchstauglichkeit (Usability) von Medizinprodukten finden Sie in unserem Übersichtartikel Usability & IEC 62366.
3. Die Änderungen im Detail
| Kapitel | Unterpunkt | Änderung |
| Kapitel 1 – Anwendungsbereich | Anmerkung 1 | „Rein physikalische Gefährdungen“ gestrichen, dadurch Gefährdungen jeglicher Art umfasst |
| Kapitel 3 – Begriffe | 3.2 Begleitdokumentation | Die Definition von Begleitdokumentation erweitert |
| 3.20 Nutzungsumgebung/ Anmerkung 1 | Die Definition von Bedingungen der Nutzungsumgebung geändert | |
| 3.29 Benutzerprofil | Fokus auf individuelle Eigenschaften des Benutzers gesetzt | |
| Kapitel 4 – Grundprinzipien | 4.1 Allgemeine Anforderungen
| Training des Benutzers als Risikobeherrschungsmaßnahme eingeführt |
| 4.3 Anpassen des Usability-Engineering-Aufwands | Anpassung des Usability-Engineering-Aufwands braucht nicht mehr in der UE-File nachgewiesen werden | |
| Kapitel 5 – Usability-Engineering-Prozess | 5.7 Erstellen eines Plans für die User-Interface-Evaluation
| Den Begriffs „User Group“ eingeführt |
| 5.7.3 Planen der summativen Evaluation | Neue Anforderungen für summative Usability-Tests eingeführt, u. a. Erfassen von Benutzungsschwierigkeiten | |
| 5.9 Durchführen der summativen Evaluation | Erfassen von Benutzungsschwierigkeiten in der summativen Evaluation | |
| Anhang A (informativ) – Allgemeine Anleitung und Begründung | Erläuterungen zur Definition 3.11 – Hauptbedienfunktion | Primary Operating Functions müssen nicht bestimmt werden |
| Erläuterungen zur Definition 3.22 – Use Scenario | Den Begriff „Critical Task“ eingeführt | |
| Grafik A.4 | Zusammenhang von IEC 62366-1 und ISO 14971 für die Arten des Gebrauchs dargestellt | |
| Grafik A.5 | Abstimmungen zwischen Risikomanagement und Usability Engineering Anpassen von gefährdungsbezogenen Nutzungsszenarien, Risikobeherrschungsmaßnahmen und User-Interface-Evaluation | |
| Erläuterungen zum Kapitel 5.7.3 – Planen der summativen Evaluation | Benutzungsschwierigkeiten und Close Calls berücksichtigt | |
| Anhang B (informativ) – Beispiele für mögliche Gefährdungssituationen | Tabelle B.1 | Hier wurde das Wort „physical“ im Zusammenhang mit Gefährdungen entfernt, sodass nun theoretisch z. B. auch psychische Folgeschäden einbezogen werden können, die durch Benutzungsfehler entstehen. |
a) Kapitel 1: Alle Arten von Gefährdungen werden einbezogen
- Gefährdungen werden laut Anmerkung 1 des ersten Kapitels nicht mehr nur auf physikalische Gefährdungen reduziert. Die „Direct Physical Hazards“ wurden in der aktuellen Version der Norm gestrichen, wodurch nun Gefährdungen jeglicher Art einbezogen werden.
- Dies hebt auch die Änderung der Tabelle B.1. im Anhang B hervor, die Beispiele für mögliche Gefährdungssituationen aufzeigt. Hier wurde das Wort „physical“ im Zusammenhang mit Gefährdungen entfernt, sodass nun theoretisch auch psychische Folgeschäden einbezogen werden können, die durch Benutzungsfehler entstehen.
b) Kapitel 3: Neue Begriffe und Definitionen
Das dritte Kapitel von IEC 62366-1:2015 legt Begriffe und Definitionen fest. Auch hier gibt es einige Neuerungen.
Erweiterung der Definition von Begleitdokumentation
Die Definition von „Begleitdokumentation“ aus Punkt 3.2 wurde dahingehend erweitert, dass hierunter neben Materialien, die die Installation, Nutzung und Instandhaltung eines Medizinprodukts betreffen, nun auch solche fallen, die Informationen über die Stilllegung und das Entsorgen enthalten.
Änderung der Definition von Bedingungen der Nutzungsumgebung
- Die Nutzungsumgebung wird in Punkt 3.20 weiterhin als „actual conditions and setting in which users interact with the medical device“ definiert, also die tatsächlichen Bedingungen und Einrichtungen, in denen Nutzer mit dem Medizinprodukt interagieren.
- Geändert hat sich jedoch die Definition der „conditions“, also der Bedingungen, die die Nutzungsumgebung ausmachen. Anmerkung 1 stellt klar, dass für diese auch soziale Merkmale der Nutzungsumgebung wie Teamarbeit versus Einzelperson, Chaos versus Ruhe sowie das Belastungsniveau eine Rolle spielen.
Fokus auf individuelle Eigenschaften des Benutzers
- Die Definition des Benutzerprofils aus 3.29 hat sich geändert. Der zweite Halbsatz, der sich auf die Nutzer bezieht, macht die Eigenschaften der Nutzer nicht mehr an Anforderungen des Jobs oder der Arbeitsbedingungen fest sondern an Attributen wie Wissen, Fertigkeiten und Fähigkeiten, die Einfluss auf Designentscheidungen (die die Nutzeroberfläche (UI) betreffen) haben können.
Die Eigenschaften beziehen sich damit jetzt konkret auf den einzelnen Benutzer.
„knowledge, skills and abilities, which can have a bearing on design decisions“
- Beachtenswert sind außerdem die Erläuterungen zu Kapitel 3 aus Anhang A, die nicht normativer, sondern lediglich informativer Natur sind. Hier betreffen die Änderungen die Definition der Hauptbedienfunktion (3.11) und des Use Scenarios (3.22).
„Primary Operating Functions“ müssen nicht bestimmt werden
In der Erläuterung zur Hauptbedienfunktion im Anhang A hat sich vor allem die Handhabung der sogenannten Primary Operating Functions geändert. Die Erläuterung zu Punkt 3.11 stellt nun eindeutig klar, dass diese nach IEC 62366-1:2015 nicht bestimmt werden müssen. Stattdessen müssen gefährdungsbezogene Use Scenarios identifiziert, beschrieben und evaluiert werden.
Hiervon gibt es jedoch Ausnahmen:
- Abweichend davon müssen die Primary Operating Functions berücksichtigt werden, wenn diese in anderen produkt-spezifischen Normen aufgeführt werden und sie somit für den Usability-Engineering-Prozess relevant sind.
- Die Bestimmung der Primary Operating Functions ist also nach IEC 62366-1:2015 nicht nötig, wohl aber unter Umständen in Zusammenhang mit anderen Normen.
Einführung des Begriffs „Critical Task“
Bei der Erläuterung des Use Scenarios (3.22) in Anhang A wurde außerdem der Begriff „Critical Task“ eingeführt.
Dieser beschreibt eine Aufgabe in einem gefahrenbezogenen Use Scenario, bei deren Erledigung ein Benutzungsfehler zu einem beträchtlichen Schaden führen kann.
c) Kapitel 4: Neues bei den allgemeinen Prinzipien
Training des Benutzers als Risikobeherrschungsmaßnahme
Bei Punkt 4.1.2, der sich mit der Risikobeherrschung in Bezug auf das Design des User Interfaces bezieht, wurde zusätzlich zu den bereits bestehenden Optionen zur Risikobeherrschung [a) „Sicheres Design und Herstellung“, b) „Schutzmaßnahmen“] in c) neben „Informationen zur Sicherheit“ die Option „Training des Benutzers“ ergänzt.
Punkt c) lautet nun:
„Information for safety and, where appropriate, training to users“.
Anpassen des Usability-Engineering-Aufwands nicht mehr in UE-File
Das Anpassen des Usability-Engineering-Aufwands braucht laut Punkt 4.3 nicht mehr in einer Usability-Engineering-File (UE-File) nachgewiesen werden. Dieser Punkt stellt keine Muss-Anforderung im Sinne der Norm dar.
d) Kapitel 5: Änderungen beim Usability-Engineering-Prozess
Auch in Kapitel 5 zum Usability-Engineering-Prozess haben sich einige Änderungen ergeben.
Einführung des Begriffs „User Group“
Beim Erstellen eines Plans für die User-Interface-Evaluation (5.7.1 Allgemeines) hat sich die Terminologie geändert. Sofern Usability-Tests Bestandteil des Plans sind (formative und summative Evaluation), soll dokumentiert werden, welche Nutzergruppen (User Groups) im Test einbezogen werden.
- Zuvor war an dieser Stelle von „User“ und „User Profile“ die Rede. Diese verschmelzen nun zu einer „User Group“. Diese ist entsprechend zu dokumentieren. Es handelt sich eher um eine formale Änderung, die sich im Erstellen der UE-File entsprechend wiederfinden sollte.
- Eine entsprechende Änderung findet sich auch in Punkt 5.7.3 e), der näher darauf eingeht, was beim Planen von Usability-Tests im Rahmen der summativen Evaluation in Bezug auf die Nutzergruppen zu beachten ist.
Neue Anforderungen für summative Usability-Tests, u. a. Erfassen von Benutzungsschwierigkeiten
Punkt 5.7.3 befasst sich mit dem Planen der summativen Evaluation. Hierbei haben sich die Anforderungen an die Durchführung summativer Usability-Tests geändert. Es wird nun gefordert, dass
- die Repräsentativität der Testteilnehmer sichergestellt wird,
- erklärt wird, warum die Benutzergruppen so gewählt wurden,
- der korrekte Gebrauch definiert wird sowie
- nicht nur Benutzungsfehler erfasst werden, sondern auch Benutzungsschwierigkeiten.
Benutzungsschwierigkeiten und Close Call
Die Erläuterung zu 5.7.3 in Anhang A geht noch näher auf den Begriff „Benutzungsschwierigkeit“ (use difficulty) ein.
- Use Error
Demnach tritt eine Benutzungsschwierigkeit während der Benutzung des Medizinprodukts typischerweise nur vorübergehend auf und wird vom Benutzer überwunden. Wenn die Benutzungsschwierigkeit fortschreitet, kann diese zum Nutzungsfehler („use error“ oder „failure“) werden, wenn der Benutzer deshalb die Aufgabe nicht erledigen kann. So könnte etwa das Suchen nach einer Funktion (als Benutzungsschwierigkeit) bei zeitkritischen Aufgaben letztlich einen Nutzungsfehler (failure) bedeuten. - Close Call
Eine Benutzungsschwierigkeit, bei der der Benutzer beim Ausführen einer Aufgabe beinahe einen Nutzungsfehler begeht, dies aber noch verhindern kann, wird manchmal („sometimes“ laut Originalwortlaut) als „Close Call“ bezeichnet.
Die Formulierung legt also nahe, dass Beinahe-Fehler (Close Calls) auch durch Benutzungsschwierigkeiten verursacht werden können.
Erfassen von Benutzungsschwierigkeiten in der Summativen Evaluation
Auch beim Durchführen der summativen Evaluation (5.9) werden Benutzungsschwierigkeiten (use difficulties) wichtiger. So müssen die Ergebnisse der summativen Evaluation nicht nur im Hinblick auf Benutzungsfehler analysiert werden, sondern es muss auch festgestellt werden, ob es Benutzungsschwierigkeiten gegeben hat. Dies wurde vorher nicht so explizit in der Norm erwähnt.
Wichtig ist auch die Anmerkung 1 hierzu, die wortlautgleich zum bereits genannten Close Call aus Anhang A ist.
„A use difficulty where a user almost commits a use error while performing a task, but recovers in time to avoid making the use error is sometimes called a ‚close call‘.“
Quelle: IEC 62366-1:2015
e) Änderungen in den erläuternden Grafiken in Anhang A
Erläuterung des Zusammenhangs von IEC 62366-1 und ISO 14971 für die Arten des Gebrauchs
Im informativen (nicht normativen) Anhang A wurde eine neue Grafik A.4 eingefügt, die den Zusammenhang der „Arten des Gebrauchs“ in der IEC 62366-1 mit dem Konzept der „vernünftigerweise vorhersehbaren Fehlanwendung“ (reasonably forseeable misuse) in der ISO 14971 erklärt. Dies stellt gewissermaßen eine Erweiterung der Grafik im Kapitel „Begriffe 3.1 – Anormaler Gebrauch“ dar.
Die Grafik führt zwei Neuerungen ein:
- Zunächst wird zwischen vernünftigerweise vorhersehbarem und nicht vernünftigerweise vorhersehbarem Gebrauch unterschieden. Unter Ersterem werden der normale (bestimmungsgemäße) Gebrauch und der anormale Gebrauch aufgeführt. Unter dem normalen Gebrauch werden der korrekte, also fehlerfreie, sowie bisher der fehlerhafte Gebrauch (use error) eingeordnet.
- Das wirklich Neue ist jedoch: Benutzungsfehler des normalen/bestimmungsgemäßen Gebrauchs und der sogenannte „anormale Gebrauch“ werden dem „vernünftigerweise vorhersehbarem Missbrauch“ („reasonably forseeable misuse“ aus ISO 14971) zugeordnet.
Was bedeutet das für den Anwender dieser Norm?
Das ist ein wenig unklar. Wo ist die Grenze zwischen anormalem Gebrauch und Gebrauch mit Fehlern? Muss der Anwender/Hersteller nun auch möglicherweise anormalen Gebrauch vorhersehen und in Usability-Tests abprüfen? Sicherlich nicht. Dass anormaler Gebrauch nun neben möglichen Benutzungsfehlern vernünftigerweise vorhersehbar sein soll (oder vielleicht auch nicht), erzeugt Unklarheit.
Abstimmungen zwischen Risikomanagement und Usability Engineering gestärkt
Auch die Grafik A.5 wurde – wenn auch nur geringfügig – verändert. Sie verdeutlicht die Prozesse bzw. Abstimmungen zwischen Schritten des Risikomanagements und dem Usability Engineering. Ein neuer Schwerpunkt liegt nun auf dem wechselseitigen Austausch. Gerade bei der Identifizierung von Gefährdungen, Szenarien und sicherheitsrelevanten User-Interface (UI)-Merkmalen ist es sinnvoll, zusammenzuarbeiten.
- Austausch zwischen dem Risikomanagement und dem Usability Engineering
Es wurde erkannt, dass es einen verstärkten wechselseitigen Austausch von Informationen zwischen dem Risikomanagement und dem Usability Engineering geben muss und nicht nur einseitig in Richtung Risikomanagement. Deshalb wurden Pfeile auch in Richtung Usability-Prozess eingefügt. Dies betrifft die Aktivitäten „Ermitteln von sicherheitsbezogenen (UI-)Eigenschaften bzw. -Merkmalen“ sowie die Ermittlung bekannter und vorhersehbarer Gefährdungen und Gefährdungssituationen. - Risikomanagement und summative Evaluation
Außerdem wurde eine neue Verbindung zwischen dem Einschätzen des Risikos von Gefährdungen im Risikomanagement als Input für das Ermitteln und Beschreiben von gefährdungsbezogenen Szenarien für die summative Evaluation auf Usability-Seite ergänzt. Grund: Die Einschätzung von Risiken seitens des Risikomanagements kann gerade bei der Auswahl von Szenarien (Stichwort: Kritikalität) wichtig sein.
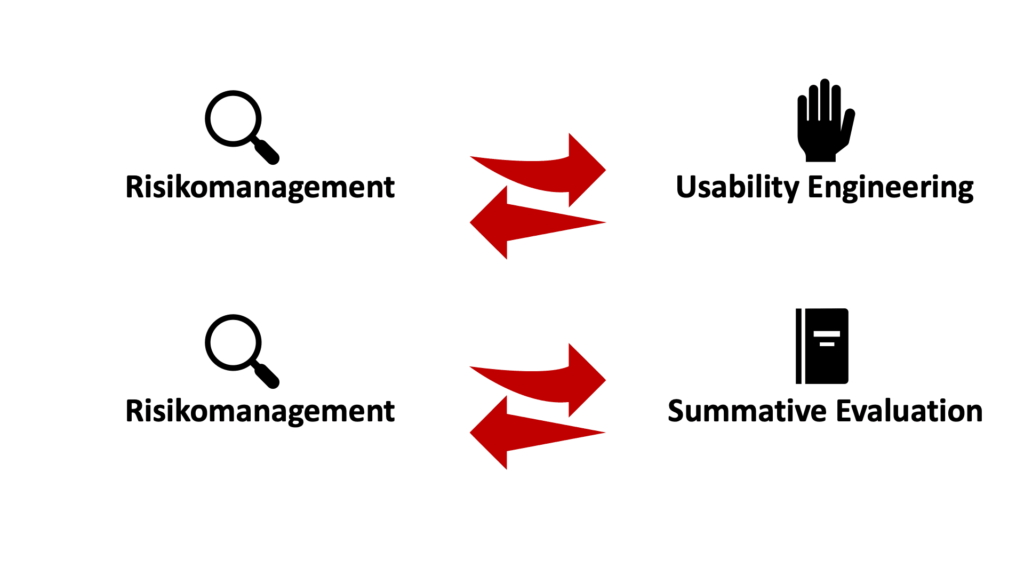
Anpassen von gefährdungsbezogenen Nutzungsszenarien, Risikobeherrschungsmaßnahmen und User-Interface-Evaluation
Ebenfalls in Zusammenhang mit Grafik A.5 wird betont, dass die gefährdungsbezogenen Nutzungsszenarien, Risikobeherrschungsmaßnahmen und die User-Interface-Evaluation kontinuierlich (iterativ) anhand der Ergebnisse der formativen Evaluation angepasst und verbessert werden sollten.
4. Aktuelles zur Harmonisierung der IEC 62366-1:2015
Das Wichtigste vorab:
Leider ist die Harmonisierung seit einiger Zeit zum Halten gekommen. Dies gilt nicht nur für diese Norm, sondern auch für andere Normen, die zur MDD harmonisiert waren und erneut harmonisiert werden müssen.
So sollte zuerst die EN ISO 14971 harmonisiert werden, um den Weg für weitere Normen auf der Harmonisierungsliste zu ebnen. Auch die aktuelle IEC 62366-1 ist eng verknüpft mit dieser Norm. Für andere Normen, z. B. die IEC 60601, sind diese Bestrebungen im Gange. Doch bis jetzt scheiterten alle Harmonisierungsbemühungen an inhaltlichen Differenzen mit der EU-Kommission in Bezug auf die Kompatibilität zu den Anforderungen der MDR – trotz aller Anstrengungen, in weiteren Anhängen inhaltlich kompatible Formulierungen mit der MDR zu generieren.
Leider ist bis heute unklar, wie es weitergeht, auch wenn mit anderen Normen ein Anfang gemacht wurde (Stand September 2021). Die Gültigkeit und Anwendbarkeit der IEC 62366-1 ist von der Harmonisierung nicht betroffen.
Nähere Informationen finden Sie im aktualisierten Beitrag Harmonisierte Normen: Beweisführung für Medizinproduktehersteller und im Regulatory Radar.
5. Fazit
Besonders das Amendment AMD1:2020 hat zahlreiche Änderungen bei der IEC 62366-1:2015 eingeführt, die im Usability-Engineering-Prozess berücksichtigt werden müssen. Die meisten dieser Änderungen liefern hilfreiche Klarstellungen und Verbesserungen. Einige, z. B. die Änderungen der Grafik A.4 in Anhang A, werfen mehr Fragen auf, als sie beantworten. Darüber hinaus verzögert sich der dringend notwendige Harmonisierungsprozess der Usability-Norm weiter.
Änderungshistorie
2021-10-01: Komplette Überarbeitung des Artikels mit einer Erläuterung der Änderungen der Version von 2015 durch das Amendment 1 von 2020 und dem aktuellen Stand der Harmonisierung der Norm.





Guten Tag Herr Prof. Dr. Johner,
ich hatte bereits die Gelegenheit an einem Ihrer interessanten Software-Seminare in Konstanz teilzunehmen und informiere mich regelmäßig über Ihren Newsletter.
Sie schreiben, dass die Aufnahme der IEC62366-1:2015 in die harmonisierten Normen für 2016 erwartet wird. Mich würde interessieren, wo diese Information herkommt, bzw. wie belastbar sie ist. Denn ich habe bei meinen Recherchen nichts darüber herausfinden können.
Über eine Antwort würde ich mich sehr freuen!
Mit freundlichen Grüßen,
Magdalena Förg
Consumer Testing Services
Medical Device Project Engineer
SGS Germany GmbH
Hofmannstr. 50
D-81379 München
Sehr geehrte Frau Förg,
die Information habe ich aus dem Normenkreis. Letztlich ist das aber gar nicht mehr so wichtig: Die benannten Stellen verlangen den Stand der Technik. Und mit Bezug darauf können/sollten Sie die neuste Version der Norm umsetzen. Schließlich gibt sie Ihnen mehr Freiheitsgrade. Durch den „Harmonisierungsstau“ reflektieren für viele benannten Stellen die harmonisierten Normen nicht mehr (immer) den Stand der Technik.
Beste Grüße
Christian Johner
Sehr geehrter Herr Johner,
ich stellte bereits eine ähnliche Frage zum Thema Anhang ZA der EN ISO 14971:2012.
Wir entwickeln aktuell nach der IEC 62366-1:2015, die Benannte Stelle fordert uns aber dazu auf in der technischen Dokumentation die IEC 62366:2007 abzubilden.
In Ihrem Fazit zu diesem Beitrag schreiben Sie, die Entwicklung nach der IEC 62366-1-2015er Version deckt die grundlegenden Anforderungen der EG-Richtlinie ab. Könnte man Ihre Ausführungen dazu als Argumentationsgrundlage für die Benannte Stelle nutzen?
Wir möchten ungern eine Gapanalyse durchführen müssen, was ich bei den unterschiedlichen Strukturen der Versionen als kompliziert erachte.
Sehr geehrter Herr Meyer,
auf Basis einer 13 Jahre alten Norm zu argumentieren, dass dies Stand der Technik sei, empfinde ich schon als weit hergeholt. Wir sind inzwischen beim AMD1 der 62366-1 angekommen.
Ich würde in der Tat die BS bitten, auf die neue Norm umzusteigen. Es hängt aber davon ab, ob Sie die Konformität gegen die MDD oder die MDR erklären wollen. Bei der MDR würde ich sogar hinterfragen, ob ein Bestehen einer BS auf einer so alten Norm rechtlich überhaupt möglich ist.
Bei der MDD ist das eher möglich. Wenn man aber das eigentliche Ziel der Regularien verfolgt, sichere und nützliche Medizinprodukte in den Verkehr zu bringen, ist die neue Version die bessere Leitlinie.
Viele Grüße, Christian Johner
Sehr geehrter Herr Johner,
vielen Dank für die rasche Antwort.
Wir gehen in der Tat noch unter der MDD ins Rennen und bauen nach Zertifikatserhalt auf MDR um.
Daher sind wir ebenfalls verwundert, dass eine vermeintliche lang überholte Norm noch als Maßstab angeführt wird.
Mit freundlichen Grüßen
Jens Meyer
Vielen Dank für diesen ausführlichen Artikel!
Eine kleine Frage: Sie schreiben: „Die Bestimmung der Primary Operating Functions ist also nach IEC 62366-1:2015 nicht nötig, wohl aber unter Umständen in Zusammenhang mit anderen Normen.“
Welche Normen erwarten Primary Operating Functions?
Beste Grüße,
Verena Prutsch
Hallo Frau Prutsch,
vielen Dank für Ihre berechtigte Frage. Leider wird in der Norm selbst kein mir bekannter Hinweis gegeben, welche anderen Normen POFs einfordern. Auch in der Zeit seit der Veröffentlichung der Änderungen habe ich weder aus dem Normungskreis noch aus anderer Quelle Hinweise erhalten.
Herzliche Grüße
Wolfgang Schneider