Die Maschinenrichtlinie (2006/42/EG) ist allgemein auf Maschinen aller Art anwendbar. Doch auch für die Hersteller von Medizinprodukten kann die Richtlinie relevant sein: Sowohl die MDR als auch die IVDR verweisen auf sie.
Greift die Maschinenrichtlinie, gelten Anforderungen, die über die der MDR und IVDR hinausgehen. Dieser Artikel verschafft Ihnen daher einen Überblick darüber,
- wann Medizinprodukte unter die Maschinenrichtlinie fallen,
- welche Anforderungen Sie dann berücksichtigen müssen,
- wie Sie den Konformitätsnachweis schaffen und
- was die EU für die Zukunft der Maschinenrichtlinie plant.
1. Wann Sie die Maschinenrichtlinie beachten müssen
Die 2006 von der EU erlassene Maschinenrichtlinie sorgt für ein einheitliches Sicherheitsniveau für Maschinen in Europa. Als allgemeine Regelung für Maschinen aller Art behandelt sie ein breites Spektrum an Gefährdungen.
Auch von Medizinprodukten können solche Gefährdungen ausgehen. Damit das einheitliche Sicherheitsniveau auch für diese Produkte gilt, verweisen sowohl die MDR als auch die IVDR auf die Richtlinie.
Wann Hersteller die Maschinenrichtlinie beachten müssen, besagen die im Wortlaut gleichen Art. 1 Abs. 12 MDR und Art. 1 Abs. 6 IVDR:
„Produkte, die auch Maschinen im Sinne des Artikels 2 Absatz 2 Buchstabe a der Richtlinie 2006/42/EG des Europäischen Parlaments und des Rates sind, müssen − falls eine gemäß dieser Richtlinie relevante Gefährdung besteht − den grundlegenden Gesundheits- und Sicherheitsanforderungen gemäß Anhang I dieser Richtlinie entsprechen, sofern diese Anforderungen spezifischer sind als die grundlegenden Sicherheits- und Leistungsanforderungen gemäß Anhang I Kapitel II der vorliegenden Verordnung.“
Quelle: Art. 1 Abs. 12 MDR; Art. 1 Abs. 6 IVDR
Die Maschinenrichtlinie gilt also für Medizinprodukte, wenn die folgenden Voraussetzungen erfüllt sind:
- Das Produkt ist eine Maschine nach Art. 2 Abs. 2 Buchst. a Maschinenrichtlinie und
- es kann eine relevante Gefährdung eintreten und
- die Maschinenrichtlinie enthält spezifischere Vorgaben als MDR oder IVDR.
a) Bedingung 1: Das Medizinprodukt gilt als Maschine
Die Maschinenrichtlinie definiert „Maschine“ in Art. 2 Abs. 2 Buchst. a.
Eine Maschine besteht allgemein aus
- einer Sachgesamtheit
Diese besteht aus mindestens zwei Teilen, die für einen spezifischen Zweck miteinander verbunden werden. - einem Antrieb
Mindestens eines der Teile wird angetrieben. Die Antriebskraft stammt nicht vom Menschen oder Tier, sondern von anderen Energiequellen wie elektrischen, pneumatischen, hydraulischen, mechanischen oder thermischen Energiequellen.
Eine Ausnahme hierzu gibt es bei Produkten für Hebevorgänge. Hierbei kann auch menschliche Kraft der Antrieb sein.
Art. 2 Abs. 2 Buchst. a definiert eine Maschine im Detail als:
− eine mit einem anderen Antriebssystem als der unmittelbar eingesetzten menschlichen oder tierischen Kraft ausgestattete oder dafür vorgesehene Gesamtheit miteinander verbundener Teile oder Vorrichtungen, von denen mindestens eines bzw. eine beweglich ist und die für eine bestimmte Anwendung zusammengefügt sind;
− eine Gesamtheit im Sinne des ersten Gedankenstrichs, der lediglich die Teile fehlen, die sie mit ihrem Einsatzort oder mit ihren Energie- und Antriebsquellen verbinden;
− eine einbaufertige Gesamtheit im Sinne des ersten und zweiten Gedankenstrichs, die erst nach Anbringung auf einem Beförderungsmittel oder Installation in einem Gebäude oder Bauwerk funktionsfähig ist;
− eine Gesamtheit von Maschinen im Sinne des ersten, zweiten und dritten Gedankenstrichs oder von unvollständigen Maschinen im Sinne des Buchstabens g, die, damit sie zusammenwirken, so angeordnet sind und betätigt werden, dass sie als Gesamtheit funktionieren;
− eine Gesamtheit miteinander verbundener Teile oder Vorrichtungen, von denen mindestens eines bzw. eine beweglich ist und die für Hebevorgänge zusammengefügt sind und deren einzige Antriebsquelle die unmittelbar eingesetzte menschliche Kraft ist
Beispiele für Maschinen nach Maschinenrichtlinie (die keine Medizinprodukte sind)
- Landwirtschaftsmaschinen
- Industrieroboter
- Bohrmaschinen
- Elektrische Gartengeräte
- Werkzeugmaschinen
Beispiele für Medizinprodukte, die auch Maschinen nach der Maschinenrichtlinie sind
- Der bewegliche Teil einer Anlage für die Tumorbestrahlung (Gantry)
- Chirurgische Instrumente wie Bohrer oder Sägen
- Chirurgische Instrumente im Dentalbereich
- Bewegliche OP-Tische
- Operationsroboter
- Zentrifugen
- Elektrisch verstellbare Patientenbetten
- Herz-Lungen-Maschinen
Beispiele für IVD-Produkte, die auch Maschinen nach der Maschinenrichtlinie sind
- Autosampler
- Zentrifugen
- Sortieranlagen
- Zuführeinrichtungen
b) Bedingung 2: Eine relevante Gefährdung kann eintreten
Fällt das Medizinprodukt unter die Definition von „Maschine“, stellen MDR und IVDR als weitere Bedingung für die Anwendung der Maschinenrichtlinie, dass eine relevante Gefährdung durch das Produkt besteht.
Eine Gefährdung ist
„eine potenzielle Quelle von Verletzungen oder Gesundheitsschäden“
Quelle: Anhang I, Punkt 1.1.1 Buchst. a Maschinenrichtlinie
Welche konkreten Arten von Gefährdungen unter die Maschinenrichtlinie fallen, listet die Richtlinie im Anhang I auf. Geht vom Medizinprodukt eine dort genannte Gefährdung aus, ist auch die zweite Bedingung erfüllt.
c) Bedingung 3: Die Maschinenrichtlinie enthält spezifischere Vorgaben
Als letzte Voraussetzung dafür, dass die Maschinenrichtlinie bei Medizinprodukten greift, müssen die Regelungen in Anhang I der Maschinenrichtlinie spezifischer sein als die in Anhang I Kap. II der MDR oder IVDR.
Welche das konkret sind, muss also von Fall zu Fall durch Vergleich der grundlegenden Anforderungen von Maschinenrichtlinie und MDR bzw. IVDR entschieden werden.
Anforderungen, die in MDR und IVDR genauer geregelt sind als in der Maschinenrichtlinie
MDR
- Biologische und chemische Gefährdungen
- Gefährdungen im Zusammenhang mit Software
- Gefährdungen im Zusammenhang mit der Gebrauchstauglichkeit
- Gefährdungen durch Strahlung
- Elektrische Gefährdungen
IVDR
- Robotiksysteme, auf denen ein IVD-Kit automatisiert ist (Liquid Handling Robotics)
- Mikroskope mit beweglichem Objektträgertisch und automatischem Objektiv
In diesen Fällen müssen sich Hersteller nach der MDR/IVDR richten.
Anforderungen, die in der Maschinenrichtlinie genauer geregelt sind als in MDR oder IVDR
- Mechanische Gefährdungen
- Sicherheit und Zuverlässigkeit von Steuerungen und Schutzeinrichtungen
- Risiken durch bewegliche Teile
- Informationen und Warnhinweise
In diesen Fällen müssen sich Hersteller nach der Maschinenrichtlinie richten.
2. Welche Anforderungen die Maschinenrichtlinie an Medizinprodukte stellt
a) Nur spezifische Anforderungen aus Anhang I sind relevant
Fallen Medizinprodukte unter die Maschinenrichtlinie, gelten für sie die speziellen Anforderungen der Regelung.
Hersteller müssen jedoch nicht die komplette Richtlinie prüfen. Sowohl die MDR als auch die IVDR verweisen nur auf den Anhang I der Maschinenrichtlinie. Dies bedeutet:
- Sie müssen nur den Anhang I der Maschinenrichtlinie berücksichtigen.
- Sie müssen nur die Anforderungen berücksichtigen, die über die der MDR bzw. IVDR hinausgehen (s. o. Bedingung 3).
Eine Gegenüberstellung der Anhang I Anforderungen zwischen der MRL, der MDD und der MDR befindet sich in der COCIR Recommendation: Applicability of EHSR of the Machinery Directive (2006/42/EC) to Medical Devices.
b) Risikobeurteilung
In Anhang I listet die Maschinenrichtlinie die konkreten Anforderungen an Produkte auf. Als erste Anforderung nennt die Richtlinie, dass relevante Risiken erhoben und beurteilt werden müssen.
Für die Risikobeurteilung legt die Maschinenrichtlinie spezielle Vorgaben fest, die jedoch mit denen der MDR bzw. IVDR übereinstimmen.
Demnach sind Hersteller verpflichtet:
– die Grenzen der Maschine zu bestimmen, was ihre bestimmungsgemäße Verwendung und jede vernünftigerweise vorhersehbare Fehlanwendung einschließt;
– die Gefährdungen, die von der Maschine ausgehen können, und die damit verbundenen Gefährdungssituationen zu ermitteln;
– die Risiken abzuschätzen unter Berücksichtigung der Schwere möglicher Verletzungen oder Gesundheitsschäden und der Wahrscheinlichkeit ihres Eintretens;
– die Risiken zu bewerten, um zu ermitteln, ob eine Risikominderung gemäß dem Ziel dieser Richtlinie erforderlich ist;
– die Gefährdungen auszuschalten oder durch Anwendung von Schutzmaß nahmen die mit diesen Gefährdungen verbundenen Risiken in der in Nummer 1.1.2 Buchstabe b festgelegten Rangfolge zu mindern.
Quelle: Maschinenrichtlinie Anhang I, Allgemeine Grundsätze
c) Gesundheits- und Sicherheitsschutzanforderungen
Die Maschinenrichtlinie unterscheidet zwischen Gesundheits- und Sicherheitsschutzanforderungen, die für alle Maschinen gelten, und solchen, die nur für bestimmte Maschinen gelten.
Allgemeine Gesundheits- und Sicherheitsschutzanforderungen
Der erste Teil des Anhangs I der Maschinenrichtlinie enthält die allgemeinen Anforderungen, die Hersteller immer berücksichtigen müssen.
Dies sind im Wesentlichen die Grundsätze für die Integration der Sicherheit, die ebenfalls für Medizinprodukte gelten:
- Beseitigung oder Minimierung der Risiken
- Ergreifen der notwendigen Schutzmaßnahmen gegen Risiken
- Unterrichtung der Benutzer über die Restrisiken
Der allgemeine Teil nennt darüber hinaus weitere Anforderungen an:
- Gebrauchstauglichkeit
- Begleitdokumente und Informationen
- Warnhinweise und Kennzeichnung
- Betriebsanleitungen
Auch diese Anforderungen sind Herstellern von Medizinprodukten bereits aus anderen Regelungen vertraut.
Spezielle Gesundheits- und Sicherheitsschutzanforderungen
Die weiteren Teile des Anhangs beziehen sich auf spezielle Gefährdungen. Sie gelten daher nur für Maschinen, bei denen die Gefährdungen, die dort aufgelistet sind, eintreten können.
Spezielle Gefährdungen sind etwa:
- Gefährdungen, die von der Beweglichkeit von Maschinen ausgehen
- Durch Hebevorgänge bedingte Gefährdungen
- Maschinen, die zum Einsatz unter Tage bestimmt sind
- Durch das Heben von Personen bedingte Gefährdungen
Hersteller müssen daher sowohl den ersten Teil als auch die weiteren Teile des Anhangs durchgehen. Sie sollten dabei prüfen, welche Gefährdungen auf ihr Produkt zutreffen. Daraus ergeben sich dann die Anforderungen, die sie nach der Maschinenrichtlinie erfüllen müssen.
3. Wie Sie die Konformität Ihres Produkts nachweisen können
Wenn Ihr Medizinprodukt möglicherweise eine Maschine im Sinne der Maschinenrichtlinie ist, befolgen Sie diese fünf Schritte, um die Konformität nachzuweisen:
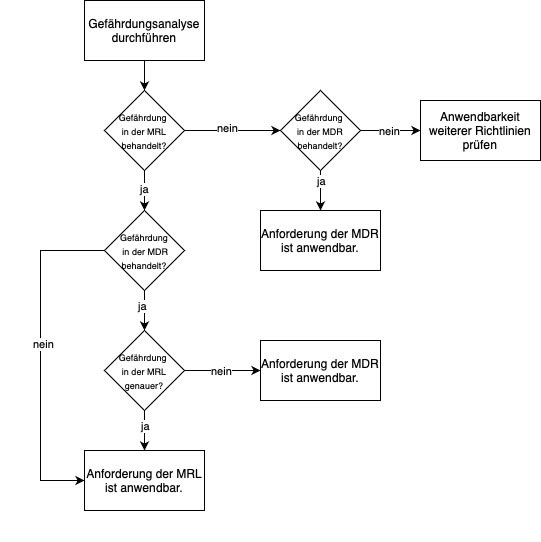
a) Schritt 1: Prüfen Sie, ob eine Maschine vorliegt
Prüfen Sie zunächst, ob Ihr Produkt unter die Definition der Maschine nach Art. 2 Abs. 2 Buchst. a fällt. Falls nicht, ist die Maschinenrichtlinie nicht anwendbar.
Falls Ihr Produkt unter die Definition der Maschine fällt, dann:
b) Schritt 2: Identifizieren Sie Gefährdungen
Prüfen Sie, welche Gefährdungen von Ihrem Produkt ausgehen können. Davon ist unter anderem abhängig, welche Regelung einschlägig ist.
c) Schritt 3: Bestimmen Sie die relevanten Anforderungen
Vergleichen Sie die Anforderungen der Regelungen:
Gehen Sie Anhang I Kap. II der MDR oder IVDR durch und identifizieren Sie, welche der Gefährdungen, die von Ihrem Produkt ausgehen, genannt werden.
Dann gehen Sie Anhang I der Maschinenrichtlinie durch und vermerken, unter welche der genannten Gefährdungen Ihr Produkt dort fällt.
Nun müssen Sie einen Vergleich vornehmen:
- Kann von Ihrem Produkt keine der in der Maschinenrichtlinie genannten Gefährdungen ausgehen? Dann ist nicht die Maschinenrichtlinie einschlägig, sondern die MDR bzw. IVDR.
- Sowohl in der MDR bzw. IVDR als auch in der Maschinenrichtlinie finden sich Gefährdungen, die von Ihrem Produkt ausgehen können? Dann müssen Sie die Regelungen vergleichen. Die genauere Regelung ist die, die für Sie gilt.
Regelt die Maschinenrichtlinie die Gefährdungen, die von Ihrem Produkt ausgehen genauer, müssen Sie sich an die Anforderungen halten, die die Richtlinie stellt (s.o. Punkt 2).
Spezialfall: IVDD-Produkte
Unter der IVDD mussten Hersteller von Laborgeräten für medizinische Zwecke, die auch Maschinen sind, die Maschinenrichtlinie nicht berücksichtigen.
Mit der IVDR wurde die Maschinenrichtlinie nun jedoch in deren Geltungsbereich gebracht. Hersteller von IVDD-Produkten müssen entsprechend dem Stand der Technik prüfen, ob die Maschinenrichtlinie neue Anforderungen beinhaltet, die durch bisherige IVDD-spezifische Normen nicht abgedeckt sind.
Hersteller von IVDD-Produkten sollten daher schnell handeln, da Änderungen bis zum Inkrafttreten der IVDR am 26. Mai 2022 noch unter der IVDD durchgeführt werden können. Mit einer gültigen IVDD-Bescheinigung profitieren Sie von den Übergangsfristen (siehe Artikel 110).
Wenn Sie unsicher sind, sprechen Sie mit Ihrer Benannten Stelle oder dem Johner Institut.
d) Schritt 4: Relevante Normen identifizieren
Einige Anforderungen in Anhang I der Maschinenrichtlinie können teilweise ohne Normenbezug umgesetzt und geprüft werden. Für die übrigen Anforderungen gibt es mehr als 800 sektorspezifische Normen, auf die Hersteller für den Konformitätsnachweis zurückgreifen können.
Die aktuell harmonisierten Normen mit Vermutungswirkung sind im Amtsblatt der Europäischen Union (Stand Amtsblatt 2017) einsehbar oder über den Regulatory Radar zu finden.
Lesen Sie mehr zu harmonisierten Normen im Artikel Harmonisierte Normen: Beweisführung für Medizinproduktehersteller.
Normen-Framework
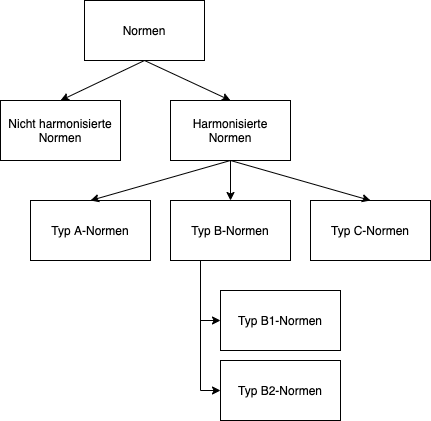
Die Maschinenrichtlinie unterscheidet zwischen den folgenden Normentypen:
- Typ-A-Normen: Sicherheitsgrundnormen mit allgemeinen Gestaltungsgrundsätzen und Definitionen (Bsp. EN ISO 12100 „Sicherheit von Maschinen – Allgemeine Gestaltungsleitsätze – Risikobeurteilung und Risikominderung“)
- Typ B-Normen: Sicherheitsfachgrundnormen, die Sicherheitsaspekte oder Schutzeinrichtungen für Maschinen behandeln
- B1-Normen: Sicherheitsaspekte (Bsp. EN ISO 13854:2019 “Sicherheit von Maschinen – Mindestabstände zur Vermeidung des Quetschens von Körperteilen”)
- B2-Normen: Schutzeinrichtungen (Bsp. EN ISO 13851:2019 “Sicherheit von Maschinen – Zweihandschaltungen – Funktionelle Aspekte und Gestaltungsleitsätze”)
- Typ C-Normen: Maschinensicherheitsnormen für eine bestimmte Maschine oder eine Gruppe von Maschinen (Bsp. EN ISO 4254-11:2010 “Landmaschinen – Sicherheit – Teil 11: Sammelpressen”)
Für Medizinprodukte existieren keine spezifischen Typ-C-Normen. Daher sind für Hersteller von Medizinprodukten, wenn überhaupt, nur die Typ-B-Normen relevant.
Nicht harmonisierte Normen
Für einige medizinische Anwendungen wie Rollstühle oder medizinische Treppenlifte existieren produktspezifische Sicherheitsnormen, die nicht unter MDR, IVDR oder Maschinenrichtlinie harmonisiert sind. Dennoch lässt sich mit diesen Normen die Konformität bewerten.
Im Unterschied zu den harmonisierten Normen besteht dabei aber nicht per se eine Vermutungswirkung für die Konformität des Medizinprodukts mit den grundlegenden Anforderungen der MDR. Das heißt: Hersteller müssen zeigen, welche Abschnitte der Norm als Nachweis für die Erfüllung einer spezifischen Anforderung der MDR bzw. Maschinenrichtlinie geeignet sind. (Harmonisierte Normen beinhalten eine fertige Gegenüberstellung im Anhang ZZ.)
IVD-Produkte
Folgende Normen sind unter anderem für IVD-Produkte relevant.
- IEC 61010-1 “Safety requirements for electrical equipment for measurement, control, and laboratory use Part 1: General requirements”
- IEC 61010-2-101 “Part 2-101: Particular requirements for in vitro diagnostic (IVD) medical equipment”
Die IEC 61010-2-101 behandelt im Kapitel 7 bereits viele der mechanischen Gefährdungen.
e) Schritt 5: Risikomanagement durchführen
Hersteller müssen die Nutzen-Risiko-Analyse durchführen, wie sie im Anhang I von MDR bzw. IVDR beschrieben ist.
Die harmonisierte Norm zur Durchführung dieser Nutzen-Risiko-Analyse ist die ISO 14971. Diese legt einen Risikomanagement-Prozess fest, der eingehalten werden muss. Auch die Anforderungen der Maschinenrichtlinie erfüllt der Prozess der ISO 14971 in den allermeisten Fällen. Daher ist diese die erste Wahl für Medizinprodukte-Hersteller.
In den seltenen Fällen, in denen der Prozess der ISO 14971 nicht zu den Anforderungen der Maschinenrichtlinie passt, können Hersteller auf EN ISO 12100 ausweichen. Deren Prozessmodell besteht aus Risikoanalyse, Risikoeinschätzung und Risikomaßnahmen und ist dasselbe wie in der ISO 14971.
4. Die Richtlinie wird zur Verordnung
Am 26. Juni 2023 hat die EU-Kommission die neue Maschninenverordnung veröffentlicht, die die Maschinenrichtlinie ersetzen soll.
a) Warum es eine Maschinenverordnung gibt
Die aktuelle Version der Maschinenrichtlinie stammt aus dem Jahr 2006. Laut Begründung des Verordnungs-Entwurfs wurden in der Zwischenzeit neue relevante Technologien entwickelt, aus denen sich neue Risiken ergeben.
Hier ist vor allem künstliche Intelligenz (KI) zu nennen, deren Regulierung die EU derzeit ohnehin umtreibt. Ebenfalls 2021 legte die Kommission einen Entwurf für eine KI-Verordnung vor. Lesen Sie mehr zur KI-Verordnung in unserem Blogbeitrag.
Außerdem sollen durch die Verordnung Rechtsunsicherheiten aufgrund des unklaren Anwendungsbereichs der bestehenden Maschinenrichtlinie und nicht einheitlicher Definitionen beseitigt werden.
b) Was das für Hersteller bedeutet
Im Gegensatz zu einer Richtlinie, die sich nur an die EU-Mitgliedsstaaten richtet, ist eine Verordnung unmittelbar für Hersteller bindend.
Darüber hinaus plant die EU auch Änderungen in der neuen Verordnung, die die genannten Probleme beheben sollen. Hersteller müssen sich daher auf einige Neuerungen einstellen. Diese beziehen sich beispielsweise auf Maschinen und Software sowie den Konformitätsnachweis.
c) Timeline
Für Hersteller stellt sich die Frage, ob die Maschinenrichtlinie oder die Maschinenverordnung anzuwenden ist. Gemäß Artikel 51 (2) der Maschinenverordnung (EU) 2023/1230 wird die Richtlinie 2006/42/EG mit Wirkung vom 14. Januar 2027 aufgehoben. Darüber hinaus gelten die Übergangsfristen gemäß Artikel 52 der Verordnung.
5. Fazit
Über den Umweg der Maschinenrichtlinie stellen MDR und IVDR zusätzliche Anforderungen an einige Medizinprodukte, die auch als Maschinen gelten. Dies bedeutet zunächst einen Mehraufwand beim Prüfen der Anforderungen.
Für den Konformitätsnachweis können sich Hersteller jedoch auch im Rahmen der Maschinenrichtlinie weit überwiegend auf vertraute Normen stützen.
Das Johner Institut unterstützt Sie bei Fragen rund um Konformitätsanforderungen von Medizinprodukten, die unter die Maschinenrichtlinie fallen. Melden Sie sich einfach per E-Mail oder über das Kontaktformular.



Lieber Herr Klessascheck,
vielen Dank für den Beitrag. Wenn für das Medizinprodukt die IEC 60601-1 anwendbar ist, dann werden auch schon mechanische Gefährdungen, Risiken durch bewegliche Teile usw. betrachtet und getestet. In wie weit geht die Maschinenrichtlinie über die entsprechenden Anforderungen aus der IEC 60601-1 hinaus?
Viele Grüße
Kay-Uwe Amthor
Lieber Herr Amthor,
das stimmt, die IEC 60601-1 deckt bereits viele mechanische Gefährdungen ab. Die Maschinenrichtlinie ist insbesondere bei Risiken im Zusammenhang mit bewegten Massen und damit verbundenen Bauteilen, wie Ketten oder Rollen spezifischer. Ausserdem finden Sie spezifischere Anforderungen an die Auslegung von trennenden Schutzeinrichtungen gegen Risiken durch bewegliche Teile.
Liebe Grüsse, Mario Klessascheck
Insbesondere bezüglich der spezifischeren Gesundheits- und Sicherheitsanforderungen von Anhang I der Maschinenrichtlinie kann auch das COCIR Recommendation Dokument: “Applicability of EHSR of the Machinery Directive (2006/42/EC) to Medical Devices” sehr hilfreich sein.
Lieber Herr Biehl,
vielen Dank für den sehr wertvollen Tipp. Das Dokument habe ich gleich im Artikel verlinkt.
Danke!
Herzliche Grüsse, Mario Klessascheck
Sehr geehrter Herr Klessascheck,
vielen Dank für Ihren sehr informativen Artikel!
Ihren Ausführungen und Empfehlungen stimme ich im Wesentlichen zu.
An einer entscheidenden Stelle frage ich mich allerdings, ob Ihre These nicht ein wenig zu gewagt ist?
Sie erwecken mit Ihrer Herleitung nach der Anwendbarkeit der Maschinenrichtlinie für Medizinprodukte (einschl. IVD) den Eindruck, als ob die MDR / IVDR „die“ ausschlaggebende Richtlinie sei, nach der sich das Medizinprodukt zu richten hat. Und nur weil dort auch die Maschinenrichtlinie referenziert wird, käme sie in diesem erwähnten Umfang auch zum Tragen.
(Zitat in 2.a.: „Hersteller müssen jedoch nicht die komplette Richtlinie prüfen. Sowohl die MDR als auch die IVDR verweisen nur auf den Anhang I der Maschinenrichtlinie. Dies bedeutet: […]“)
Aber ist es nicht vielmehr so, dass unsere regulatorische Richtlinien-Welt eben _nicht_ hierarchisch aufgebaut ist?
Sondern jede Richtlinie für sich gemäß ihrem Anwendungsbereich für jedes Produkt anzuwenden ist?
So kennen wir auch für die Medizintechnik ein wahres Füllhorn an relevanten Richtlinien, Verordnungen und Gesetzen: neben der Maschinenrichtlinie gibt es da z.B. noch
– Elektromagnetische-Verträglichkeit-Gesetz (EMVG) 2014/30/EU
– Elektro- und Elektronikgerätegesetz (ElektroG) 2012/19/EU
– das allseits bekannte RoHS 2015/863/EU
– Druckgeräte-Richtlinie 2014/68/EU
– Funkanlagen-Richtlinie 2014/53/EU
– Einstufung, Kennzeichnung und Verpackung von Stoffen und Gemischen (CLP) 1272/2008/EG
Um nur Einige zu nennen 😉
Und fällt ein Medizinprodukt unter deren Anwendungsbereich, so gelten die entsprechenden Anforderungen auch für das Produkt – unabhängig davon, ob eine vermeintliche „Haupt-Richtlinie“ diese „Neben-Richtlinie“ nun erwähnt oder nicht?!
Letztlich bestätigt der Hersteller mit dem CE-Zeichen ja auch die Richtlinien-Konformität zu _allen_ relevanten Richtlinien, und nicht nur zur MDR oder IVDR?!
Wenn dem so ist, ergeben sich aber zwei zu Ihrem Artikel abweichende Konsequenzen:
1) Die Maschinenrichtlinie war schon „immer“ (seit Ihrer Fassung von 2006) auch für Medizinprodukte anwendbar und nicht erst seit Einführung der MDR / IVDR. Lediglich ihr Vorgänger enthielt eine – leider bis heute immer wieder gern zitierte – Ausnahme der Anwendbarkeit für Medizinprodukte.
2) Die Maschinenrichtlinie gilt in Gänze auch für Medizinprodukte (wenn sie denn in ihre Anwendbarkeit fällt). Und nicht bloß den in der MDR / IVDR referenzierten Anhang I.
[So wurden wir als Hersteller von IVD-Geräten bereits vor mehreren Jahren (noch unter der IVDD 98/79/EG) von unserer Benannten Stelle dazu aufgefordert, über die IVDD hinausgehende Anforderungen der Maschinenrichtlinie umzusetzen.]
Viel interessanter wird dann aber Artikel 3 der Maschinenrichtlinie selbst – der so oder ähnlich in vielen Richtlinien zu finden ist:
„Spezielle Richtlinien
Werden die in Anhang I genannten, von einer Maschine ausgehenden
Gefährdungen ganz oder teilweise von anderen
Gemeinschaftsrichtlinien genauer erfasst, so gilt diese Richtlinie
für diese Maschine und diese Gefährdungen nicht bzw. ab dem
Beginn der Anwendung dieser anderen Richtlinien nicht mehr.“
Was dann letztlich zu einer Gegenüberstellung der Anforderung beider „spezieller Richtlinien“ führt, so wie Sie es im Wesentlichen ja auch vorschlagen. Nur eben vollumfassend und nicht begrenzt auf Anhang I.
An dieser Stelle sei auch auf einen anderen empfehlenswerten Johner Blog zum Thema Medizinprodukte und Maschinenrichtlinie hingewiesen:
https://www.johner-institut.de/blog/regulatory-affairs/ivd-in-vitro-diagnostika/
Dort kam Herr Prof. Johner zu einer ähnlichen – aber eben nicht gleichen – Meinung wie Sie.
Sein Tip der Gegenüberstellung der Forderungen beider Richtlinien galt explizit auch bereits für die IVDD und ohne Einschränkung auf Anhang I.
In gespannter Erwartung Ihrer Einschätzung dazu
mit herzlichen Grüßen
Martin Schroeder
Lieber Herr Schröder,
Sie haben völlig recht, Hersteller müssen immer die Anwendbarkeit weiterer Rechtsvorschriften und Gesetze prüfen.
Die beiden Verordnungen MDR/IVDR verweisen im Artikel 12 (MDR) und im Artikel 6 (IVDR) explizit auf den Anhang I der MRL. Damit werden die Sicherheits- und Gesundheitsschutzanforderungen der MRL in die MDR bzw. IVDR eingefügt. Alle weiteren Pflichten im Zusammenhang mit der Inverkehrbringung sind in der MDR/IVDR spezifischer festgelegt.
Die (noch gültige) IVDD schliesst im Artikel 12 die MRL für Laborapparate mit mechanischen Merkmalen aus. Der VDGH hat in seinem Dokument „Allgemeine Informationen zu den gesetzlichen Anforderungen und denen der Normen an IVD-Geräte“ eine gleiche Meinung. Der Einschluss der MRL kam erst mit dem Artikel 6 in der IVDR. Dass Sie die MRL schon immer berücksichtigt haben, zeigt Ihre Umsichtigkeit.
Nochmals vielen Dank für Ihre wertvollen Gedanken und Ihr aufmerksames Lesen.
Liebe Grüsse, Mario Klessascheck