Das Ziel der Systementwicklung (Systems Engineering) besteht darin, Systeme – in diesem Kontext Medizinprodukte – systematisch in der geplanten Zeit und Qualität zu entwickeln.
Inhalt
Diese Seite hilft Herstellern von Medizinprodukten und deren Dienstleistern, einen Überblick über das Systems Engineering zu erlangen und dazu weitere Fachartikel zu finden:
- Artikel zu Prozessen und Aktivitäten im Produkt-Lebenszyklus
- Artikel zur IEC 60601-1-Familie und zur physikalischen Sicherheit
- Artikel zu Biokompatibilität, Sterilität und Aufbereitung
Definition von Systems Engineering
Gemäß der Definition ISO/IEC 15940 ist Systems Engineering …
… ein interdisziplinärer Ansatz, der den gesamten technischen und verwaltungstechnischen Aufwand regelt, der erforderlich ist, um eine Reihe von Bedürfnissen, Erwartungen und Einschränkungen der Interessengruppen in eine Lösung umzusetzen und diese Lösung während ihrer gesamten Lebensdauer zu unterstützen.
Diese Definition des Systems Engineerings hat auch Wikipedia übernommen.
Die ISO/IEC/IEEE 21841 spricht von einem Prozess der Planung, Analyse, Organisation, Entwicklung und Integration.
1. Artikel zu Prozessen und Aktivitäten
a) Prozesse
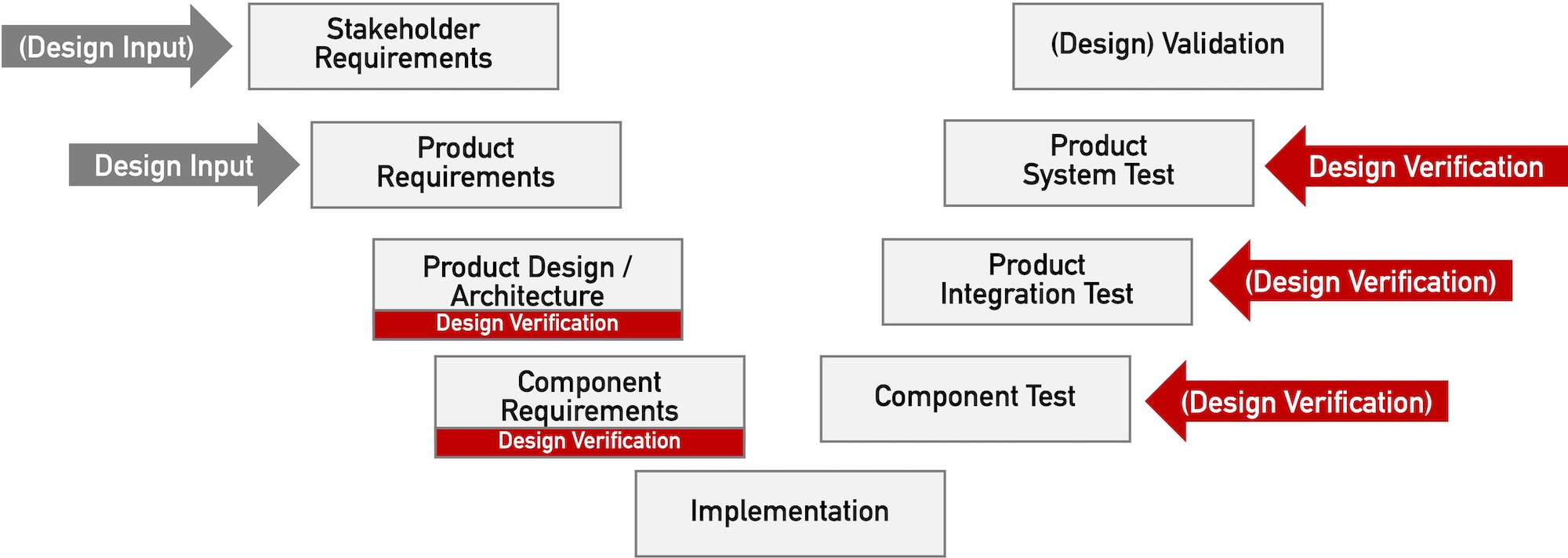
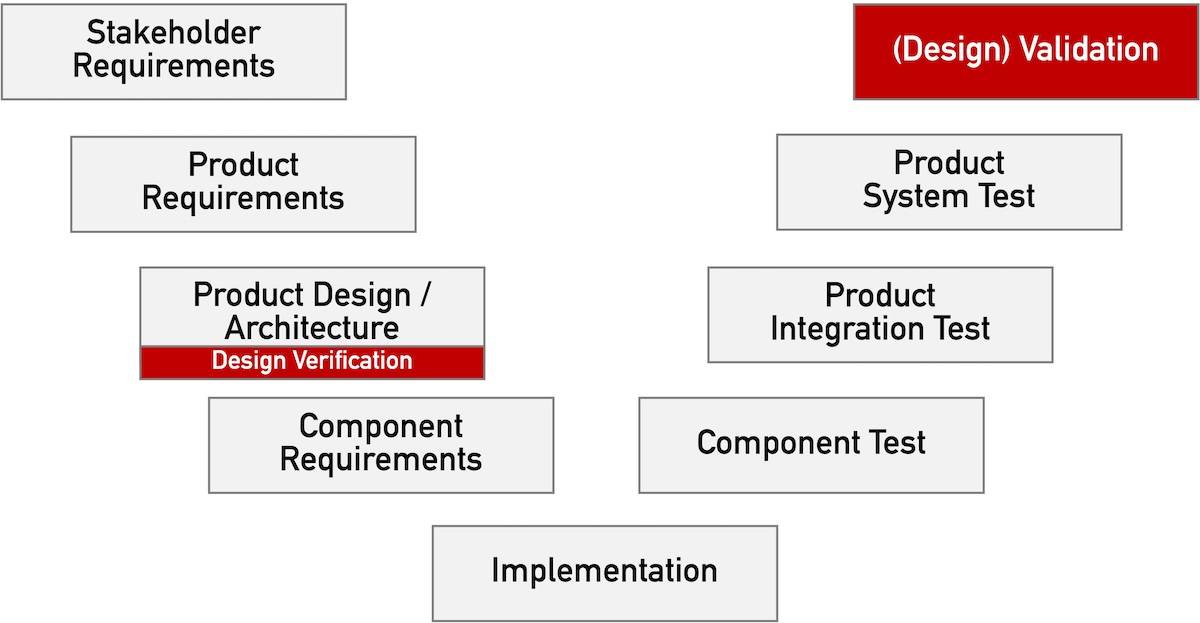
Das V-Modell ist ein bekanntes Modell für den Entwicklungsprozess. Bei der (agilen) Entwicklung von Medizinprodukten eignet es sich als Dokumentationsmodell.
Im Rahmen dieses Prozesses führen Hersteller verschiedene Tätigkeiten durch, zu denen weitere Artikel Handlungsleitung geben. Sie können für diese Tätigkeiten ein eigenes Entwicklungsteam aufbauen oder/und Tätigkeiten durch Dritte durchführen lassen.
Im letzteren Fall sind diese Artikel relevant:
b) Zweckbestimmung formulieren und Anforderungen erheben
c) Systeme entwerfen
d) Systeme verifizieren und validieren
e) Weitere Phasen im Lebenszyklus
Hinweise und weiterführende Informationen
Das Usability Engineering und damit auch die Verifizierung und Validierung der Gebrauchstauglichkeit zählen auch zum Systems Engineering. Sie finden unter dem Link weitere Informationen zum Systems Engineering.
Das Risikomanagement stellt eine Besonderheit des Systems Engineerings bei Medizinprodukten dar. Sie finden unter dem Link eine Übersicht über die Fachartikel zum Risikomanagement.
2. Artikel zur IEC 60601-1-Familie und zur physikalischen Sicherheit
a) Regulatorische Anforderungen
Die Basis der regulatorischen Anforderungen bilden die EU-Verordnungen bzw. Richtlinien:
Die zentrale Norm ist die IEC 60601-1. Sie wurde 2019 durch ein 2. Amendment erweitert. Für IVD ist die IEC 61010-1 relevant.
Zu den Konzepten der Norm(en) zählen:
Relevant sind neben der Grundnorm auch die Partikularnormen:
Bei den Nachweisen greifen viele Hersteller auf die CB Reports/CB-Berichte zurück.
b) Umsetzung der Anforderungen bei bestimmten Systemen und Situationen
- Systeme,Geräte
- Komponenten, Bauteile
3. Artikel zu Biokompatibilität, Sterilität und Aufbereitung
Für Produkte, die mit dem menschlichen Körper in Kontakt kommen sollen, gibt es spezielle Normen:
Die ISO 17664 ist bei der Aufbereitung von Medizinprodukten relevant.
Beachten Sie auch unseren Artikel zu den stofflichen Medizinprodukten.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Entwicklung, Prüfung und Zulassung Ihres Medizinprodukts? Dann nutzen Sie das kostenfreie Micro-Consulting.
Wünschen Sie Unterstützung dabei, Ihre Medizingeräte gesetzeskonform zu entwickeln, deren Sicherheit zu prüfen und „zuzulassen“? Das Team des Johner Instituts hilft gerne! Nehmen Sie Kontakt auf!
Die Normenfamilie IEC 61010 stellt Sicherheitsanforderungen an elektrische Mess-, Steuer-, Regel- und Laborgeräte. Die Basisnorm IEC 61010-1 und die Partikularnormen der Serie IEC 61010-2 beschreiben den Stand der Technik und dienen damit IVD-Herstellern zum Nachweis der grundlegenden Sicherheits- und Leistungsanforderungen von Anhang I der IVD-Verordnung (IVDR).
Die korrekte und präzise Formulierung der Zweckbestimmung von Medizinprodukten und In-Vitro-Diagnostika (IVD) ist entscheidend für deren erfolgreiche Entwicklung und Zulassung. Doch bereits die Begriffsdefinitionen und die Abgrenzung von Zweckbestimmung und bestimmungsgemäßem Gebrauch erschweren die notwendige Klarheit und Präzision. Dieser Artikel verrät, wie Sie eine Zweckbestimmung formulieren, um Schwierigkeiten bei Audits und Zulassungen zu vermeiden.
Details
Medizinprodukte über das Ende der Lebensdauer hinaus zu betreiben kann gefährlich und rechtlich problematisch sein. Daher sollten Hersteller die genaue Lebensdauer bei jedem Produkt präzise bestimmen. Doch könnten Sie auf die Schnelle sagen, wie Lebensdauer definiert oder nach welchen Kriterien sie bestimmt wird? Verwandte Begriffe wie „Nutzungsdauer“, “Haltbarkeit”, “Betriebszeit” bzw. „Service Life“ und „Shelf Life“…
Details
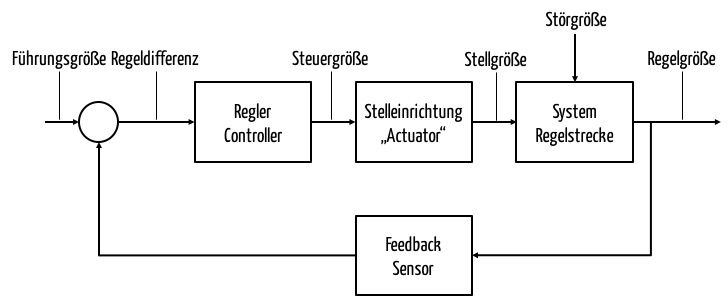
Medizinprodukte basieren zunehmend auf Closed-Loop-Systemen. Diese „geschlossenen Regelsysteme“ finden bereits in der Medizinprodukteverordnung MDR Erwähnung. Ein Beispiel ist ein System aus einer Insulinpumpe, die von einem Gerät mit Glukosesensor gesteuert wird. Sie erfahren in diesem Artikel, was Closed-Loop-Systeme sind, wo sie in der Medizin zum Einsatz kommen und welche regulatorischen Anforderungen sie erfüllen müssen. Der…
Details
Die Forderung nach „Design Verification“ erhebt keinesfalls nur die FDA. Dieser Beitrag beschreibt, was unter „Design Verification“ zu verstehen ist und welche regulatorischen Forderungen Medizinproduktehersteller erfüllen sollten.
ASCA steht für Accreditation Scheme for Conformity Assessment. Das Verfahren soll Konformitätsbewertungen und damit Zulassungsverfahren beschleunigen. Es ist aber weder bei allen Produkten noch bei allen Märkten anwendbar. Wer von ASCA profitiert und wie das Verfahren abläuft, erläutert dieser Artikel.
Details
Den Begriff „Design Validation“ assoziieren die meisten Medizinproduktehersteller mit der FDA. Doch nicht nur die FDA, sondern auch die europäischen Regularien, insbesondere die ISO 13485, fordern eine Validierung von Design und Entwicklung. Dabei sollten allerdings „Design Validation“ und Validierung des Designs nicht verwechselt werden. Wie sich beide unterscheiden und welche regulatorischen Anforderungen zu beachten sind, zeigt…
Details
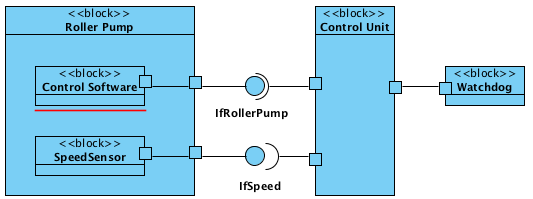
Die Systemarchitektur beschreibt, aus welchen Komponenten ein (Medizin)produkt zusammengesetzt ist und wie diese Komponenten über Schnittstellen miteinander in Beziehung stehen. Bei Standalone-Software fallen Systemarchitektur und Software-Architektur zusammen.
Regularien wie die MDR fordern den Nachweis der Biokompatibilität aller Materialien, die mit Patienten oder Anwendern direkt oder indirekt in Kontakt kommen.
Wie unterscheiden sich Verifizierung und Validierung und wie sind diese Begriffe definiert? Selbst Normen und Gesetze verwenden die Begriffe falsch oder missverständlich. Dieser Artikel
Details