Das Ziel der Systementwicklung (Systems Engineering) besteht darin, Systeme – in diesem Kontext Medizinprodukte – systematisch in der geplanten Zeit und Qualität zu entwickeln.
Inhalt
Diese Seite hilft Herstellern von Medizinprodukten und deren Dienstleistern, einen Überblick über das Systems Engineering zu erlangen und dazu weitere Fachartikel zu finden:
- Artikel zu Prozessen und Aktivitäten im Produkt-Lebenszyklus
- Artikel zur IEC 60601-1-Familie und zur physikalischen Sicherheit
- Artikel zu Biokompatibilität, Sterilität und Aufbereitung
Definition von Systems Engineering
Gemäß der Definition ISO/IEC 15940 ist Systems Engineering …
… ein interdisziplinärer Ansatz, der den gesamten technischen und verwaltungstechnischen Aufwand regelt, der erforderlich ist, um eine Reihe von Bedürfnissen, Erwartungen und Einschränkungen der Interessengruppen in eine Lösung umzusetzen und diese Lösung während ihrer gesamten Lebensdauer zu unterstützen.
Diese Definition des Systems Engineerings hat auch Wikipedia übernommen.
Die ISO/IEC/IEEE 21841 spricht von einem Prozess der Planung, Analyse, Organisation, Entwicklung und Integration.
1. Artikel zu Prozessen und Aktivitäten
a) Prozesse
Das V-Modell ist ein bekanntes Modell für den Entwicklungsprozess. Bei der (agilen) Entwicklung von Medizinprodukten eignet es sich als Dokumentationsmodell.
Im Rahmen dieses Prozesses führen Hersteller verschiedene Tätigkeiten durch, zu denen weitere Artikel Handlungsleitung geben. Sie können für diese Tätigkeiten ein eigenes Entwicklungsteam aufbauen oder/und Tätigkeiten durch Dritte durchführen lassen.
Im letzteren Fall sind diese Artikel relevant:
b) Zweckbestimmung formulieren und Anforderungen erheben
c) Systeme entwerfen
d) Systeme verifizieren und validieren
e) Weitere Phasen im Lebenszyklus
Hinweise und weiterführende Informationen
Das Usability Engineering und damit auch die Verifizierung und Validierung der Gebrauchstauglichkeit zählen auch zum Systems Engineering. Sie finden unter dem Link weitere Informationen zum Systems Engineering.
Das Risikomanagement stellt eine Besonderheit des Systems Engineerings bei Medizinprodukten dar. Sie finden unter dem Link eine Übersicht über die Fachartikel zum Risikomanagement.
2. Artikel zur IEC 60601-1-Familie und zur physikalischen Sicherheit
a) Regulatorische Anforderungen
Die Basis der regulatorischen Anforderungen bilden die EU-Verordnungen bzw. Richtlinien:
Die zentrale Norm ist die IEC 60601-1. Sie wurde 2019 durch ein 2. Amendment erweitert. Für IVD ist die IEC 61010-1 relevant.
Zu den Konzepten der Norm(en) zählen:
Relevant sind neben der Grundnorm auch die Partikularnormen:
Bei den Nachweisen greifen viele Hersteller auf die CB Reports/CB-Berichte zurück.
b) Umsetzung der Anforderungen bei bestimmten Systemen und Situationen
- Systeme,Geräte
- Komponenten, Bauteile
3. Artikel zu Biokompatibilität, Sterilität und Aufbereitung
Für Produkte, die mit dem menschlichen Körper in Kontakt kommen sollen, gibt es spezielle Normen:
Die ISO 17664 ist bei der Aufbereitung von Medizinprodukten relevant.
Beachten Sie auch unseren Artikel zu den stofflichen Medizinprodukten.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Entwicklung, Prüfung und Zulassung Ihres Medizinprodukts? Dann nutzen Sie das kostenfreie Micro-Consulting.
Wünschen Sie Unterstützung dabei, Ihre Medizingeräte gesetzeskonform zu entwickeln, deren Sicherheit zu prüfen und „zuzulassen“? Das Team des Johner Instituts hilft gerne! Nehmen Sie Kontakt auf!
Ein CB Report ist ein Prüfbericht, der von einem akkreditierten CB Testlabor (CBTL) erstellt wird. Er kann als Grundlage für nationale Zertifizierungen und Zulassungen dienen. Test- und Prüflabore wie zahlreiche TÜVs oder der VDE bieten Prüfungen konform mit dem „CB Scheme“ an. Sie erstellen als Ergebnis solche CB Reports. Wann Medizinproduktehersteller diese CB Reports überhaupt benötigen, erfahren Sie…
Details
Die ISO/IEC 15408-1 trägt den Titel „Information technology — Security techniques — Evaluation criteria for IT security — Part 1: Introduction and general model“. Sie beschreibt ganz allgemein, wie man bei der Bewertung der IT-Sicherheit z.B. von Produkten vorgehen soll. Die konkreten Hinweise, wie geprüft werden soll, finden sich in dem zweiten und dritten Teil…
Details
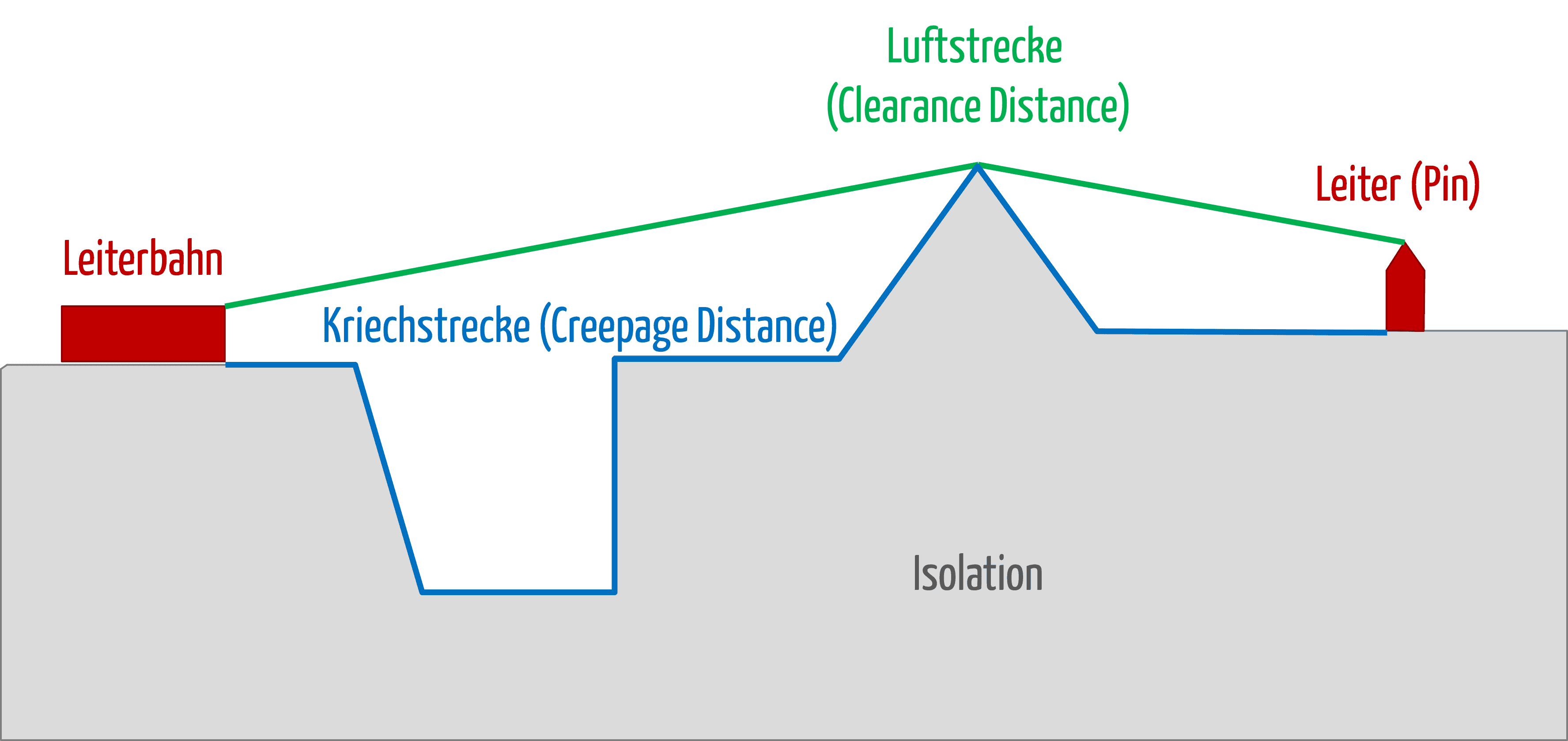
MOPP, MOOP und MOP: Die Norm für medizinische elektrische Geräte IEC 60601-1 benutzt diese Akronyme für „Means of Patient Protection“, „Means of Operator Protection“ und „Means of Protection“. Was es mit diesen zentralen Begriffen der Norm auf sich hat und welche Anforderungen mit ihnen verbunden sind, erfahren Sie in diesem Artikel.
Besonders große Medizintechnik-Hersteller nutzen das Outsourcing, um Teile der Wertschöpfungskette auszulagern. Verschaffen Sie sich in diesem Artikel einen Überblick über die Chancen und Risiken des Outsourcings und über die Besonderheiten bei Medizinprodukten.
Beim Wort „Produktmanager“ oder „Produktmanagement“ verdrehen viele Entwickler die Augen. Die Zusammenarbeit der beiden Abteilungen ist oft von Reibungsverlusten geprägt. Lesen Sie hier, weshalb dem so ist und was Sie dagegen machen können.
Eine Schichtenarchitektur ist ein Architekturstil, der häufig bei Software-Systemen Anwendung findet. Vielen Herstellern sind die Nachteile eine mehrschichtigen Architektur und eines Denkens in Layern nicht bewusst.
Die IEC 60601-1 definiert ein PESS, ein programmierbares elektronisches Subsystem, als System, das auf einer oder mehreren zentralen Prozessoreinheiten beruht, einschließlich deren Software und Schnittstellen. Die Norm verrät nicht, was sie unter System versteht, es ist in diesem Kontext eine Komponente des Medizinprodukts. Dafür stellt die IEC 60601-1 konkrete Anforderungen an die PESS.
Details
Medizingeräte verfügen über zahlreiche Hardware-Schnittstellen. Diese sollten Hersteller genau dokumentieren, um das Produkt ohne unnötige Nachbesserungen entwickeln, Testfälle ableiten und regulatorische Forderungen erfüllen zu können. Dieser Beitrag gibt Tipps, wie es Ihnen gelingen wird, die Hardware-Schnittstellen Ihrer Medizinprodukte schnell und präzise zu spezifizieren.
Details
IT-Projekte werden nicht nur im Gesundheitswesen mit einem der folgenden Ziele gestartet: Effektivität und Effizienz erhöhen z.B. von Prozessen oder Systemen Gesetzliche Anforderungen erfüllen Bestehende Systeme ablösen Innovation z.B. in neue Produkte oder Märke tätigen Gründe fürs Scheitern von IT-Projekten » Kosten für IT-Projekte richtig berechnen » Projektauftrag korrekt formulieren »
Details
Die UML, die Unified Modeling Language, ist eine standardisierte Sprache, mit der sich Software, aber auch ganze Systeme beschreiben lassen. Durch die wenigen aber genau definierten Notationselemente der UML sind Hersteller befähigt, Sachverhalten eindeutig und präzise zu beschreiben und so Anforderungen z.B. der IEC 60601-1 und IEC 62304 zu erfüllen. Inhaltsübersicht Modellierung der Wirklichkeit » Modellierung von…
Details