Das Ziel der Systementwicklung (Systems Engineering) besteht darin, Systeme – in diesem Kontext Medizinprodukte – systematisch in der geplanten Zeit und Qualität zu entwickeln.
Inhalt
Diese Seite hilft Herstellern von Medizinprodukten und deren Dienstleistern, einen Überblick über das Systems Engineering zu erlangen und dazu weitere Fachartikel zu finden:
- Artikel zu Prozessen und Aktivitäten im Produkt-Lebenszyklus
- Artikel zur IEC 60601-1-Familie und zur physikalischen Sicherheit
- Artikel zu Biokompatibilität, Sterilität und Aufbereitung
Definition von Systems Engineering
Gemäß der Definition ISO/IEC 15940 ist Systems Engineering …
… ein interdisziplinärer Ansatz, der den gesamten technischen und verwaltungstechnischen Aufwand regelt, der erforderlich ist, um eine Reihe von Bedürfnissen, Erwartungen und Einschränkungen der Interessengruppen in eine Lösung umzusetzen und diese Lösung während ihrer gesamten Lebensdauer zu unterstützen.
Diese Definition des Systems Engineerings hat auch Wikipedia übernommen.
Die ISO/IEC/IEEE 21841 spricht von einem Prozess der Planung, Analyse, Organisation, Entwicklung und Integration.
1. Artikel zu Prozessen und Aktivitäten
a) Prozesse
Das V-Modell ist ein bekanntes Modell für den Entwicklungsprozess. Bei der (agilen) Entwicklung von Medizinprodukten eignet es sich als Dokumentationsmodell.
Im Rahmen dieses Prozesses führen Hersteller verschiedene Tätigkeiten durch, zu denen weitere Artikel Handlungsleitung geben. Sie können für diese Tätigkeiten ein eigenes Entwicklungsteam aufbauen oder/und Tätigkeiten durch Dritte durchführen lassen.
Im letzteren Fall sind diese Artikel relevant:
b) Zweckbestimmung formulieren und Anforderungen erheben
c) Systeme entwerfen
d) Systeme verifizieren und validieren
e) Weitere Phasen im Lebenszyklus
Hinweise und weiterführende Informationen
Das Usability Engineering und damit auch die Verifizierung und Validierung der Gebrauchstauglichkeit zählen auch zum Systems Engineering. Sie finden unter dem Link weitere Informationen zum Systems Engineering.
Das Risikomanagement stellt eine Besonderheit des Systems Engineerings bei Medizinprodukten dar. Sie finden unter dem Link eine Übersicht über die Fachartikel zum Risikomanagement.
2. Artikel zur IEC 60601-1-Familie und zur physikalischen Sicherheit
a) Regulatorische Anforderungen
Die Basis der regulatorischen Anforderungen bilden die EU-Verordnungen bzw. Richtlinien:
Die zentrale Norm ist die IEC 60601-1. Sie wurde 2019 durch ein 2. Amendment erweitert. Für IVD ist die IEC 61010-1 relevant.
Zu den Konzepten der Norm(en) zählen:
Relevant sind neben der Grundnorm auch die Partikularnormen:
Bei den Nachweisen greifen viele Hersteller auf die CB Reports/CB-Berichte zurück.
b) Umsetzung der Anforderungen bei bestimmten Systemen und Situationen
- Systeme,Geräte
- Komponenten, Bauteile
3. Artikel zu Biokompatibilität, Sterilität und Aufbereitung
Für Produkte, die mit dem menschlichen Körper in Kontakt kommen sollen, gibt es spezielle Normen:
Die ISO 17664 ist bei der Aufbereitung von Medizinprodukten relevant.
Beachten Sie auch unseren Artikel zu den stofflichen Medizinprodukten.
Benötigen Sie Unterstützung?
Haben Sie noch Fragen, beispielsweise zur Entwicklung, Prüfung und Zulassung Ihres Medizinprodukts? Dann nutzen Sie das kostenfreie Micro-Consulting.
Wünschen Sie Unterstützung dabei, Ihre Medizingeräte gesetzeskonform zu entwickeln, deren Sicherheit zu prüfen und „zuzulassen“? Das Team des Johner Instituts hilft gerne! Nehmen Sie Kontakt auf!
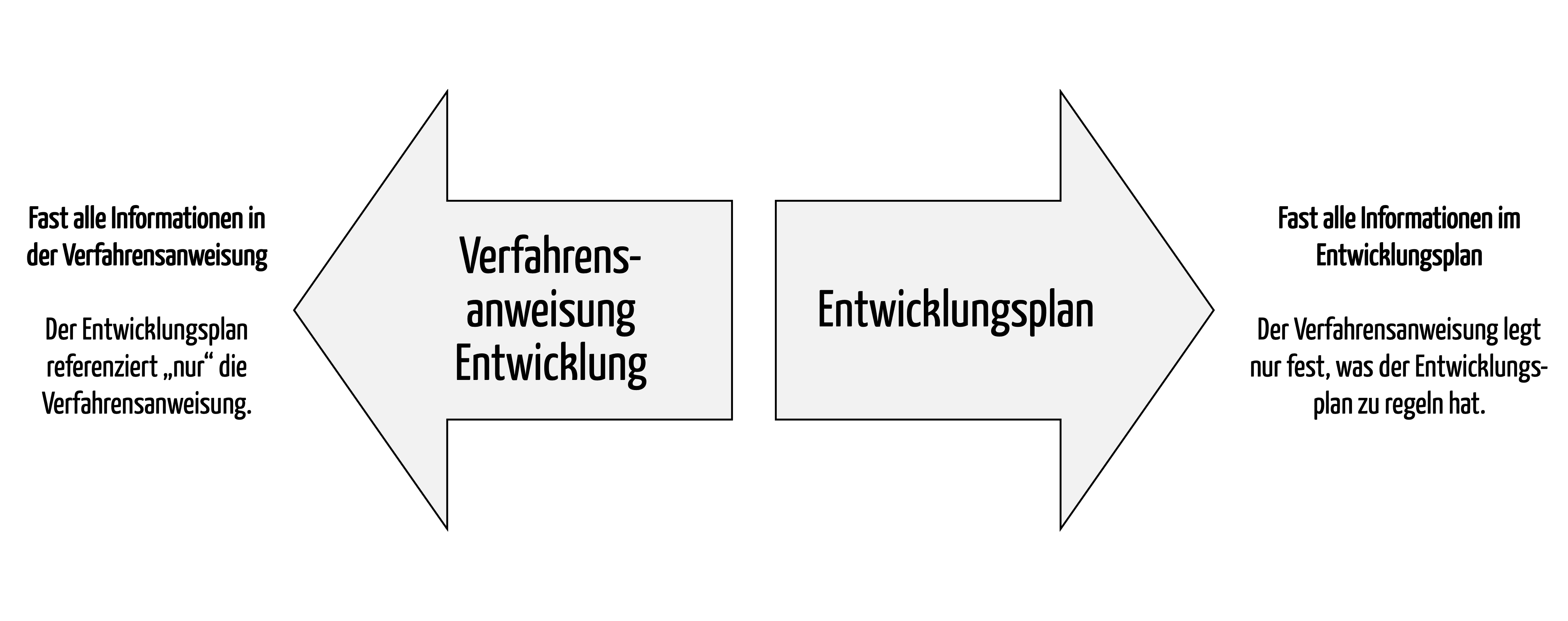
Medizinproduktehersteller sind verpflichtet, sowohl den Entwicklungsprozess zu beschreiben als auch einen Entwicklungsplan zu erstellen. Weil beide Dokumente Vorgaben dazu machen, wie Medizinprodukte zu entwickeln sind, gibt es Unsicherheit darüber, welche Information in welches Dokument gehört. Dieser Artikel löst das auf und betrachtet dabei auch die Software. Er geht ein auf den Software-Entwicklungsplan und die Beschreibung…
Details
Gesetze und Normen formulieren Anforderungen, wie Medizinproduktehersteller den Entwicklungsprozess festlegen und dokumentieren müssen. Diese Anforderungen prüfen Benannte Stellen bei Audits. Dieser Artikel zum Entwicklungsprozess gibt Ihnen Tipps zu dessen Gestaltung und zum Abgleich mit anderen Prozessen wie dem Risikomanagementprozess.
Details
Viele Lastenhefte und Pflichtenhefte unterscheiden funktionale Anforderungen und nicht-funktionale Anforderungen. Funktionale Anforderungen sind Anforderungen mit Bezug zur Zweckbestimmung des Produkts. Zu den nicht-funktionale Anforderungen zählen Anforderungen wie die Zuverlässigkeit und das Zeitverhalten. Dieser Artikel hilft mit Beispielen, beide Anforderungstypen zu unterscheiden, und erläutert die Auswirkung auf deren Dokumentation.
Details
Medizinprodukte müssen die gesetzlichen Anforderungen an die funktionale Sicherheit, auch Funktionssicherheit und „functional safety“ genannt, erfüllen. Leider verwenden und definieren die relevanten Normen und Gesetze für Medizinprodukte den Begriff „funktionale Sicherheit“ nicht. Dieser Artikel verschafft Klarheit.
Details
Die EN ISO 17664-1:2021 trägt den Titel „Aufbereitung von Produkten für die Gesundheitsfürsorge – Vom Medizinprodukt-Hersteller bereitzustellende Informationen für die Aufbereitung von Medizinprodukten“.
Im Mai 2016 wurde die deutsche Ausgabe der IEC 60601-1-2:2014 (Edition 4) als DIN EN 60601-1-2:2016 mit dem Titel Elektromagnetische Störgrößen – Anforderungen und Prüfungen veröffentlicht. Ende 2020 folgte die um das Amendment 1 (AMD 1) ergänzte und als Edition 4.1 bezeichnete Ausgabe dieser „EMV-Norm“.
Details
Das Threat Modeling ist für Sie ein „Pflichtthema“, wenn Sie Medizinprodukte herstellen, die Software enthalten oder die Software sind. Denn das Threat Modeling ist ein strukturierter Prozess zur systematischen Analyse von IT-Sicherheitsrisiken, den Auditoren als den „Stand der Technik“ voraussetzen.
Viele Startups müssen ein Entwicklungsteam aufbauen. Auch etablierte Hersteller stehen regelmäßig vor der Aufgabe, bestehende Entwicklungsteams zu erweitern, aufzuteilen oder neu auszurichten. Dabei können sie von den Best Practices der Startups lernen und so die Produktivität ihres Entwicklungsteams, seine Effizienz und die Motivation der Teammitglieder erhöhen. Einige dieser Best Practices stellt dieser Artikel übersichtlich und…
Details
Mit einem Zytotoxizitätstest lässt sich eine Probe daraufhin überprüfen, wie stark diese die menschlichen Zellen schädigen oder sogar den Tod dieser Zellen verursachen kann. Normen und Gesetze verlangen von den Herstellern nachzuweisen, dass ihre Produkte nicht zytotoxisch sind. Mit einem guten Testaufbau gelingt der Nachweis, ob eine Probe 100 % zytotoxisch, d.h. stark zytotoxisch ist,…
Details
Die Maschinenrichtlinie (2006/42/EG) ist allgemein auf Maschinen aller Art anwendbar. Doch auch für die Hersteller von Medizinprodukten kann die Richtlinie relevant sein: Sowohl die MDR als auch die IVDR verweisen auf sie.