| Inhaltsübersicht |
|---|
| Begriffsdefinitionen » |
| Regulatorische Anforderungen » |
| Design Validation bei Software » |
Eine weiterer häufiger Fehler bei Software-Entwicklern besteht darin, die „Design Validation“ mit der Validierung des (Software-)Designs zu verwechseln.
Definition des Begriffs Design Validation
Die FDA definiert den Begriff Design Validation als „establishing by objective evidence that device specifications conform with user needs and intended use(s)“.
D.h. die Design Validation ist die Überprüfung, ob die Spezifikationen, die sich aus der Entwicklung ergeben, der Zweckbestimmung und den Erfordernissen der Anwender entsprechen.
Leider definiert die FDA den Begriff „user needs“ nicht. Eine Definition des Begriffs „Erfordernis“ (user need) liefert die ISO/IEC 25060:2014: Demnach ist ein Erfordernis eine für einen Benutzer oder eine Benutzergruppe als notwendig identifizierte Voraussetzung, um ein angestrebtes Arbeitsergebnis innerhalb eines bestimmten Nutzungskontextes zu erreichen“.
Design Validation: Was regulatorisch verlangt ist
Forderungen der FDA
Die FDA verlangt mit Bezug zur Design Validation (21 CFR part 820.30 (g)):
Each manufacturer shall establish and maintain procedures for validating the device design. Design validation shall be performed under defined operating conditions on initial production units, lots, or batches, or their equivalents. Design validation shall ensure that devices conform to defined user needs and intended uses and shall include testing of production units under actual or simulated use conditions. Design validation shall include software validation and risk analysis, where appropriate. The results of the design validation, including identification of the design, method(s), the date, and the individual(s) performing the validation, shall be documented in the DHF.
In diesem Abschnitt konkretisiert die FDA, was bei der Design Validation zu tun ist, außer definitionsgemäß zu prüfen, ob wie oben geschrieben, die Spezifikationen, die sich aus der Entwicklung ergeben, der Zweckbestimmung und den Erfordernissen der Anwender entsprechen:
- Die Hersteller müssen prüfen, ob die Medizinprodukte (und nicht nur deren Spezifikation) die Zweckbestimmung und Erfordernisse erfüllen
- Diese Prüfung muss im definierten Nutzungskontext erfolgen.
- Für die Prüfung sind Produkte eingesetzt werden, die der Produktion entstammen bzw. solchen Produkten entsprechen.
- Die Design Validierung muss die Software Validierung und das Risikomanagement einschließen.
Fazit: Die Design Validation ist die „ganz normale“ Validierung des Medizinprodukts bzw. eines Baumusters (und nicht nur die Prüfung von Spezifikationen). Bei nicht stand-alone Software würde eine abschließende Validierung noch Produktionsaspekte berücksichtigen, die nicht Gegenstand der Design Validierung sind.

Forderungen der ISO 13485
Die ISO fordert im Kapitel 7.3.6 „Design and Development Validation“ (auf deutsch: Design- und Entwicklungsvalidierung“) ebenso, dass man prüfen muss, ob das resultierende Produkt die Zweckbestimmung erfüllt. Im Gegensatz zur FDA fordert die ISO 13485 die klinische Bewertung als Teil der Design Validierung.
Design Validierung bei (standalone) Software
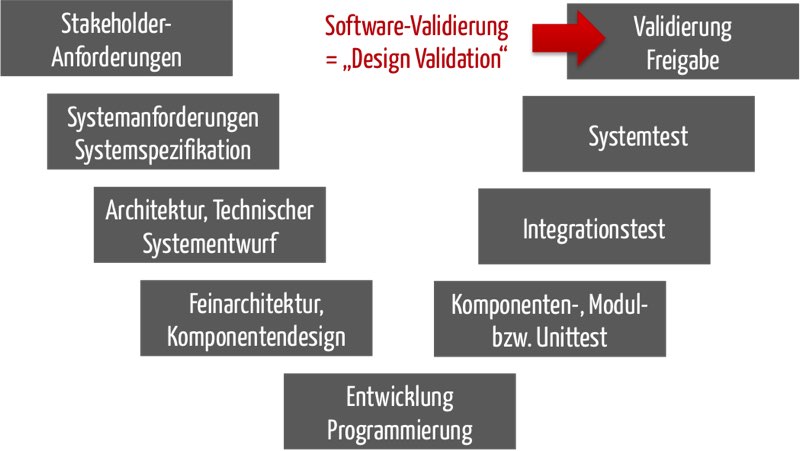
Viele Entwickler von standalone Software assoziieren mit „Design“ die Software-Architektur, zumal die FDA und IEC 62304 Design im Software-Kontext so verwenden.
Eine Design Validation entspricht aber nicht (nur) der Prüfung, ob eine Software-Architektur (oder ein „Software Design“) geeignet ist, die Zweckbestimmung bzw. die Erfordernisse oder Anforderungen der Anwender zu erfüllen. Diese Prüfung bezeichnet die IEC 62304 als Verifizierung. Vielmehr entspricht bei standalone Software die Design Validation der Validierung des ganzen Produkts, da es kaum Produktionsaspekte zu beachten gilt.
Die Design Validierung ist also nicht die „Validierung des Software-Designs“. Sie entspricht der Validierung der Software einschließlich der Usability Validierung.
Lesen Sie hier mehr zur Validierung von Medizinprodukten.




Für mich klingt das nach dem exakt selben was ich in der HF Validierung machen muss. Sehen sie einen Unterschied in der Design Validierung und der Human Factors Validierung?
Besten Dank, Herr Schmid, für die Frage!
Die HF Validierung ist Teil der Design Validierung. Die klinische Bewertung ist ein weiterer Teil (s.a. ISO 13485). Somit ist die HF Validierung eine Untermenge.
Beste Grüße, Christian Johner