Medizinprodukte-Hersteller sind verpflichtet, klinische Daten vor und nach der Zulassung ihrer Produkte systematisch zu sammeln und auszuwerten.
Die EU-Medizinprodukteverordnung MDR hat die Anforderungen an den Umfang und die Qualität dieser klinischen Daten erhöht.
Dieser Artikel verschafft Ihnen einen Überblick über die regulatorischen Anforderungen und gibt Tipps, welche klinischen Daten Medizinproduktehersteller auf welche Weise sammeln und bewerten können, um regulatorische Probleme zu vermeiden.
Viele Hersteller sind sich nicht bewusst, welche Bedeutung die klinischen Daten für den Nachweis der Konformität ihrer Produkte haben. Das betrifft sowohl die Zulassung der Produkte als auch die Post-Market-Aktivitäten, insbesondere das „Post-Market Clinical Follow-up“.
1. Klinische Daten: Grundlagen
1.1 Definition
Ähnlich wie die MEDDEV 2.7/1 definiert die Medizinprodukteverordnung MDR den Begriff „klinische Daten“ wie folgt:
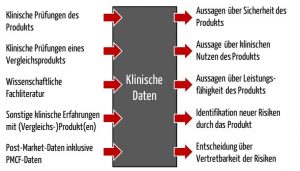
„Angaben zur Sicherheit oder Leistung, die im Rahmen der Anwendung eines Produkts gewonnen werden und die aus den folgenden Quellen stammen:
- klinische Prüfung(en) des betreffenden Produkts,
- klinische Prüfung(en) oder sonstige in der wissenschaftlichen Fachliteratur wiedergegebene Studien über ein Produkt, dessen Gleichartigkeit mit dem betreffenden Produkt nachgewiesen werden kann,
- in nach dem Peer-Review-Verfahren überprüfter wissenschaftlicher Fachliteratur veröffentlichte Berichte über sonstige klinische Erfahrungen entweder mit dem betreffenden Produkt oder einem Produkt, dessen Gleichartigkeit mit dem betreffenden Produkt nachgewiesen werden kann,
- klinisch relevante Angaben aus der Überwachung nach dem Inverkehrbringen, insbesondere aus der klinischen Nachbeobachtung nach dem Inverkehrbringen;“
Abschnitt 48 in Artikel 2 MDR
1.2 Zwecke, die mit klinischen Daten erreicht werden sollen
Diese Definition nennt sowohl den Zweck als auch die Quellen medizinischer Daten.
Der Anhang VI offenbart, dass der Begriff „Leistung“ im doppelten Sinn zu verstehen ist:
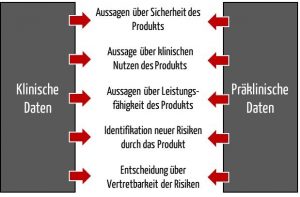
- Die Leistung im Sinne einer Leistungsfähigkeit in Form spezifizierter Leistungsangaben. Ein Beispiel ist die Fähigkeit eines Defibrillators, eine gewisse Energiemenge pro Zeiteinheit abzugeben.
- Die Leistung im Sinne des klinischen Nutzens und des Erreichens der Zweckbestimmung des Produkts. Beim Defibrillator wäre dies, das Herzkammerflimmern zu beenden.
Den Nachweis, dass die spezifizierten Leistungsangaben (1. Punkt) erfüllt sind, erbringen Hersteller meist anhand vorklinischer Daten, die auch präklinische Daten genannt werden. Beispiele für präklinische Daten finden Sie weiter unten.
Im Anhang XIV offenbart die MDR weitere Zwecke klinischer Daten:
- Sie sollen dazu dienen, bisher nicht erkannte Risiken oder Gefährdungen zu identifizieren und neu zu bewerten.
- Anhand aktualisierter klinischer Daten sollen die Hersteller ihre Entscheidung über die Vertretbarkeit der Risiken neu treffen.
Sie stehen noch am Anfang Ihrer klinischen Bewertung?
Unser Clinical Evaluation Jumpstart Kit hilft Ihnen, die ersten Schritte innerhalb der klinischen Bewertung Ihrer Medizinprodukte zu gehen und verschafft Orientierung, was konkret von Ihnen verlangt wird.
2. Quellen von Daten
Für die klinische Bewertung müssen Hersteller nicht nur die klinischen, sondern auch die vorklinischen (präklinischen) Daten berücksichtigen.
Lesen Sie hier mehr zum Thema Klinische Bewertung und MEDDEV 2.7/1 Revision 4.
2.1 Quellen für klinische Daten
| Daten | Beispiele |
| Klinische Prüfungen zum Produkt |
|
| Klinische Prüfungen eines Äquivalenzprodukts |
|
| Wissenschaftliche Fachliteratur | |
| Sonstige klinische Erfahrungen mit (Äquivalenz-)Produkten |
|
| Post-Market-Daten inklusive PMCF-Daten (Klinische Nachbeobachtung) |
|
Lesen Sie hier mehr zum Thema Post-Market Surveillance (PMS) und Post-Market Clinical Follow-up (PMCF) (klinische Nachbeobachtung).
2.2 Quellen für präklinische Daten
Zu den Beispielen für präklinische Daten zählen die Ergebnisse folgender Prüfungen:
- Tests der Biokompatibilität
- Prüfungen der elektrischen und mechanischen Sicherheit, z. B. gemäß IEC 60601-1
- Prüfungen der elektromagnetischen Verträglichkeit, z. B. gemäß IEC 60601-1-2
- Software-Tests (Unit-, Integrations- und System-Tests)
- Summative Bewertung der Gebrauchstauglichkeit
- Tests der Haltbarkeit und Stabilität (z. B. bei langer Lagerung, Transport, Wärme, Kälte)
- Tierversuche
- Simulationen
- Labortests
Daten aus z. B. Usability-Tests, die nach der Inverkehrbringung gesammelt werden und die klinisch relevante Informationen enthalten, zählen definitionsgemäß ebenfalls zu den klinischen Daten.
3. Regulatorische Anforderungen an klinische Daten
3.1 Europa
Die Medizinprodukterichtlinie MDD fordert ebenso wie die Medizinprodukteverordnung MDR, dass die Hersteller klinische Daten sammeln und bewerten. Bei der MDR finden sich diese Forderungen u. a. in den folgenden Kapiteln:
- Artikel 61 fordert eine klinische Bewertung, die sich auf „ausreichende klinische Daten stützt“. Darin heißt es weiter: „Die klinische Bewertung und die dazugehörigen Unterlagen sind während des gesamten Lebenszyklus des Produkts anhand der klinischen Daten zu aktualisieren.“ Die Frequenz hängt von der Klasse des Produkts ab und ist in Artikel 84 der MDR spezifiziert.
- Anhang II (Technische Dokumentation) fordert in Kapitel 6 (Verifizierung und Validierung des Produkts) vorklinische und klinische Daten.
- Besonders ausführlich geht der Anhang XIV Teil A (klinische Bewertung) auf die klinischen Daten ein.
- Anhang XIV Teil B (klinische Nachbeobachtung, PMCF) verlangt von den Herstellern, „auf proaktive Weise klinische Daten“ zu sammeln und zu bewerten.
Die MDR verlangt von den Herstellern, klinische Daten vor und nach der Zulassung zu sammeln. Sie gibt bereits in der Definition vor, welche Quellen die Hersteller mindestens zu berücksichtigen haben.
Wie wichtig der Medizinprodukteverordnung die klinischen Daten sind, offenbart der Anhang VII, der die Anforderungen an die Benannten Stellen spezifiziert:
„Die Benannte Stelle […] schenkt den klinischen Daten aus der Überwachung nach dem Inverkehrbringen und [… der] klinischen Nachbeobachtung […] besondere Aufmerksamkeit […]“.
3.1.1 Klinische Daten von anderen Medizinprodukten
Hersteller dürfen sich laut Anhang XIV bei der klinischen Bewertung nur dann auf klinische Daten anderer Produkte stützen, wenn die Gleichartigkeit dieser anderen Produkte nachgewiesen wird. Die MDR fordert eine technische, biologische und klinische Äquivalenz. Mehr dazu lesen Sie weiter unten.
3.1.2 Verzicht auf klinische Daten
MDR und MDD erlauben lediglich unter ganz bestimmten Voraussetzungen, in der klinischen Bewertung auf klinische Daten zu verzichten.
In der MDD gab es in Anhang X, Absatz 1.1d bereits eine Ausnahmeregelung für Produkte, bei denen die Bewertung auf Basis klinischer Daten „für nicht notwendig erachtet“ wird.
Die MDR erlaubt diese Ausnahme, wenn der Nachweis mittels klinischer Daten als ungeeignet oder nicht angemessen erachtet wird („is not deemed appropriate“).
Wird der Nachweis der Übereinstimmung mit grundlegenden Sicherheits- und Leistungsanforderungen auf der Grundlage klinischer Daten für ungeeignet erachtet, ist jede solche Ausnahme auf der Grundlage des Risikomanagements des Herstellers und unter Berücksichtigung der besonderen Merkmale des Zusammenspiels zwischen dem Produkt und dem menschlichen Körper, der bezweckten klinischen Leistung und der Angaben des Herstellers angemessen zu begründen; dies gilt unbeschadet des Absatzes 4. In diesem Fall muss der Hersteller in der technischen Dokumentation gemäß Anhang II gebührend begründen, warum er den Nachweis der Übereinstimmung mit grundlegenden Sicherheits- und Leistungsanforderungen allein auf der Grundlage der Ergebnisse nichtklinischer Testmethoden, einschließlich Leistungsbewertung, technischer Prüfung („bench testing“) und vorklinischer Bewertung, für geeignet hält.
MDR, Artikel 61, Satz (10)
Hilfsmittel (z. B. Mundspatel) oder Werkzeuge (z. B. Skalpell, Zahnarztbohrer) können oft ohne produktspezifische klinische Daten bewertet werden, da eine solitäre klinische Prüfung nicht angemessen oder ethisch nicht vertretbar erscheint. Natürlich muss dies nachvollziehbar begründet werden.
Ein Verzicht auf klinische Daten muss nachvollziehbar begründet werden. Für die Begründung können Sie z. B. über allgemeine klinische Daten im State of the Art nachweisen, dass Ihr Gerät auf einer bewährten Technologie basiert, die dem anerkannten Stand der Technik entspricht und allgemein wenig Änderung erfährt. Idealerweise liegen Produktnormen vor, in denen Leistungsparameter angegeben werden, durch deren Einhaltung die Sicherheit gewährleistet werden kann. Der Nutzen kann z. B. über Leitlinien medizinischer Fachgesellschaften nachgewiesen werden.
Die MDCG beschreibt diese Möglichkeit nur im Dokument MDCG 2020-6 für Bestandsprodukte (englisch: legacy devices). Wir denken aber, dass der Grundgedanke auch anwendbar ist, wenn Sie ein derartiges Produkt neu in Ihr Portfolio aufnehmen und erstmals zulassen.
Beachten Sie, dass ein Verzicht auf klinische Daten nicht bedeutet, dass Sie Ihr Produkt nicht schon vor der Inverkehrbringung einer Prüfung durch Anwender unterziehen müssen. In den meisten Fällen brauchen Sie summative Tests, eine sogenannte Usability-Studie, um die Gebrauchstauglichkeit zu validieren.
3.2 USA / FDA
Die FDA verlangt von den Herstellern bei den Zulassungen, z. B. den Premarket Notifications (PMN) oder Premarket Approvals (PMA), klinische Daten. Bei den PMN (510(k)) stammen diese in der Regel vom Vergleichsprodukt, wie die FDA selbst sagt.
Ende Februar 2018 hat die FDA ein Guidance-Dokument veröffentlicht, das beschreibt, in welcher Form die FDA welche klinischen Daten akzeptiert. Es trägt den Titel Acceptance of Clinical Data to Support Medical Device Applications and Submissions Frequently Asked Questions.
2023 hat die FDA das Guidance-Dokument Recommendations for the Use of Clinical Data in Premarket Notification [510(k)] Submissions veröffentlicht.
4. Typische Probleme
4.1 Äquivalenz der Produkte
Die meisten Medizinproduktehersteller sind bestrebt, klinische Prüfungen mit dem eigenen Produkt zu vermeiden. Klinische Studien sind teuer und benötigen meist Monate. Daher versuchen die Hersteller, die klinischen Daten von Vergleichsprodukten zu verwenden und/oder den Beweis nach dem „Literaturverfahren“ zu führen.
Allerdings müssen diese Vergleichsprodukte „ausreichend ähnlich“ sein. Die MDR und die MEDDEV 2.7/1 Revision 4 haben die Anforderungen an diese Äquivalenz deutlich erhöht. Sie nennen drei Aspekte:
- Technisch: Das Produkt ist von ähnlicher Bauart, wird unter ähnlichen Anwendungsbedingungen angewandt, hat ähnliche Spezifikationen und Eigenschaften einschließlich physikalisch-chemischer Eigenschaften wie Energieintensität, Zugfestigkeit, Viskosität, Oberflächenbeschaffenheit, Wellenlänge und Software-Algorithmen, verwendet gegebenenfalls ähnliche Entwicklungsmethoden und hat ähnliche Funktionsgrundsätze und entscheidende Leistungsanforderungen.
- Biologisch: Das Produkt verwendet die gleichen Materialien oder Stoffe im Kontakt mit den gleichen menschlichen Geweben oder Körperflüssigkeiten für eine ähnliche Art und Dauer des Kontakts bei ähnlichem Abgabeverhalten der Stoffe einschließlich Abbauprodukte und herauslösbarer Bestandteile („leachables“).
- Klinisch: Das Produkt wird unter der gleichen klinischen Bedingung oder zum gleichen klinischen Zweck, einschließlich eines ähnlichen Schweregrads und Stadiums der Krankheit, an der gleichen Körperstelle und bei ähnlichen Patientenpopulationen in Bezug auf u.a. Alter, Anatomie und Physiologie angewandt, hat die gleichen Anwender und erbringt eine ähnliche, maßgebliche und entscheidende Leistung im Hinblick auf die erwartete klinische Wirkung für eine spezielle Zweckbestimmung. (Quelle MDR)
Das Johner Institut erlebt regelmäßig, dass Benannte Stellen die Anforderungen an die Äquivalenz so hoch auslegen, dass klinische Prüfungen unumgänglich werden. Das ist besonders bei unkritischen Produkten nicht immer nachvollziehbar und sinnvoll.
Die Anforderungen an den Äquivalenznachweis unterscheiden sich in der EU und den USA, wie der Fachartikel zum Predicate Device und zur Substantial Equivalence beschreibt.
4.2 Quantität und Qualität der Daten
Die Daten müssen „in quantitativer und qualitativer Hinsicht ausreichend„ sein, um „qualifiziert beurteilen zu können, ob das Produkt sicher ist und den angestrebten klinischen Nutzen […] erreicht“. Dazu müssen die klinischen Daten „wissenschaftlich fundiert, zuverlässig und solide“ sein.
Die Prüfer der Benannten Stellen legen auf folgende Eigenschaften besonderen Wert:
- Die klinischen Daten müssen quantitativ ausreichend sein, um eine statistische Signifikanz zu belegen.
- Sie müssen aus Quellen stammen, deren wissenschaftliche Validität keinen Zweifel aufwirft.
- Die Daten verschiedener Quellen sollten die These des Herstellers belegen und damit den Nachweis des Nutzens, der Leistung und der Sicherheit des Produkts erbringen.
- Es müssen möglichst alle Quellen durchsucht bzw. ausgewertet werden. Manche Hersteller wehren sich gegen die Forderung, die kostenpflichtige Datenbank EMBASE zu nutzen. Es gibt keine Anforderung, alle Datenquellen zu verwenden. PubMed ist von den meisten benannten Stellen als alleinige Quelle anerkannt.
- Die Daten müssen mit Produkten, Technologien oder Verfahren gewonnen wurden, bei denen die Anforderungen an die Äquivalenz und damit Vergleichbarkeit erfüllt sind.
Besonders die Beurteilung der wissenschaftlichen Validität klinischer Daten führt zu Diskussionen zwischen Herstellern einerseits und Benannten Stellen und Behörden andererseits. Dabei geht es um solche Fragen:
- Ist das wissenschaftliche Journal seriös? Der Impact Factor des Journals ist dabei eine relevante Metrik.
- Ist das Studiendesign angemessen? Müssen die Daten aus einer prospektiven, randomisierten und kontrollierten Studie stammen?
- Hat die Studie einen Bias? Hat die Auswahl der Probanden oder des Verfahrens oder sogar der Hersteller selbst einen Einfluss auf die Ergebnisse (genommen)?
Diese wissenschaftliche Güte von Publikationen versucht der GRADE, ein „Level of Evidence“ nach Cochrane, zu quantifizieren.
4.3 Verpflichtung zu klinischen Prüfungen
Insbesondere bei Implantaten der Klasse IIb und allen Produkten der Klasse III besteht die MDR darauf, dass die Hersteller die klinischen Daten (auch) im Rahmen klinischer Prüfungen mit dem speziellen Produkt erheben. Ausnahmeregelungen existieren zwar, aber die Anzahl klinischer Prüfungen wird zunehmen.
5. Tipps und Fazit
Die Anforderungen an die Hersteller steigen, den Nutzen und die Sicherheit ihrer Produkte anhand klinischer Daten wissenschaftlich zu beweisen. Das Sammeln der wissenschaftlichen Daten, z. B. in Form einer klinischen Prüfung, darf aber nicht zum Selbstzweck werden. Wir empfehlen daher:
5.1 Auf Leistungsdaten ausweichen (falls möglich)
Die EU-Richtlinien bzw. Verordnungen erlauben es (MDD Anhang X, Absatz 1.1d bzw. Kapitel VI, Artikel 61 Abs. 10 der MDR), in gewissen Fällen statt klinischer Daten auch präklinische Daten wie Leistungsdaten, Simulationsergebnisse und Systemtests zu verwenden. Dies sollte besonders bei unkritischen Produkten ohne (oder mit nur wenig) Rückwirkung mit dem Patienten gelingen. Beispiele für solche Produkte, bei denen es dem Team des Johner Institut gelang, diesen Weg zu gehen, sind: Stand-alone-Software, Mundspatel, Behandlungsstühle, sehr etablierte stoffliche Medizinprodukte und sehr etablierte kardiologische Elektroden.
5.2 Datenbank klinischer Prüfungen beachten
Die wissenschaftliche Fachliteratur müssen Hersteller in jedem Fall beleuchten. Wir empfehlen zudem, Registries und die Datenbanken für klinische Prüfungen wie https://clinicaltrials.gov/ zu berücksichtigen.
5.3 Daten von Vorgängerprodukten nutzen
Viele Firmen unterschätzen den Wert der Daten, die von Vorgängerprodukten stammen. Manchmal ist es einfacher, eine nicht-interventionelle Anwendungsstudie mit solch einem Vorgängerprodukt durchzuführen, als eine neue klinische Prüfung aufzusetzen. Stimmen Sie mit Ihrer Benannten Stelle diesen Ansatz ab.
5.4 Sofort mit dem Sammeln der Daten beginnen
Mit der MDR müssen Sie Ihre Produkte neu zulassen. Nutzen Sie die Zeit bis dahin, um mit den bereits zugelassenen Produkten ausreichend Daten zu sammeln, auf die Sie später zurückgreifen und damit eine klinische Prüfung vermeiden können.
Die Zweckbestimmung stellt eine Voraussetzung für jede klinische Bewertung dar. Diese Zweckbestimmung sollte möglichst quantitativ den beabsichtigten klinischen Nutzen spezifizieren.
Kontaktieren Sie gerne das Johner Institut, wenn Ihre Benannte Stelle eine zeit- und kostenintensive klinische Prüfung verlangt, obwohl Sie der Meinung sind, über ausreichend klinische Daten zu verfügen. Regelmäßig finden unsere klinischen Experten einen Ausweg. Sie helfen Ihnen auch, eine klinische Prüfung oder Anwendungsbeobachtung schnell, planbar, kosteneffizient und gesetzeskonform durchzuführen.
Änderungshistorie
- 2024-04-17: Kapitel 3.1.2 eingefügt und Nummerierung geändert
- 2023-10-23: Artikel aktualisiert; z. B. durch Hinweis auf neues FDA Guidance Document. Kapitel 1 und 5 neu strukturiert.
- 2018-09-12: Erste Version veröffentlicht




Wenn man gemäß Kapitel VI Artikel 61 Abs. 10 der MDR auf klinische Daten verzichten kann, ist dann trotzdem eine klinische Bewertung notwendig?
Wenn nein, welchen Umfang sollte so eine klinische Bewertung haben? Bei uns wurde bisher eine Literaturrecherche durchgeführt und zusätzlich Daten von Reklamationen, Vorkommnissen etc. gesammelt / berücksichtigt. Zusätzlich wurde das Feedback von Anwendern, welches über Fragebögen eingeholt wurde hinzugezogen. Würden diese Daten ausreichen um eine klinische Bewertung inkl. der klinischen Nachbeobachtung nach dem Inverkehrbringen gemäß MDR umzusetzen?
Für mich ist es schwer vorstellbar, wie eine klinische Bewertung z.B. für eine Mundspatel aussehen soll bzw. wie man für so ein Produkt proaktiv klinische Daten sammeln soll….
Würde mich über Feedback freuen!
Danke und schöne Grüße,
Heinz
Sehr geehrter Herr K., sehr geehrte Frau Gossenreiter,
danke für Ihre Fragen!
Eine klinische Bewertung ist auch unter der MDR verpflichtend – auch wenn man unter Umständen und einer guten Begründung auf klinische Daten verzichten kann.
Sie benötigen neben den o.g. Daten präklinische Daten. Bei einer Mundspalten wären z.B. die Ergebnisse von Biokompatiblitätstests unverzichtbar. Weitere Beispiele für präklinische Daten sind Ergebnisse von EMV-, Software- oder Usability-Tests.
Die Daten die Sie nennen sind v.a. Post-Market-Daten. Die sind sehr wichtig und verpflichtend, wenn das Produkt in den Verkehr gebracht wurde. Bei der erstmaligen Inverkehrbringung liegen diese naturgemäß noch nicht vor.
Viele Grüße, Christian Johner
Vielen Dank für die rasche Antwort.
Das heißt bei der klinischen Bewertung vor dem Inverkehrbringen argumentiert man über präklinische Daten wie z.B. Biokompatibilitätstests.
Nach dem Inverkehrbringen ist für die Aktualisierung der klinischen Bewertung gemäß Kapitel VI Artikel 61 Abs. 11 der MDR ist eine Literaturrecherche in wissenschaftlicher Fachliteratur ausreichend (da man ja selbst keine klinischen Daten generiert)?
Verstehe ich das richtig?
Was mir noch unklar ist, wie man gemäß Anhang XIV Teil B Abs. 5 für eine Mundspatel proaktiv klinische Daten sammeln soll?
Danke und LG, Heinz
Danke für Ihre Nachfrage, die sich nun auf die Post-Market-Daten bezieht. Diese Daten beziehen sich nicht ausschließlich auf die Fachliteratur. Zumindest zum Zeitpunkt der erstmaligen Inverkehrbringung scheint es diese ja gerade nicht gegeben zu haben. Wenn inzwischen solche Daten entstanden sind, müssen diese ebenso berücksichtigt werden wie andere Daten, die bei der Anwendung des Produkts entstehen wie Anrufe bei der Hotline, Reklamationen, Nachtestungen, Beobachtungen der Medizinprodukteberatern, Serviceberichte, Ersatzteilbestellungen (bei Mundspateln nicht anwendbar), ggf. Befragungen und natürlich die Daten der Konkurrenz und von alternativen Verfahren und Technologien.
Dass Sie keine Daten generieren, ist somit nicht in jedem Fall ganz zutreffend.
Sehr geehrter Herr Johner,
für das PMCF müssen die Hersteller klinische Daten proaktiv sammeln. Was genau wird unter „proaktiv“ verstanden? Dass man den Kunden z.B. Fragebögen schickt?
Wir stellen venöse Blutentnahmekanülen her. Ärzte oder Krankenschwestern werden sich nicht die Zeit nehmen und einen derartigen Fragebogen ausfüllen. Was tut man, wenn man Daten sammeln will, aber keine Rückmeldungen bekommt? Gibt es noch andere Möglichkeiten wie wir zu klinischen Daten kommen könnten?
Schönen Grüße,
Maximilian Fürhauser
Sehr geehrter Herr Fürhauser,
unter „proaktiv“ ist zu verstehen, dass man nicht einfach wartet, dass einem Daten erreichen, sondern dass man sie aktiv sammelt. Wenn Kunden auf Fragebögen nicht reagieren, dann bedeutet das nicht, dass man sie zwingt.
Weitere Datenquellen nennt der Artikel. Denken Sie an Beschwerden, Hotline-Anfrufe, Informationen über Konkurrenzprodukte, Veröffentlichungen zu Materialien, Gespräche mit Anwendern usw. Eine Pflicht zu Fragebögen gibt es aber nicht.
Beste Grüße, Christian Johner
Sehr geehrter Herr Johner,
in unserem Unternehmen gibt es zum Thema klinische Daten immer wieder die Diskussion, ab wann technische Daten auch klinische Daten sind. Ein Beispiel dafür wäre der Themenblock „Preventive Maintenance“. Hier würden technische Daten (wie zum Beispiel interne Sensorwerte ausgewertet), um daraus präventiv Wartungsmaßnahmen abzuleiten. So könnten sich anbahnende Defekte in einem Medizinprodukt entdeckt werden, bevor ein Schutzsystem eingreift. Indirekt sind diese Daten sicherlich auch mit der Leistungsfähigkeit eines Produkts, aber vor allem mit seiner Verfügbarkeit verknüpft. Dies führt dazu, dass wir uns intern sehr schwer damit tun, Themen wie Preventive Maintenance von klinischen Studien abzugrenzen.
Können Sie uns hier bei der genaueren Abgrenzung einen Rat geben?
Viele Grüße,
Nicolas Müglich
Sehr geehrter Herr Müglich,
technische Daten wie Sensorwerte würde ich nicht zu den klinischen Daten zählen, weil sie nicht der Definition entsprechen. Aber ich sehe auch gar nicht die Notwendigkeit: Sie sollten alle relevanten Post-Market-Daten auswerten, um Rückschlüsse auf Sicherheit, Leistungsfähigkeit und den klinischen Nutzen zu ziehen und entsprechende Maßnahmen zu ergreifen.
Die „preventive Maintenance“ und die klinischen Studien sind etwas komplett unterschiedliches. Schon die Ziele unterscheiden sich: Bei ersterem versuchen Sie die Sicherheit und Leistungsfähigkeit des Produkts aufrecht zu erhalten. Bei dem zweiten versuchen Sie Antworten auf Fragen zur Sicherheit, Leistungsfähigkeit und dem Nutzen des Produkts zu beantworten. Dies ist relevant für die Zulassung des Produkts.
Beste Grüße, Christian Johner
Sehr geehrter Herr Professor Johner,
ich bin mir nicht sicher, ob ich mit meinem Anliegen her richtig bin. Ich gehe aber davon aus, dass Sie mir trotzdem eine Antwort geben werden. Vielen Dank dafür bereits im Voraus!
Meine Frage:
Ist es während der Entwicklung eines neuen Medizinprodukts (Klasse 1, z.B. eine Bandage für das Handgelenk) möglich, mit einem Prototyp Tests mit Anwendern durchzuführen? Die Tests sollen Aufschluss darüber geben, ob ein z.B. gewähltes Material die Leistung erfüllt, die in der ersten Idee zum neuen Produkt formuliert wurde.
Das zukünftige neue Medizinprodukt ist zu diesem Zeitpunkt noch nicht CE-gekennzeichnet.
Welche Anforderungen muss der Hersteller erfüllen, um diese Tests durchführen zu können/dürfen?
Müssen diese Art Tests bei der Behörde angemeldet werden?
Vielen Dank für Ihre Hilfe
Mit freundlichen Grüßen
Christine Graß
Sehr geehrte Frau Graß,
vielen Dank für Ihre spannende Frage. Da Sie Ihren Protottyp an Anwendern testen wollen, bewegen wir uns hier bereits im Rahmen einer klinischen Prüfung:
Definition: Klinische Prüfung laut MDR, Artikel 2, Absatz 45
„systematische Untersuchung, bei der ein oder mehrere menschliche Prüfungsteilnehmer einbezogen sind und die zwecks Bewertung der Sicherheit oder Leistung eines Produkts durchgeführt wird“
Sie schrieben: „Die Tests sollen Aufschluss darüber geben, ob ein z.B. gewähltes Material die Leistung erfüllt, die in der ersten Idee zum neuen Produkt formuliert wurde.“
Im Artikel 62 der MDR steht:
a) zur Feststellung und Überprüfung, dass ein Produkt so ausgelegt, hergestellt und verpackt ist, dass es unter normalen Verwendungsbedingungen für einen oder mehrere der aufgelisteten spezifischen Zwecke geeignet ist und die von seinem Hersteller angegebene bezweckte Leistung erbringt;
b) zur Feststellung und Überprüfung des von seinem Hersteller angegebenen klinischen Nutzens eines Produkts;
c) zur Feststellung und Überprüfung der klinischen Sicherheit des Produkts und zur Bestimmung von bei normalen Verwendungsbedingungen gegebenenfalls auftretenden unerwünschten Nebenwirkungen des Produkts und zur Beurteilung, ob diese im Vergleich zu dem von dem Produkt erbrachten Nutzen vertretbare Risiken darstellen.
Tatsächlich handelt es sich in ihrem Fall um eine klinische Prüfung und Sie müssen Studiendokumente gemäß MDR Anhang XV, Kapitel 2 und ISO 14155 erstellen. Für Fragen zu klinischen Prüfungen hilft auch das MDCG 2021-6 Dokument – Questions & Answers regarding clinical investigation.