Regularien wie die MDR fordern den Nachweis der Biokompatibilität aller Materialien, die mit Patienten oder Anwendern direkt oder indirekt in Kontakt kommen.
Eine prüfbasierte Beurteilung der Biokompatibilität liefert Referenzdaten, die bei unerwarteten Problemen ein sehr gutes Fundament liefern und helfen, unbekannte Ursachen sehr schnell und gezielt zu identifizieren.
Allerdings gibt es seit Jahren einen gegensätzlichen Trend. Weg von Prüfungen und damit weg von der Produktsicherheit.
1. Grundlagen
a) Risiken durch mangelnde Biokompatibilität
Medizinproduktehersteller sind verpflichtet, die Sicherheit ihrer Produkte zu gewährleisten und mögliche Risiken zu minimieren. Zu diesen Risiken zählen auch biologische Risiken, die beispielsweise verursacht werden durch:
- Chemikalien, die sich aus Materialien des Medizinprodukts herauslösen und vom Körper aufgenommen werden
- Implantate, die eine Abstoßungsreaktion hervorrufen
- Materialien, die eine allergische Reaktion verursachen
- Materialien, die entgegen der Absicht des Hersteller vom Körper abgebaut oder umgewandelt werden
- Implantate und Materialien, die nicht wie gewünscht in den Körper einwachsen
Faktoren, die die Biokompatibilität negativ beeinflussen, beschreibt dieser Artikel weiter unten.
b) Begriffsdefinitionen
Die ISO 10993 definiert den Begriff biologisches Risiko wie folgt:
„Wahrscheinlichkeit von gesundheitlichen Schäden aufgrund des Medizinprodukts oder Wechselwirkungen mit den Materialien.“
Quelle: ISO 10993-1
Die biologische Sicherheit ist entsprechend die Freiheit von nicht akzeptablen biologischen Risiken.
Etwas kryptischer wirkt die Definition des Begriffs „Biokompatibilität“:
„Fähigkeit eines Medizinprodukts oder Materials, mit einer angemessenen Host-Reaktion Leistung in einer spezifischen Anwendung zu erbringen“
Quelle: ISO 10993-1
Der Begriff Host-Reaktion meint hier mögliche unerwünschte und nachteilige Reaktionen. Die Norm merkt an, dass der Nachweis der Biokompatibilität durch biologische Prüfungen und durch eine Beurteilung der herauslösbaren Chemikalien erfolgen kann.
2. Regulatorische Anforderungen an die Biokompatibilität
a) Anforderungen der MDR
Die Medizinprodukteverordnung (Medical Device Regulation MDR) räumt der Biokompatibilität einen hohen Stellenwert ein, wie man bereits in den Erwägungsgründen erkennt. Sie formuliert die entsprechenden Anforderungen an mehreren Stellen:
Anhang I: Grundlegende Sicherheits- und Leistungsanforderungen
Der Anhang I erwähnt den Begriff Biokompatibilität nicht explizit. Er schreibt aber:
Die Produkte werden so ausgelegt, hergestellt und verpackt, dass die Risiken durch Schadstoffe und Rückstände für Patienten — unter Berücksichtigung der Zweckbestimmung des Produkts — sowie für Transport-, Lager- und Bedienungspersonal so gering wie möglich gehalten werden. Dabei wird Geweben, die diesen Schadstoffen und Rückständen ausgesetzt sind, sowie der Dauer und Häufigkeit der Exposition besondere Aufmerksamkeit gewidmet.
MDR, Anhang I, Absatz 10.2
Bereits im ersten Abschnitt des Anhangs I fordert die Verordnung, die Sicherheit und Gesundheit von Patienten, Anwendern und Dritten nicht zu gefährden und die „Risiken durch sichere Auslegung und Herstellung beseitigen oder so weit wie möglich [zu] minimieren“.
Anhang II: Technische Dokumentation
Die MDR verpflichtet die Hersteller im Anhang II, Informationen zu allen Prüfungen zu dokumentieren inklusive
Testaufbau, Testprotokolle, Methoden der Datenanalyse, […], Testergebnisse hinsichtlich der Biokompatibilität des Produkts einschließlich der Identifizierung aller Materialien in direktem oder indirektem Kontakt mit dem Patienten oder Anwender, [sowie hinsichtlich der …] chemischen und mikrobiologischen Parameter.
MDR, Anhang II, Absatz 6.1.b)
Auch den Fall, dass die Hersteller keine Tests durchführen, regelt die MDR:
Falls keine neuen Tests durchgeführt wurden, wird diese Entscheidung in der Dokumentation begründet. Eine solche Begründung wäre beispielsweise, dass Biokompatibilitätstests an identischen Materialien durchgeführt wurden, als diese Materialien in ein rechtmäßig in Verkehr gebrachtes oder in Betrieb genommenes Vorgängermodell des Produkts integriert wurden.
MDR, Anhang II, Absatz 6.1.b)
Anhang VII: Anforderungen an Benannte Stellen
Dieser Anhang betrifft die Hersteller zumindest indirekt, denn darin verpflichtet die MDR die Benannten Stellen:
- Die Kompetenz des Personals der Benannten Stellen bezüglich der Biokompatibilität gewährleisten
- Aktualität des Wissens der Hersteller
Benannte Stellen müssen die Verfahren der Hersteller prüfen, mit denen die Hersteller sicherstellen, dass sie über neuste wissenschaftliche Erkenntnisse auch in Bezug auf die Biokompatibilität von Materialien verfügen.
b) ISO 10993-1
Die Norm ISO 10993-1 war bereits unter der Medizinprodukterichtlinie MDD harmonisiert und wird das (wie die ganze Normenfamilie) auch unter der MDR bleiben.
Daher orientieren sich die meisten Medizinproduktehersteller an dieser Norm, u.a. wenn es um Endpunkte geht, die für Bewertung der biologischen Sicherheit notwendig sind.
Diese Endpunkte beschreibt die Norm in Tabelle A.1 im Annex A. Der folgende Ausschnitt aus der Tabelle zeigt exemplarisch die zu bewertenden Endpunkte für ein Medizinprodukt mit Kontakt zu zirkulierendem Blut.
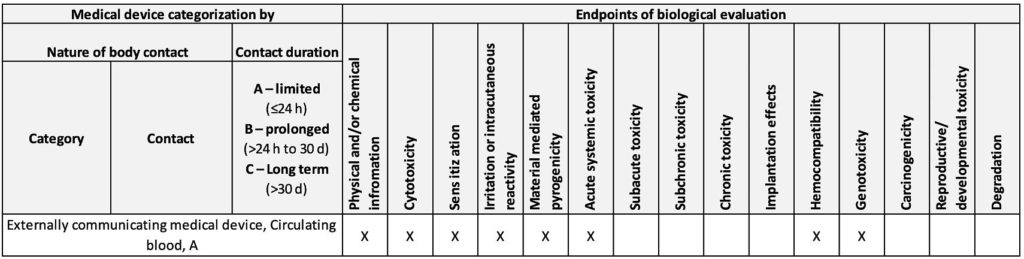
Diese im nicht-normativen Teil beschriebene Vorgehensweise entspricht nicht den normativen Vorgaben: Gemäß ISO 10993-1 (2018), Figure 1, sowie ISO 10993-2 ist ausdrücklich eine Materialcharakterisierung durchzuführen und auf Tierversuche zu verzichten. Zudem ermöglicht eine Materialcharakterisierung eine höhere Aussagekraft und damit eine höhere biologische Sicherheit.
Die Norm stellt klar, dass die Hersteller die biologische Sicherheit über den kompletten Lebenszyklus des Medizinprodukts gewährleisten müssen:
„The biological safety of a medical device shall be evaluated by the manufacturer over the whole life cycle of a medical device.“
ISO 10993-1, 4.7
Ebenso ergänzt dieser Teil die Forderungen nach „Freiheit von inakzeptablen biologischen Risiken“ wie folgt:
„The following shall be taken into account for their relevance to overall biological evaluation of the medical device: …process contaminants and residues… packaging materials… leachables substances… degradation products…“
ISO 10993-1, 4.3
Bitte beachten Sie auch diese Fachartikel:
3. Umgang mit Informationen zur Biokompatibilität
a) Vorhandene Informationen nutzen
Zur Beurteilung der Biokompatibilität tragen Hersteller häufig alle Informationen zu den verwendeten Materialien zusammen wie
- Materialdatenblätter
- Zertifikate
- Ergebnisse von Recherchen zu bekannten Inhaltsstoffen und Additiven
- Markterfahrungen
Diese Informationen sind notwendig und wichtig, aber meist nicht hinreichend, um die Biokompatibilität zu beweisen!
b) Fehlende Informationen ergänzen
Die oben genannten Informationen sind eine sehr gute Ausgangsbasis. Häufig erlauben sie aber noch keine vollständigen Aussagen über die biologische Sicherheit. So fehlen Informationen, die nachweisen, dass es keine biologischen Risiken gibt durch die
- Wechselwirkungen der verschiedenen Materialien untereinander
- Veränderungen der Materialien über die Lebensdauer des Produkts
- Bearbeitung der Materialien im Rahmen der Produktion
- Endreinigung des Produkts
- usw.
Die Liste möglicher Einflussfaktoren ist sehr umfasend: Sie reicht vom Handdesinfektionsmittel der Mitarbeiter, über unreine Ausgangsmaterialien, bis hin zu nicht wahrgenommenen Kabelabrieb an den Anlagen. Alle Faktoren der folgenden Tag-Cloud haben bereits erfolgreich eine positive Bewertung der Biokompatibilität verhindert.

c) Vorhandene Informationen kritisch bewerten
Auch die Verlässlichkeit der vorhandenen Informationen sollten Hersteller kritisch hinterfragen und beispielsweise folgende Aspekte klären:
- Prüfverfahren und Prüfparameter
- Ausgangsmaterialen, mit denen diese Ergebnisse gewonnen wurden
- Übertragbarkeit der Ergebnisse
Dass Hersteller auf Informationen von Mitbewerbern zurückgreifen, ist gut. Jedoch sollten Sie bei der Argumentation, dass deren Produkte ausreichend ähnlich und seit Jahren ohne Probleme auf dem Markt verwendet würden, die Äquivalenz aller Parameter betrachten wie:
- Sämtliche Inhaltsstoffe und Materialtypen wie Additive und Einfärbungen und nicht nur die Hauptbestandteile
- Produktionsprozess und Produktionshilfsmittel
- Endreinigung: Prozess, Reinigungsmittel
Häufig fehlen genau diese Informationen und führen zu argumentativen Lücken. Im Datenblatt nicht gelistete Inhaltsstoffe sind nicht automatisch unkritisch.
4. Weitere Praxistipps
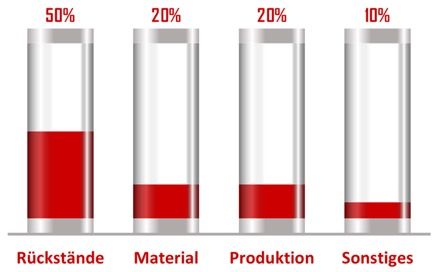
Die folgende Grafik spiegelt die Erfahrung des Johner Instituts mit den typischen Problemen bei mehreren 1000 Medizinprodukten wider.
a) Nicht auf „etablierte Meinungen“ verlassen
Manche Hersteller folgen der Ansicht, dass der Cytotoxizitätstest alleine ausreichend würden, um die biologische Sicherheit zu gewährleisten, oder dass Produkte mit sehr kurzem Haut- oder Schleimhautkontakt als unkritisch anzusehen sind. Beides ist nicht zutreffend und nicht konform mit den o.g. Anforderungen der MDR.
b) Notwendige Nachweise bereitstellen
Leider verwirren sowohl die ISO 10993 als auch die MDR durch mehrere Aussagen, welche bei einigen Produkten den Rückschluss ermöglichen, dass keine Prüfungen benötigt würden. An anderen Stellen finden sich gegenteilige Behauptungen. Daher zwei konkrete Praxistipps:
- Was die Benannten Stellen sehen wollen
Fast immer wollen die benannten Stellen Prüfungen zu genau den in der Tabelle genannten Endpunkten sehen. Oder zumindest eine Begründung, warum diese weggelassen/ersetzt wurden. - Effekte, die Hersteller diskutieren müssen
Es ist meist nicht möglich, Effekte apriori auszuschließen, die sich ergeben durch Reinigungsmittelrückstände, Produktionsrückstände, Sterilisation, die Aushärtung eines Klebers, das Abdampfen von Lösungsmitteln, Effekte durch Gravuren, Bedruckungen, Materialverunreinigungen beim Extrudieren, unzureichende Polymerisation, Verpackungskomponenten, unzureichende Materialqualitäten, unzulässige Weichmacher oder andere Additive, durch Einfärbungen usw.
c) Keine minderwertigen Materialien verwenden
Mit hochwertigen Ausgangsmaterialien lassen sich viele Probleme von Beginn an vermeiden. So sind zum Beispiel bei einem minderwertigen Polyurethan (PUR) weit über 200 verschiedene Extractables möglich, wenn auch nicht alle auf einmal. Bei einem sehr guten PUR sind hingegen keine Leachables zu erwarten.
d) Prüfungen: Risikobasiert arbeiten
Es benötigt viel Erfahrung, um eine Grenze zu setzen, ab der ein Material nicht mehr als akzeptabel bewertet werden kann. Und natürlich sind diesbezüglich umfangreiche Kenntnisse zu Grenzwerten unerlässlich.
Die meisten Medizinprodukte sind bei der Prüfung der Biokompatibilität unauffällig. Das Verhältnis hängt stark vom Material und Produkttyp ab. Bei den auffälligen Produkten können aber 90% der Abweichungen direkt oder mit ergänzenden Analysen als akzeptabel argumentiert oder durch eine unkomplizierte Optimierung behoben werden.
Nutzen Sie dabei Erfahrungen, um Risiken besser einschätzen zu können, wie:
- Produkt und Produkttyp (Historie)
- Ähnliche Produkte
- Materialien
- Aufbereitung und Produktion des Produkts
5. Fazit
Der Nachweis der Biokompatibilität lässt sich nicht ausschließlich anhand von Datenblättern führen. Daher sind Prüfungen notwendig.
Allerdings sollten diese Prüfungen nicht abschrecken, weil die Kosten dafür sehr überschaubar sind. Das ist die Erfahrung der Experten für Biokompatibilität beim Johner Institut, die bereits mehrere 1000 Medizinprodukte getestet haben.
Diese Minimierung des Prüfungaufwands ist möglich, falls man die richtige Strategie wählt und
- vorhandene Informationen sorgfältig recherchiert,
- mögliche Einflussfaktoren auf die Biokompatibilität zusammenträgt,
- aus beidem Rückschlüsse ableitet und Beweisketten erstellt und
- durch einen risikobasierten Ansatz die Aufwände für die Prüfungen minimiert z. B. unnötige Prüfungen vermeidet.
Änderungshistorie
- 2024-05-02: Hinweise auf weiterführende Artikel ergänzt. Redaktionelle Verbesserungen
- 2019-07-22: erste Version des Artikels erstellt





Hallo Herr Prof. Johner,
als Hersteller von dentalen Medizinprodukten orientieren wir uns nicht ausschließlich an der ISO 10993 sondern eher an der DIN EN ISO 7405:2019-03, da diese nach unserer Sicht um einiges detaillierter im Bereich der biologischen Sicherheit für dentale Produkte konzipiert ist. Sicherlich arbeiten wir auch in Bezug auf die Risikobewertung gemäß ISO 10993-1, aber dennoch fehlen aus unserer Sicht einige Aspekte in Bezug auf den Dentalbereich, welche Beachtung finden sollten. Die Einordnung in Bezug auf erforderliche bzw. empfohlene Prüfungen (ISO 10993-1, Anhang A, Tabelle A.1 + DIN 7405, Anhang A, Tabelle A.1) sind in beiden Normen ziemlich identisch, d.h. die 7405 scheint eher noch mehr zu beachten als die 10993-1. Jetzt stellt sich mir nur die Frage, ob die von Auditorenseite heißgeliebte 10993-1 ausschließlich als Mittel der Wahl gilt oder ob man im speziellen Fall von Dentalprodukten auch bedenkenlos die aktuelle DIN 7405 verwenden kann, vor allem in Bezug auf die Einordnung der durchzuführenden biologischen Untersuchungen. Zudem bezieht sich die 7405 in großen Teilen auf die 10993-1.
Zudem beinhaltet die momentan harmonisierte DIN EN ISO 10993-1:2010-04 noch nicht den Aspekt der chemischen Charakterisierung bzw. ist dieser Punkt in der Tabelle A.1 noch nicht explizit mit aufgeführt. Und die neue Normenversion 2017-04 befindet sich immer noch nur im Entwurfsstatus…
Mir ist bewusst das der Auditor von heute nicht der Auditor von morgen ist und das teilweise leider immer noch viel persönliche Meinung darin steckt, aber rein regulatorisch betrachtet wollen wir natürlich stichhaltig argumentieren können.
Ihre Meinung würde mich in diesem Fall sehr interessieren.
Liebe Grüße
Tobias Bauer
(diese Antwort hatten Sie bereits am 23.07. per Mail erhalten)
Sehr geehrter Herr Bauer,
vielen Dank für Ihren Kommentar und dass Sie ein wichtiges Thema ansprechen
Die ISO 10993-1 verweist explizit (z.B: unter A.1 General) auf die Einbeziehung produktspezifischer Normen, sollten diese vorliegen. Insofern ist eine Orientierung an den Vorgaben der DIN EN ISO 7405 für Ihre Produktpalette zielführend.
Wichtig ist aus unserer Sicht und unserer Erfahrung dennoch, dass unabhängig von der produktspezifischen Norm, die Anforderungen der ISO 10993-1 erfüllt sind.
Im einfachsten Falle müssten dann nur die vorliegenden Ergebnisse bzgl. den Vorgaben der ISO 10993-1 und deren Endpunkte hin, kurz diskutiert werden.
Wenn Sie diese Anforderungen überschreiten, umso besser.
Die Materialcharakterisierung ist schon seit längerem Teil der ISO 10993-1 und explizite Vorgabe (siehe z.B. ISO 10993-1(2009) 6.1 Material characterization), bisher hat dies nur kaum jemand umgesetzt.
Wir hatten Ihnen hierzu ein ausführliches Statement zur Information beigefügt.
Mit sonnigsten Grüßen,
Hendrik Rudolf
Guten Tag,
Ich habe mehr eine formelle, denn eine inhaltliche Frage. Im Anhang zum Durchführungsbeschluss der Kommission über das Mandat zur Harmonisierung von Normen unter MDR ist eine EN ISO 10993-1:2018 gelistet.
Mir ist Stand heute nicht bekannt dass die ISO 10993-1:2018 bereits den Status einer Europäischen Norm hat. Einschlägige Quellen wie Beuth.de zeigen das auch nicht an. Offenbar gilt auf europäischer Ebene gilt offenbar noch immer EN ISO 10993-1:2009/AC2010.
Da man für die Konformitätsvermutung nach MDR die unter MDD harmonisierten Normen nicht mehr heranziehen sollte und wie beschrieben die ISO 10993-1:2018 für die MDR wichtig ist, gibt das meiner Meinung nach eine etwas konfuse Situation, da man grundsätzlich eigentlich immer EN Normen heranziehen sollte zur Erfüllung der MDR. So sieht es ja dann ab 2024 auch wieder die MDR mit den harmonisierten Normen vor. Was ist hier ihr Ratschlag?
Vielen Dank
Hallo, Herr Schwenter,
verfassen Sie einen detaillierten Prüfplan zur Biokomp. und legen Sie diesen der Benannten Stelle zur (Vorab-)Genehmigung vor. Dann 1:1 abarbeiten.
Mehr Antwort, wenn überhaupt eine Antwort kommt, werden Sie in der jetzigen Situation von einer Benannten Stelle kaum erwarten dürfen.
Wir sind weit davon entfernt, halbwegs klare Anforderungen im Bereich der 10993-1 ff zu bekommen. Im Moment wird alles von jedem Prüfer zerpflückt. Früher konnte man noch darauf bauen (oder hoffen), dass bei den Benannten Stellen der „Gesunde Menschenverstand“ noch ansprechbar war.
Beispiel: Partikel-Zahl auf dem sterilen Fertigprodukt. Hier sind keine Grenzwerte definiert. Fragen Sie mal, welche Mengen akzeptabel sind und Sie bekommen die Antwort: „Wir beraten nicht“. Soviel zu den Anforderungen, zu denen Sie anschließend massenweise Abweichungen bekommen.
LG Franz Kettenbaum