Medizinprodukte mit Messfunktion sind etwas Besonderes. Wichtig (u.a.): Messfunktion beeinflusst die Klassifizierung. Doch nicht alles, was misst, hat eine Messfunktion. Bei der Einordnung hilft die MEDDEV 2.1./5.
Wenn medizinische Geräte messen, sind spezielle Regularien zu beachten. Gravierend ist beispielsweise: Die angenehme Regelung, dass Medizinprodukte der Klasse I auch ohne Zulassung durch eine benannte Stelle in Verkehr gebracht werden dürfen, gilt nicht für Geräte mit Messfunktion. Sprich: Wer ein Gerät der Klasse „1m“ vermarkten möchte, muss zwingend eine benannte Stelle einschalten.
Für alle Klassen gilt: Medizinprodukte mit Messfunktion müssen im Vergleich zu anderen Medizinprodukten zusätzliche Anforderungen erfüllen.
Es ist also für den Hersteller nicht unwichtig, ob ein Gerät Messfunktion hat oder nicht. Doch welche Kriterien entscheiden darüber? Praktische Hilfe findet sich in der Leitlinie MEDDEV 2.1/5 der Europäischen Kommission.
MEDDEV 2.1/5: Wann zählt etwas als Messfunktion?
Intuitiv könnte man meinen: Alle Medizinprodukte, die etwas messen, haben selbstredend Messfunktion. Weit gefehlt! Die Regularien haben unter anderem den Sinn, Gefahren zu vermeiden. Die Definition einer „Messfunktion“ ist deshalb so gefasst, dass sie nur „regulierungswürdiges“ einbezieht.
Regeln zur Klassifizierung
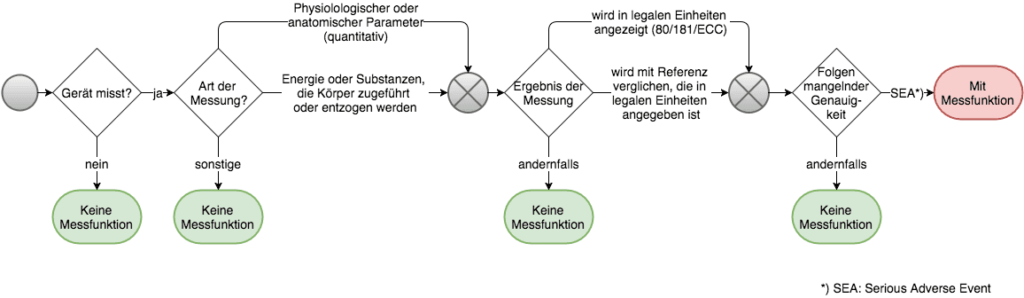
Gemäß MEDDEV 2.1/5 müssen genau drei Bedingungen gemeinsam erfüllt sein, damit ein Gerät als Medizinprodukt mit Messfunktion gilt:
- Das Produkt soll entweder einen physiologischen oder anatomischen Parameter quantitativ messen oder die Menge der Energie bzw. von Substanzen, die dem Körper zugeführt oder entzogen werden sollen.
- Das Ergebnis wird in legalen Einheiten (gemäß 80/181/EEC) angezeigt oder mit einem Referenzwert verglichen, der ebenfalls in diesen Einheiten angegeben sein muss.
- Die Zweckbestimmung nennt eine Genauigkeit oder lässt eine solche vermuten, die gegeben sein muss, um schwerwiegende unerwünschte Ereignisse zu vermeiden.
Anhand dieser Kriterien lässt sich also prinzipiell feststellen, ob ein Medizinprodukt Messfunktion im Sinne der MedDev 2.1/5 hat oder nicht. Im folgenden Flussdiagramm ist eine mögliche Folge von Entscheidungsschritten dargestellt:
Beispiele
Um die Klassifizierungsregeln zu verdeutlichen und im Einzelfall die Entscheidung zu unterstützen und zu erleichtern, gibt die MedDev 2.1/5 Beispiele für Produkte mit und ohne Messfunkion.
Als Beispiele für Medizinprodukte mit Messfunktion nennt die MEDEV 2.1/5
- Temperaturmessgeräte
- Nicht-aktive, nicht invasive Blutdruckmessgeräte (gemeint sind u.a. die mit Quecksilbersäule)
- Nicht-aktive Messgeräte für den Augeninnendruck
Als Beispiele für Medizinprodukte ohne Messfunktion nennt die MEDDEV 2.1/5
- Medikamentenlöffel oder Pipetten ohne Messskala in legalen Messeinheiten.
- Tafeln mit Buchstaben verschiedener Größe für den Augentest
- Produkte, die nur Trends von Messwerten ohne Skala anzeigen.
Die Beispiele machen deutlich: Vor allem für die Klasse I ist es wichtig, Produkte mit Messfunktion von solchen ohne Messfunktion abzugrenzen. Denn hier bedeutet „Messfunktion“, dass eine Benannte Stelle eingeschaltet werden muss – was für Klasse-I-Produkte ohne Messfunktion nicht nötig ist.
Dennoch ist die Abgrenzung im Einzelfall manchmal schwierig oder nicht eindeutig.
Konsequenzen der Klassifizierung als „Medizinprodukt mit Messfunktion“
Zusätzliche grundlegende Anforderungen
Doch nicht nur für Klasse-I-Produkte ist wichtig, ob sie Messfunktion haben oder nicht. Für sämtliche Geräte gilt: Die Medizinprodukterichtlinie stellt im Absatz 10 des Anhangs I (grundlegende Anforderungen) zusätzliche Ansprüche an Produkte mit Messfunktion:
| 10.1. | Produkte mit Messfunktion müssen so ausgelegt und hergestellt sein, dass unter Berücksichtigung angemessener Genauigkeitsgrenzen entsprechend der Zweckbestimmung des Produkts eine ausreichende Konstanz und Genauigkeit der Messwerte gewährleistet sind. Die vom Hersteller gewählten Genauigkeitsgrenzen sind von ihm anzugeben. |
| 10.2. | Messskalen, Bedienungs- und Anzeigeeinrichtungen müssen so ausgelegt sein, dass sie unter Berücksichtigung der Zweckbestimmung des Produkts ergonomischen Grundsätzen entsprechen. |
| 10.3. | Bei Produkten mit Messfunktionen sind die gesetzlichen Einheiten im Messwesen gemäß den Vorschriften der Richtlinie 80/181/EWG des Rates zu verwenden. |
Finden Sie hier einen weiterführenden Artikel zur Richtlinie 80/181/EWG, die vor allem vorschreibt, welche Messeinheiten zu verwenden sind. Das sind nicht nur SI-Einheiten. Weiter fordert die Richtlinie für diese Produkte: Die Gebrauchsanweisung muss angeben, wie genau die Messung ist.
Einschränkung der Konformitätsbewertungsverfahren
Als wichtigstes Fazit für Hersteller ergibt sich: Die schöne Regel, dass Medizinprodukte der Klasse I ohne Benannte Stelle in Verkehr gebracht werden dürfen, gilt nicht für Medizinprodukte mit Messfunktion. Für Geräte mit Messfunktion muss der Hersteller eine Benannte Stelle einschalten und ein Konformitätsbewertungsverfahren „nach Anhang II, IV, V oder VI anwenden“.
Die Benannte Stelle prüft allerdings bei Klasse-Im-Produkten nur, ob die Geräte die messtechnischen Anforderungen erfüllen. Bei Produkten höherer Klassen werden diese entsprechend den obigen Ausführungen als zusätzliche Anforderungen geprüft.
Es ist also in jedem Falle von Bedeutung, wenn auch nicht immer einfach zu entscheiden, ob ein medizinisches Gerät Messfunktion hat oder nicht.
Mit Dank für Lektorat an unseren Kollegen Dr. Franz Mechsner





Hallo Herr Johner,
kann eine Stand-Alone-Software als Medizinprodukt mit Messfunktion angesehen werden?
Man kann mit der Software zwar nicht messen, aber Messdaten manipulieren und für den Anwender aufbereiten.
Danke für die Antwort!
Grüße aus Freiburg – Sándor Áts
Sehr geehrter Herr Ats,
bei der Software würde man davon ausgehen, dass sie zusammen mit der Hardware die Messung macht. Bei Software, die andere Medizinprodukte kontrolliert oder beeinflusst, fällt in die gleich Klasse wie das andere Medizinprodukte. Wenn das andere Produkt (Hardware) aber kein Medizinprodukt ist, darf der Hersteller die Kombination nicht ohne Konformitätsbewertung in Verkehr bringen (Artikel 12 MDD). Dann stellt sich die Frage gar nicht.
Wenn die Software hingegen Daten von einem einem Medizinprodukt „nur“ manipuliert und aufbereitet, läge keine Messfunktion vor. Damit ist aber nicht gesagt, dass standalone Software kein Produkt mit Messfunktion sein kann.
Beste Grüße, Christian Johner
Sehr geehrter Herr Johner,
erstmal vielen herzlichen Dank für den aufschlussreichen Artikel! Anhand Ihres aufgezeigten Flussdiagramms wird klar, dass ein Medizinprodukt erst dann eine Messfunktion besitzt wenn als Folge der mangelnden Genauigkeit ein schwerwiegendes unerwünschtes Ereignis eintritt.
Besitzt somit auch ein gewöhnlicher Messbecher (mit legaler Skala) für einen Hustensaft eine Messfunktion? Ich für meinen Teil tue mir schwer in diesem Fall ein schwerwiegendes Ereignis zu sehen wenn der Messbecher nicht eine exakte Genauigkeit verspricht. Wie sehen Sie diesen Fall?
Vielen Dank im Voraus!
Beste Grüße,
Marius Berthel
Danke für das positive Feedback, Herr Berthel!
Die Antwort auf die Frage müsste in der Risikomanagementakte zu finden sein. Ich bin nicht tief genug in der Thematik Hustensaft.
Spontan würde ich keine Messfunktion im Sinn des MPGs sehen. Allerdings muss man prüfen, ob nicht das AMG greift.
Bei normalen Gläsern (z.B. Biergläser) greift noch eine Messverordnung, weshalb diese Gläser ebenfalls eine benannte Stelle einbeziehen müssen — natürlich keine für Medizinprodukte. Auch diesen Rechtsrahmen sollte man überprüfen.
Viele Grüße, Christian Johner
Guten Tag Herr Johner
D.h. eine Sauerstoffflasche mit einem Manometer (Einheit: bar), die an ein Beatmungsgerät angeschlossen wird, enthält keine Messfunktion, da die Sauerstoffflasche primär das Beatmungsgerät mit Sauerstoff versorgt und nicht direkt dem Patienten verabreicht wird.
Gespannt sehe ich Ihrer Antwort entgegen.
Beste Grüsse
T. Fritschi
Sehr geehrter Herr Fritschi,
Sie bitten um eine Antwort. Ich bräuchte noch Ihre Frage.
Die einzige Frage, die ich ggf. zwischen den Teilen erkennen könnte, wäre die, ob die Sauerstoffflasche eine Messfunktion enthält. Genau das haben Sie aber selbst ausgeschlossen.
Mit Ihrer kurzen Hilfe wird es mir (hoffentlich) besser gelingen, zu antworten.
Mit der Bitte um Nachricht für meine mögliche Begriffsstutzigkeit und mit viele Grüßen, Christian Johner
Sehr geehrter Herr Prof. Dr. Johner,
zunächst möchte auch ich mich sehr herzlich für die ausführliche Darlegung der Rechtslage zu Geräten mit Messfunktion im Sinne des MPGs bedanken.
Für mich stellt sich die Frage, ob einfache Messgeräte aus dem Bereich Physiotherapie/Orthopädie wie Winkelmesser, Inklinometer, Massbänder oder Dynamometer (Kraftmessgeräte) als „regelungswürdig“ im Sinne des MPGs gesehen werden oder nicht. Es handelt sich insgesamt um Messgeräte, welche auch bei moderaten Messfehlern keinen Schaden am Patienten anrichten könnten.
Vielen Dank im Voraus für Ihr Bemühen
Mit besten Grüßen:
R. Bruzek
Sehr geehrter Herr Bruzek
wenn aus einer falschen bzw. ungenauen Messung keine schwerwiegenden unerwünschten Ereignisse entstehen können, dann ist es keine Messfunktion im Sinne des Gesetzes. Allerdings unterscheidet die MEDDEV dabei nicht die Größe des Messfehlers. Ob ein größerer Messfehler solche Ereignisse provozieren kann, weiß ich nicht. Das müsste in Ihrer Risikomanagementakte stehen und in der klinischen Bewertung diskutiert sein.
Beste Grüße, Christian Johner
Sehr geehrter Herr Prof. Dr. Johner,
Erst einmal vielen Dank für die informative und nachvollziehbare Aufstellung des Sachverhalts.
Müsste Ihrer Ansicht nach eine Standalone-Software eine Messfunktion zugeschrieben bekommen, wenn sie lediglich Berechnungen anhand der manuellen Eingaben eines Anwenders ausführt? Im Speziellen bezieht sich meine Frage auf eine Software zur Auswertung von Fernröntgenbildern, bei denen anatomische Messpunkte durch Anklicken am Computerbildschirm gesetzt werden.
Beste Grüße,
T. Haberl
Sehr geehrter Herr Haberl,
danke für Ihre Frage!
Aus den Informationen gelingt es mir noch nicht, eine Antwort zu geben. Insbesondere die Frage mit Risiken kann ich nicht einschätzen. Die anderen Kriterien, z.B. dass ein nummerischer Wert in SI-Einheiten bestimmt wird, scheinen gegeben zu sein.
Beste Grüße, Christian Johner
Sehr geehrter Herr Prof. Dr. Johner,
Um meine obige Fragestellung zu präzisieren:
Die Software dient der kephalometrischen Auswertung von Fernröntgenbildern eines Patientenschädels. Es besteht keine direkte Anbindung an ein Röntgengerät; stattdessen werden Röntgenbilder von beliebiger Quelle als Bilddatei geladen. Der Anwender bestimmt vorgegebene anatomische Messpunkte (Sella, Nasion, etc.) durch Anklicken der entsprechenden Positionen auf dem in der Software angezeigtem Röntgenbild. Aus diesen Pixelkoordinaten werden anschließend numerische Werte wie Winkel, Distanzen, Verhältnisse, etc., zwecks kieferorthopädischer Diagnose und Behandlungsplanung berechnet.
Zwar werden die berechneten Werte in SI-Einheiten ausgegeben, jedoch ist die Messgenauigkeit prinzipbedingt von der Sorgfalt des Anwenders und der Qualität der Bilddaten abhängig. Ist also die bloße Umrechnung von Pixelkoordinaten auf diagnostische Werte als Messfunktion zu bezeichnen?
Beste Grüße,
T. Haberl
Sehr geehrter Herr Haberl,
Sie stellen eine spannende Frage, die in Unkenntnis der möglichen Schäden und der erklärten Genauigkeit nicht zu beantworten ist. Genau das benötigt man aber, um die Entscheidung c) in MEDDEV 2.1/5 treffen zu können.
Die Tatsache, dass die Benutzer einen Einfluss auf die „Messung“ haben, ist für die Bewertung unerheblich.
Es gibt andere Medizinprodukte, mit denen man Strecken oder Volumina in radiologischen Bildern vermisst, die als Produkt mit Messfunktion definiert werden.
Viele Grüße, Christian Johner
Sehr geehrter Herr Prof. Dr. Johner,
vielen Dank für die sehr strukturierte Darstellung der bisherigen regulatorischen Situation. Hat sich diese durch die MDCG 2019-15 zu Klasse-I-Produkten verändert, die unter „Definitions“ auch „Class I medical devices with measuring function“ aufführt. Der dortige Passus enthält nur die ersten zwei Bedingungen der MEDDEV 2.1/5, aber die dritte Bedingung zur Risikorelevanz ist nicht aufgeführt.
Vielen Dank im voraus!
Mit besten Grüßen,
Manfred Weiser
Sehr geehrter Herr Weiser,
danke für die ausgezeichnete Frage. Ich fürchte, dass es momentan generell noch keine abschließende Klarheit über die MEDDEV Guidelines gibt. Diese wurden explizit für die Richtlinien veröffentlicht. Daher sagen viele (darunter auch Benannte Stellen), dass diese unter der MDR keine Gültigkeit haben. Gleichzeitig gibt es Benannte Stellen, die die MEDDEV 2.7/1 weiter einfordern und sich auf den Stand der Technik berufen.
Bei der MEDDEV 2.1/5 würde ich davon ausgehen, dass die Regeln weiter gelten. Denn man will ja nicht auf jedes jedes Produkt, das „ein bisschen was misst“ gleich die Benannten Stellen loslassen. Das widerspräche dem Gedanken einer risikobasierten Klassifizierung bzw. Zulassung.
Falls es jedoch zu einer Klage käme, wäre wäre man einem wahrscheinlich ziemlich unverhersehbaren Urteil ausgesetzt.
Beste Grüße, Christian Johner
Sehr geehrter Herr Johner,
wie lesen Sie die neu erschienene MDCG 2021- 24? Dort ist ja im Risikokriterium von einem „significant adverse effect“ die Rede – leider ein Begriff, der nicht definiert ist.
Herzliche Grüße
Frank Müller
Lieber Herr Müller,
ich bitte noch um ein wenig Geduld. Wir werden Ihnen zeitnah antworten!
Herzliche Grüße
Anja Segschneider | Redaktion
Lieber Herr Müller,
danke für Ihre wichtige Frage und für Ihre Geduld!
Das „significant adverse event“ würde ich mit dem „serious adverse event“ der MDR gleichsetzen. Das ist definiert als
(a) death,
(b) serious deterioration in the health of the subject, that resulted in any of the following:
(i) life-threatening illness or injury,
(ii) permanent impairment of a body structure or a body function,
(iii) hospitalisation or prolongation of patient hospitalisation,
(iv) medical or surgical intervention to prevent life-threatening illness or injury or permanent impairment to a body structure or a body function,
(v) chronic disease,
(c) foetal distress, foetal death or a congenital physical or mental impairment or birth defect;
Dass sich die Regulatoren auf keine einheitliche Begriffswelt einigen können, ist schon bedauerlich.
Ich danke Ihnen nochmals!
Viele Grüße
Christian Johner
Sehr geehrter Johner, der Artikel ist zwar schon sehr alt und mittlerweile gilt auch die MDR. Nun aber die Frage, ob die MEDDEV 2.1/5 noch gilt unter der MDR für die genau Definition einer „Messfunktion“ oder ob es nun schon ein MCDG Paper hierfür gibt bzw. welches offizielles Paper hierfür herangezogen werden kann, VG Sefan Kieslinger
Hallo Herr Prof. Johner, jetzt hab ich gerade im Chat Verlauf gelesen, dass hierzu allerdings schon eine Frage von Herrn Manfred Weiser am Dnnerstag, 29. Oktober 2020 um 13:23 Uhr gestellt wurde auf diese Sie dann am 29.Oktober 2020 um 18:46 Uhr geantwortet haben:
Sehr geehrter Herr Weiser,
danke für die ausgezeichnete Frage. Ich fürchte, dass es momentan generell noch keine abschließende Klarheit über die MEDDEV Guidelines gibt. Diese wurden explizit für die Richtlinien veröffentlicht. Daher sagen viele (darunter auch Benannte Stellen), dass diese unter der MDR keine Gültigkeit haben. Gleichzeitig gibt es Benannte Stellen, die die MEDDEV 2.7/1 weiter einfordern und sich auf den Stand der Technik berufen.
Bei der MEDDEV 2.1/5 würde ich davon ausgehen, dass die Regeln weiter gelten. Denn man will ja nicht auf jedes jedes Produkt, das „ein bisschen was misst“ gleich die Benannten Stellen loslassen. Das widerspräche dem Gedanken einer risikobasierten Klassifizierung bzw. Zulassung.
Falls es jedoch zu einer Klage käme, wäre wäre man einem wahrscheinlich ziemlich unverhersehbaren Urteil ausgesetzt.
gibt es mittlerweile neu Erkenntnisse bzw. eben neue Vorgaben oder gilt hierzu nach wie vor die MEDDEV 2.1/5
VG stefan Kieslinger
Lieber Herr Kiesling,
danke für Ihre wichtige Frage! Dass der Artikel nicht aktualisiert wurde, hat einen einfachen Grund: Es gibt leider noch nichts Neues. D.h. wir befinden uns streng genommen in einem regulatorischen Vakuum. Offiziell gelten die MEDDEV Dokumente nicht mehr. Allerdings nutzen viele Benannte Stelle in Ermangelung von neueren Regulierungen diese weiterhin.
Hilft Ihnen das? Falls nicht, dann haken Sie gerne nach.
Beste Grüße,
Christian Johner
Guten Tag Herr Prof. Dr. Johner,
wenn man mittels IMU den Winkelverlauf eines Gelenks bei einer Ganganalyse abbildet und die Normal-Werte aus der Literatur als Referenz überlagert, handelt es sich aus technischer Sicht um eine Messung.
Wie wäre dies aus medizinischer Sicht bzw. nach den Regularien der Einstufung in Klasse I mit Messfunktion?
Die Interpretation wird dem Physio/Arzt überlassen.
Die Genauigkeit der IMUs ist bereits belegt.
Schöne Grüße
Sehr geehrter Herr Schmidt,
danke für Ihre Frage! Da die Einstufung auch vom Risiko abhängig, müsste ich diese noch kennen, um fundiert antworten zu können.
Die Einstufung durch den Physio/Arzt ändert wahrscheinlich v.a. die Wahrscheinlichkeit, nicht so sehr den Schweregrad. Letzterer ist bei der Klassifizierung wesentlich.
Beste Grüße, Christian Johner
Guten Morgen Herr Prof. Dr. Johner,
vielen Dank für die schnelle Antwort!
Der Patient bewegt sich letztlich wie im Alltag und die Sensoren (IMUs) tracken lediglich die Bewegung, ohne in die Bewegung einzugreifen. Es ist somit eine Ist-Aufnahme des aktuellen Standes des Patienten/Probanden. Ahnlich einer Videoaufnahme mit einer Kamera. Der Vorteil dei den Sensoren ist, dass man sich auf keine Ansicht beschränken muss und quasi eine 360° Rundum-Ansicht bekommt. Da der Sensor auch nur 5g wiegt wird das Tragen zudem nicht wahrgenommen und hat somit keinen Einfluss.
Ein Risiko für den Patienten sehe ich dort nicht.
Ich hoffe in diese Richtung zielte Ihre Frage.
Schöne Grüße
Hugo Schmidt
Genau, danke Herr Schmidt!
Damit sehe ich kein schwerwiegendes unerwünschtes Ereignis als mögliche Folge. Damit ist es keine Messfunktion im Sinne der Klassifizierung / MEDDEV.
Viele Grüße
Christian Johner