Gesundheitsanbieter wie Krankenhäuser, Klinken, Praxen und Labore unterliegen umfangreichen regulatorischen Anforderungen. Genau wie die Medizinproduktehersteller.
Inhalt
Diese Seite stellt wichtige Fachartikel für diese Anwender und Betreiber zusammen.
- Regulatorische Anforderungen
- IT in Krankenhäusern und Praxen
- Umgang der Krankenhäuser mit Medizinprodukten
- Unterstützung für Krankenhäuser
1. Regulatorische Anforderungen
a) Regulatorische Anforderungen an die Betreiber
Den übergeordneten gesetzlichen Rahmen bilden die EU-Medizinprodukteverordnungen MDR und IVDR. Ein Artikel beleuchtet deren Auswirkungen auf Gesundheitseinrichtungen wie Krankenhäuser.
In Deutschland werden diese Anforderungen konkretisiert durch
Alle drei betreffen explizit auch Krankenhäuser und andere Betreiber.
Aus der MPBetreibV folgt die Pflicht zum Führen eines Medizinproduktebuchs.
Eine zentrale gesetzliche Vorgabe ist das Risikomanagement der Krankenhäuser.
b) Spezielle Anforderungen an die medizinischen Labore
Die EU reguliert medizinische Labore. Deshalb sollten diese sich mit den Anforderungen an Inhouse IVD (LDT) und die Laborprodukte „For Research Use Only“ (RUO) vertraut machen.
2. IT der Krankenhäuser, Labore und Praxen
Die Digitalisierung der Krankenhäuser schreitet (zu) langsam voran und stellt die IT der Krankenhäuser und Arztpraxen vor große Aufgaben.
a) Krankenhaus-IT aus regulatorischer Sicht
Die Krankenhaus-IT sollte aus regulatorischer Sicht bei diesen Punkten besonders aufpassen:
b) Anforderungen an die IT-Sicherheit
Einen Einstieg liefert der Artikel IT-Sicherheit im Gesundheitswesen.
Die IEC 80001-1 gibt Vorgaben zum Risikomangement bei der Krankenhaus-IT.
Hersteller müssen Sicherheitsprobleme melden. Deren Schweregrad können sie mithilfe des Common Vulnerability Scoring System (CVSS) einteilen.
Sie sollten Security Patches einspielen und die regulatorischen Implikationen kennen.
c) Anforderungen an den Datenschutz in Krankenhäusern
Die IT-Sicherheit ist eine Grundlage für den Datenschutz. Eine Einführung liefert der Artikel Datenschutz im Gesundheitswesen bei medizinischen Daten.
Ein Weg, um die Datenschutzanforderungen zu erfüllen, ist die Anonymisierung und Pseudonymisierung von personenbezogenen Daten.
All dies muss ein Datenschutzbeauftragter im Gesundheitswesen überwachen.
d) Spezielle Systeme
Mitarbeiter der Krankenhaus-IT haben vielerlei Systeme auszuwählen, zu installieren und zu administrieren:
Eine besondere Herausforderung ist die Interoperabilität dieser Produkte.
3. Umgang der Krankenhäuser mit Medizinprodukten
a) Anforderungen an konkrete Tätigkeiten
Gesetze und Normen stellen Anforderungen an alle Phasen des Produktlebenszyklus:
In diesem Kontext ist die Festlegung der Lebensdauer von Medizinprodukten entscheidend.
b) Anforderungen an spezielle (Medizin-)Produkte
Zudem gibt es Anforderungen an spezielle Typen von Produkten:
4. Unterstützung für Krankenhäuser und andere Betreiber
Haben Sie Fragen zur Auswahl, Anwendung und zum Betrieb von Medizinprodukten in Krankenhäusern, Laboren, Praxen und bei anderen Gesundheitsdienstleistern? Antworten erhalten Sie in unserem kostenlosen Micro-Consulting.
Die Seminare des Johner Instituts verschaffen den Mitarbeitenden in Gesundheitsanbietern einen guten Einstieg in Themen wie:
PDMS steht für Patientendatenmanagementsystem. Diese klinischen Informationssysteme finden sich typischerweise in Krankenhäusern, v. a. in den Abteilungen, die Patienten intensivmedizinisch behandeln. Durch die Förderungen des Krankenhaus-Zukunftsgesetzes (KHZG) erleben die PMDS einen neuen Boom. Dieser Artikel
Weiterlesen
Die Telematikinfrastruktur (TI) ist eine Plattform bzw. ein Netzwerk, über das in Deutschland Gesundheitsdaten sicher ausgetauscht werden und auf der Gesundheitsanwendungen wie die elektronische Patientenakte und das e-Rezept betrieben werden sollen. Dieser Beitrag hilft Herstellern medizinischer Software zu verstehen, wann sie welche gesetzlichen und technischen Anforderungen im Kontext dieser Telematikinfrastruktur erfüllen müssen.
Weiterlesen
Medizinprodukte- und IVD-Hersteller verwenden zunehmend Cloud-Dienste: Erfahren Sie, welche Möglichkeiten Hersteller haben, um Cloud-Dienste wie Medical Clouds zu nutzen und dennoch die regulatorischen Anforderungen an z. B. den Datenschutz zu erfüllen.
Weiterlesen
Gesetze fordern das Risikomanagement im Krankenhaus, vor allem, um die Patientensicherheit zu verbessern. Dennoch tun sich viele Krankenhäuser damit schwer. Dieser Artikel stellt die wichtigsten regulatorischen Anforderungen vor und gibt Tipps zur Umsetzung.
Weiterlesen
Eine Annahme hält sich hartnäckig: Allgemeiner Laborbedarf wie PCR-Cycler, NGS-Geräte, Fragment-Analyzer, Zentrifugen, Pipettier-Roboter und Extraktionskits müssen eine CE-IVD-Kennzeichnung tragen. Stimmt das? Es fehlt oft Klarheit darüber, Daher gibt es Unsicherheiten, um sich nicht strafbar zu machen. Dieser Artikel verschafft Klarheit und gibt Herstellern und Betreibern (z. B. medizinischen Laboren) konkrete Tipps, um regulatorischen Ärger und…
Weiterlesen
Dass Gesetze und Normen die IT-Security auch bei „Legacy Devices“ einfordern, ist verständlich. Die Art, wie diese Anforderungen formuliert werden, führt allerdings oft zu Verwirrung. Beispielsweise konnten sich Gesetzgeber und Normenkomitees nicht auf gemeinsame Definitionen einigen. So geht es einmal um die IT-Sicherheit bei Legacy Devices, einmal um die IT-Sicherheit von Altprodukten bzw. von Bestandsprodukten…
Weiterlesen
Den Begriff „Probenahme-Set“ definiert weder die IVDR noch eine andere Regularie. Dennoch gibt es (indirekte) regulatorische Anforderungen, die IVD-Hersteller und medizinische Labore kennen und beachten müssen. Die Anforderungen hängen von der jeweiligen Konstellation ab. Dieser Artikel stellt fünf Konstellationen vor. Er verschafft damit Klarheit und hilft, regulatorischen Ärger zu vermeiden und regulatorische Aufwände zu minimieren.
Weiterlesen
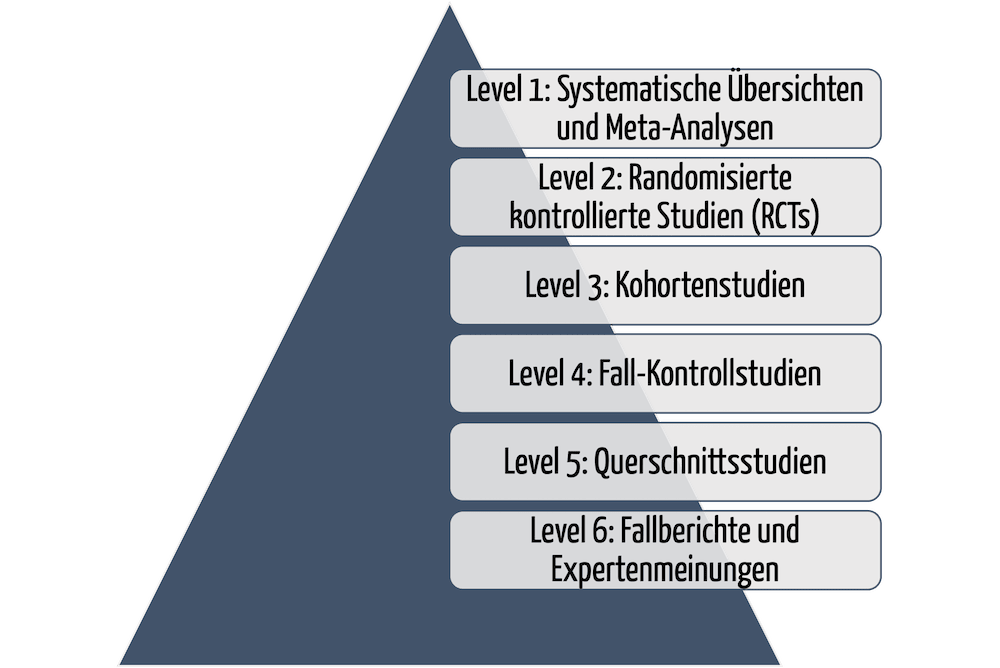
Nur durch klinische Evidenz – wirkliche Beweise – können Hersteller die Sicherheit, Leistungsfähigkeit und Wirksamkeit ihrer Medizinprodukte nachweisen. Doch wann ist ein Beweis stichhaltig genug? Sprich: Wann liegt eine ausreichende klinische Evidenz vor, welche Behörden und Benannte Stellen akzeptieren? Dieser Artikel beantwortet die Fragen und verschafft einen kompakten Einstieg in das Thema „Klinische Evidenz“.
Weiterlesen
Über die Stilllegung bzw. Außerbetriebnahme von Medizinprodukten und über das Ende der Vermarktung wird wenig geschrieben. Dafür thematisieren hunderte Artikel die Inbetriebnahme und Inverkehrbringung von Medizinprodukten. Doch Hersteller und Betreiber stehen häufiger vor der Frage, ob und wie sie ihre Medizinprodukte stilllegen, deren Vermarktung beenden und idealerweise die Verantwortung für diese „Altprodukte“ loswerden können. Dieser…
Weiterlesen
Der Begriff „Medizinprodukte-PC“ ist nicht eindeutig definiert. Allerdings verstehen unter einem Medizinprodukte-PC die meisten Abhängig von den Konstellationen müssen die Hersteller unterschiedliche regulatorische Anforderungen erfüllen. Diese werden im vorliegenden Artikel vorgestellt.
Weiterlesen