Unter Interoperabilität versteht man die Fähigkeit eines Systems (z. B. eines Medizinprodukts oder einer Software), mit anderen Systemen zusammenzuarbeiten.
Inhalt
Sie finden auf dieser Seite eine kurze Einführung in das Thema Interoperabilität sowie Verweise auf weiterführende Fachartikel zu den folgenden Themen:
- Interoperabilitätsebenen
- Regulatorische Anforderungen an die Interoperabilität
- Unterstützung (auch bei DiGA)
1. Interoperabilitätsebenen
Die Interoperabilität setzt gemeinsame „Absprachen“ auf vier Interoperabilitätsebenen voraus:
| Ebene |
Aufgabe |
Beispiele für Standards |
| Organisatorische Ebene |
Systemübergreifende Prozesse, Rollen, Berechtigungen ermöglichen |
IHE |
| Semantische Ebene |
Einheitliches Verständnis der Informationseinheiten erlangen |
Taxonomien, Klassifikationssysteme, Nomenklaturen wie ICD-10, ICF, LOINC, UCUM, ATC sowie die Wertetabellen von HL7, FHIR und DICOM |
| Syntaktische Ebene |
Informationseinheiten im Datenstrom identifizieren |
Formate wie XML, JSON, HL71, DICOM1 |
| Strukturelle Ebene |
Datenstrom von einem zum anderen System übertragen |
Protokolle z.B. des OSI-Schichtenmodells (TCP/IP, FTP, http), RS232, I2C u.v.m. |
1 HL7 und DICOM standardisieren nicht nur die syntaktische Ebene.
Achtung!
Achten Sie darauf, dass Sie in der System Requirements Specification und der Software Requirements Specification alle vier Interoperabilitätsebenen adressieren, nicht nur die unterste, wie häufig zu finden.
2. Regulatorische Anforderungen an die Interoperabilität
a) MDR und IVDR
Definition
Die MDR definiert den Begriff Interoperabilität.
Definition: Interoperabilität
Fähigkeit von zwei oder mehr Geräten, einschließlich Software, vom gleichen oder von unterschiedlichen Herstellern
- Informationen auszutauschen und die ausgetauschte Information für die korrekte Ausführung einer spezifizierten Funktion zu nutzen, ohne den Inhalt der Daten zu verändern oder/und
- untereinander zu kommunizieren oder/und
- wie spezifiziert zusammen zu arbeiten.
Medizinprodukte-Verordnung (MDR) Artikel 2.26
Grundlegende Sicherheits- und Leistungsanforderungen
MDR und IVDR fordern nicht explizit die Interoperabilität. Aber zu den grundlegenden Sicherheits- und Leistungsanforderungen zählen sie:
Wenn ein Produkt zur Verwendung in Kombination mit anderen Produkten oder Ausrüstungen bestimmt ist, muss die Kombination einschließlich der Verbindungen sicher sein und darf die vorgesehene Leistung der Produkte nicht beeinträchtigen. (MDR, Anhang I, Abschnitt 14.1)
Auch müssen „Risiken im Zusammenhang mit der möglichen negativen Wechselwirkung zwischen Software und der IT-Umgebung, in der sie eingesetzt wird und mit der sie in Wechselwirkung steht“, ausgeschlossen oder so weit wie möglich reduziert werden.
Änderungen von „Interoperabilitätskanälen“
Wenn Hersteller die „Interoperabilitätskanäle“ ändern (sprich: die Spezifikation einer bestehenden Schnittstelle ändern oder eine neue Schnittstelle hinzufügen), hat das Folgen:
- Die Software (falls es eine Standalone-Software ist) muss eine neue UDI-DI erhalten.
- Die Änderung zählt als wesentliche Änderung, was den „Bestandsschutz“ von Produkten verwirkt, die unter einem MDD-Zertifikat in den Verkehr gebracht wurden.
b) Anforderungen an DiGA
Hersteller von digitalen Gesundheitsanwendungen (DiGA) müssen die Interoperabilität ihrer Produkte nachweisen. Das BfArM fasst diese Anforderungen gut zusammen:
Interoperabilität ist somit ein wesentliches Qualitätsmerkmal von DiGA und fällt damit unter die Anforderung in § 139e Absatz 2 SGB V. Weiter ausgeführt wird dieses in den §§ 5 und 6 DiGAV und in der Anlage 2 zur DiGAV (Rubrik „Interoperabilität“). Hier wird festgeschrieben, welche Schnittstellen einer DiGA als interoperabel auszugestalten sind und wie Interoperabilität durch die Nutzung von Standards realisiert werden muss.
c) FDA
Auch die FDA stellt Anforderungen an die Interoperabilität.
3. Unterstützung
Haben Sie noch Fragen zur Interoperabilität oder zu DiGA? Dann nutzen Sie das kostenfreie Micro-Consulting.
Mit dem Auditgarant lernen Sie dank zahlreicher Videotrainings die Interoperabilitätsebenen genauer kennen. Sie werden Schritt für Schritt angeleitet, wie Sie bei der Software- bzw. Systemspezifikation das Modell der Interoperabilitätsebenen nutzen und so eine schlanke und „auditsichere“ Dokumentation erstellen können.
Unsere Expertinnen und Experten helfen Ihnen gerne, Ihre DiGA schnell und sicher zu „zertifizieren“ und ins DiGA-Verzeichnis des BfArM zu bringen. Melden Sie sich gerne!
Am 01. Oktober 2021 soll die neue Gesundheits-IT-Interoperabilitäts-Governance-Verordnung (oder IOP Governance-Verordnung, kurz GIGV) in Kraft treten. Einen Referentenentwurf hat das Bundesgesundheitsministerium (BMG) bereits publiziert. Die Zustimmung des Parlaments ist nicht notwendig. In diesem Artikel erfahren Sie, was die Verordnung fordert und ob Sie davon betroffen sind.
Weiterlesen
Die Digitale Gesundheitsanwendungen-Verordnung (DiGAV) ist für die Hersteller von digitalen Gesundheitsanwendungen die wichtigste gesetzliche Vorgabe. Die DiGAV bestimmt die Voraussetzungen für eine Erstattung von digitalen Gesundheitsanwendungen (DiGA) durch die Krankenkassen. Erfahren Sie, welche Anforderungen die Verordnung an die Hersteller stellt. So können Sie entscheiden, ob ein Antrag erfolgversprechend ist und ob die Kosten dafür im…
Weiterlesen
Die Telematikinfrastruktur (TI) ist eine Plattform bzw. ein Netzwerk, über das in Deutschland Gesundheitsdaten sicher ausgetauscht werden und auf der Gesundheitsanwendungen wie die elektronische Patientenakte und das e-Rezept betrieben werden sollen. Dieser Beitrag hilft Herstellern medizinischer Software zu verstehen, wann sie welche gesetzlichen und technischen Anforderungen im Kontext dieser Telematikinfrastruktur erfüllen müssen.
Weiterlesen
FHIR ist inzwischen der Standard für den Datenaustausch im Gesundheitswesen. Moderne klinische Informationssysteme, viele Medizinprodukte und selbst Health-Apps kommen an FHIR nicht vorbei. FHIR steht für „Fast Healthcare Interoperability Resources“ und wird wie das englische „fire“ ausgesprochen. Dieser von HL7 ins Leben gerufene Standard soll alle „Use Cases“ abdecken: vom Abfragen von Versicherungsstammdaten über den…
Weiterlesen
Zunehmend finden autonome Systeme auch in der Medizin Verwendung. Zu diesen autonomen Systemen zählen einzelne Medizinprodukte wie OP-Roboter. Aber auch Kombinationen einzelner (Medizin-)Produkte bilden autonome Systeme. Vielen Medizinprodukteherstellern und Krankenhäusern ist nicht klar,
Weiterlesen
Viele Digital Health Technologien und Anwendungen wie Machine Learning und Connected Home stehen im Gartner Hype Cycle gerade auf dem Gipfel der überzogenen Erwartungen. Hingegen durchleiden viele E-Health Technologien wie „Healthcare Master Data Management“ gerade das Tal der Tränen. Lernen Sie in diesem Artikel Digital Health und E-Health besser abzugrenzen. Erfahren Sie, wie die Politik…
Weiterlesen
LOINC, die Logical Observation Identifiers Names and Codes, sind ein vom Regenstrief Institute gepflegtes System, um v.a. Laborparameter und Vitaldaten semantisch eindeutig zu verschlüsseln. Zunehmend findet das System auch in Deutschland Beachtung, auch von den Medizintechnik-Unternehmen. Die FDA legt diesen semantischen Standard besonders den IVD-Herstellern nahe. Mit Recht! Inhaltsübersicht Ziele von LOINC » Achsen » Zusammenspiel…
Weiterlesen
Die FDA hat das Guidance Dokument ‚Interoperable Medical Devices‘ am 6. September 2017 veröffentlicht. Die US-Behörde möchte damit der Tatsache Rechnung tragen, dass einerseits die Interoperabilität von Medizinprodukten immer wichtiger für die Gesundheitsversorgung wird. Andererseits führen Probleme mit mangelnder Interoperabilität immer häufiger zu Risiken. Dieser Beitrag verschafft Ihnen einen schnellen Überblick über die Anforderungen der FDA…
Weiterlesen
Beim Internet der Dinge (engl. „Internet of Things“ kurz IoT) geht es um die digitale Vernetzung von physischen Objekten („things“) über das Internet (bzw. Internet-Technologien) mit dem Ziel, Prozesse zu automatisieren und zu optimieren. Von den Chancen, die das Internet der Dinge (IoT) ermöglicht, möchte auch das Gesundheitswesen bzw. die Medizin profitieren. Dabei sind dort…
Weiterlesen
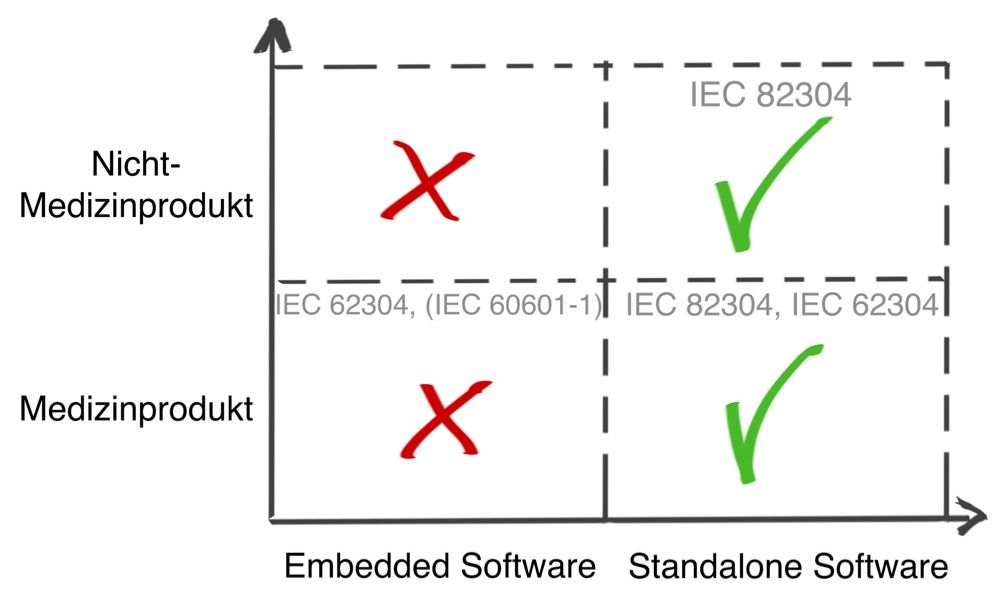
Die IEC 82304 liegt inzwischen vor. Ein guter Anlass, sich diese Norm zu „Health-Software-Products“ näher anzusehen.