Den Begriff „Design Validation“ assoziieren die meisten Medizinproduktehersteller mit der FDA. Doch nicht nur die FDA, sondern auch die europäischen Regularien, insbesondere die ISO 13485, fordern eine Validierung von Design und Entwicklung. Dabei sollten allerdings „Design Validation“ und Validierung des Designs nicht verwechselt werden.
Wie sich beide unterscheiden und welche regulatorischen Anforderungen zu beachten sind, zeigt dieser Artikel.
1. Definition des Begriffs Design Validation
Die FDA definiert den Begriff Design Validation:
„establishing by objective evidence that device specifications conform with user needs and intended use(s)“
D. h. die Design Validation ist die Überprüfung, ob die Spezifikationen, die sich aus der Entwicklung ergeben, der Zweckbestimmung und den Erfordernissen der Anwender genügen.
Leider definiert die FDA den Begriff „user needs“ nicht. Dafür liefert die ISO/IEC 25060:2014 eine Definition des Begriffs „Erfordernis“ (user need).
eine für einen Benutzer oder eine Benutzergruppe als notwendig identifizierte Voraussetzung, um ein angestrebtes Arbeitsergebnis innerhalb eines bestimmten Nutzungskontextes zu erreichen
Damit ist klar, dass die Validierung prüfen muss, ob die Nutzer mit dem Produkt die Zweckbestimmung erreichen und das Produkt die sich aus den User Needs ergebenden Stakeholder-Anforderungen wie die fachlichen Anforderungen (= Anforderungen an das Arbeitsergebnis) erfüllt.
2. Design Validation: Was regulatorisch verlangt ist
a) Forderungen der FDA
Die FDA verlangt mit Bezug zur Design Validation:
Each manufacturer shall establish and maintain procedures for validating the device design. Design validation shall be performed under defined operating conditions on initial production units, lots, or batches, or their equivalents. Design validation shall ensure that devices conform to defined user needs and intended uses and shall include testing of production units under actual or simulated use conditions. Design validation shall include software validation and risk analysis, where appropriate. The results of the design validation, including identification of the design, method(s), the date, and the individual(s) performing the validation, shall be documented in the DHF
21 CFR part 820.30 (g)
In diesem Abschnitt konkretisiert die FDA, was bei der Design Validation zu tun ist, außer definitionsgemäß und wie oben geschrieben zu prüfen, dass die Spezifikationen, die sich aus der Entwicklung ergeben, der Zweckbestimmung und den Erfordernissen der Anwender entsprechen:
- Die Hersteller müssen prüfen, ob die Medizinprodukte (und nicht nur deren Spezifikation) die Zweckbestimmung und Erfordernisse erfüllen.
- Diese Prüfung muss im definierten Nutzungskontext erfolgen.
- Für die Prüfung sind Produkte eingesetzt werden, die der Produktion entstammen bzw. solchen Produkten entsprechen.
- Die Design Validierung muss die Software Validierung und das Risikomanagement einschließen.
Fazit: Die Design Validation ist die „ganz normale“ Validierung des Medizinprodukts bzw. eines Baumusters (und nicht nur die Prüfung von Spezifikationen). Bei nicht stand-alone Software würde eine abschließende Validierung noch Produktionsaspekte berücksichtigen, die nicht Gegenstand der Design Validierung sind.
Mit der Novellierung des 21 CFR part 820 übernimmt die FDA bezüglich der Design Validation die Anforderungen der ISO 13485 Kapitel 7.3.7.
b) Forderungen der ISO 13485
Die ISO fordert im Kapitel 7.3.7 „Design and Development Validation“ (auf deutsch: Design- und Entwicklungsvalidierung“) ebenso, dass man prüfen muss, ob das resultierende Produkt die Zweckbestimmung erfüllt. Im Gegensatz zur FDA fordert die ISO 13485 die klinische Bewertung als Teil der Design Validierung. Die Norm macht darauf aufmerksam, dass
- klinische Daten ein Ergebnis der Design Validation seien,
- Hersteller diese Validierung mit einem repräsentativen Produkt,
- vor dem Release des Produkts und
- in der vorgesehenen Nutzungsumgebung (z. B. verbundenen anderen Produkten) durchführen müssen.
3. Design Validierung: Missverständnisse vermeiden
Die Entwicklung assoziiert mit dem Begriff „Design“ eines Produkts oft dessen Architektur. Jede der Entwicklungsschritte und damit auch der Entwurf der Architektur sollte überprüft werden. Diese Überprüfung wird manchmal als „Validierung“ und deshalb die Überprüfung der Architektur als mit „Design Validation“ bezeichnet. Doch diese darf nicht verwechselt werden mit der Design Validierung im Sinne der ISO 13485, sprich der Produktvalidierung.
Sowohl die IEC 62304 als auch die IEC 60601-1 klassifizieren die Überprüfung der Architektur korrekterweise als „Verifizierung“.
Bei standalone Software entspricht die Design Validation der Validierung des ganzen Produkts, da es kaum Produktionsaspekte zu beachten gilt.
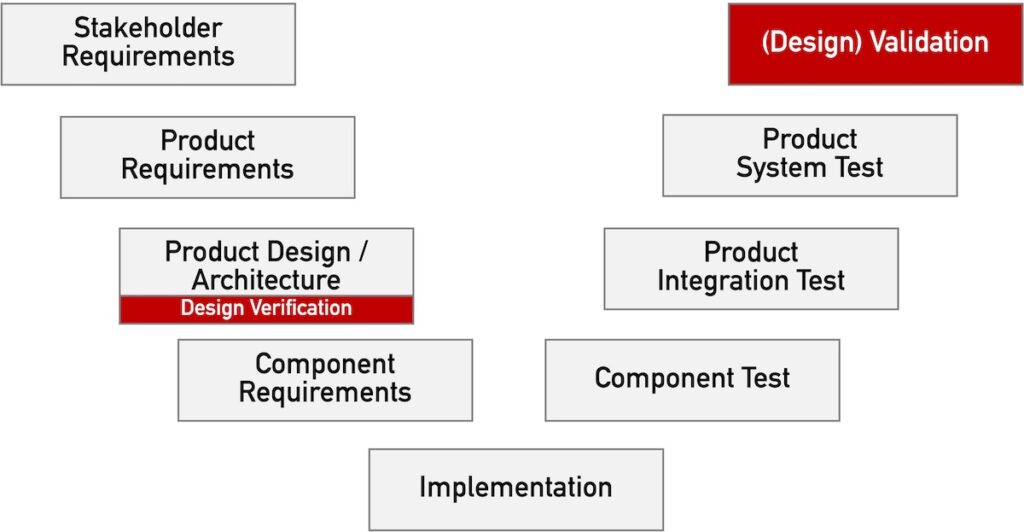
D. h. im Falle eines Software-Produkts ist die Design-Validierung nicht die „Validierung des Software-Designs“. Die Design-Validierung entspricht der Validierung der gesamten Software einschließlich der klinischen Bewertung und Usability Validierung.
Lesen Sie hier mehr zur Validierung von Medizinprodukten und hier zu der Verwirrung beim Begriff Software-Validierung.
4. Fazit und Zusammenfassung
Der Begriff „Validierung“ bzw. „Validation“ ist genauso mehrfach belegt wie der Begriff „Design“. Daher ist es nicht verwunderlich, dass Design Validation nicht immer einheitlich verstanden wird. Hätten die ISO 13485 und die FDA beide statt von Design Validation (bzw. Design-Validierung) von Product Validation gesprochen, wäre klarer gewesen, was gemeint ist. Zumindest sind sich beide regulatorischen Vorgaben einig und werden mit der Novellierung des 21 CFR part 820 sogar zusammengelegt.
Änderungshistorie
- 2024-11-04: Artikel weitgehend überarbeitet und neu strukturiert, Grafik ausgetauscht
- 2015-10-11: Erste Version des Artikel veröffentlicht



Für mich klingt das nach dem exakt selben was ich in der HF Validierung machen muss. Sehen sie einen Unterschied in der Design Validierung und der Human Factors Validierung?
Besten Dank, Herr Schmid, für die Frage!
Die HF Validierung ist Teil der Design Validierung. Die klinische Bewertung ist ein weiterer Teil (s.a. ISO 13485). Somit ist die HF Validierung eine Untermenge.
Beste Grüße, Christian Johner