Medizinproduktehersteller müssen die Schweregrade möglicher Schäden bestimmen, um die Risiken durch ihre Produkte bewerten zu können.
Was sich einfach anhört, ist in der Praxis sehr herausfordernd. Dieser Artikel gibt Hilfestellung, um die Schweregrade dieser Schäden ISO 14971-konform zu bestimmen und zu dokumentieren.
Beachten Sie den Fachartikel zu den Schäden, um den Begriff Schaden präzise verwenden und typische Fehler bei dessen Verwendung vermeiden zu können.
1. Grundlagen
a) Definition
Die ISO 14971, die Norm zum Risikomanagement bei Medizinprodukten, definiert den Begriff Schweregrad (von Schäden):
„Maß der möglichen Auswirkungen einer Gefährdung“
DIN ISO 14971:2022, Kapitel 3.27 mit Verweis auf ISO/IEC Guide 63:2019, 3.3
b) Regulatorischer Hintergrund
Hersteller müssen die Risiken identifizieren und bewerten. Für die Bewertung nutzen sie üblicherweise eine Risikoakzeptanzmatrix (s. Abb. 3).
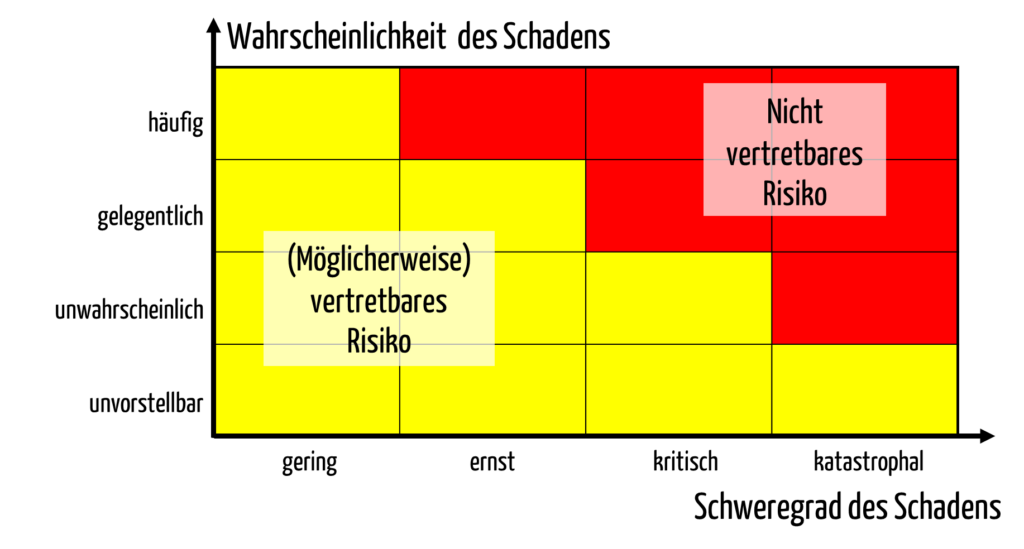
Diese Risikoakzeptanzmatrix setzt voraus, dass der Hersteller Klassen für die Wahrscheinlichkeiten und Schweregrade definiert. Das bedeutet, dass er Klassifizierungskriterien für die Schweregradklassen festlegen muss.
2. Typische Herausforderung beim Definieren von Schweregradklassen
Die Bewertung von Schweregraden erweist sich als schwierig:
- Was ist ein größerer Schaden für einen Patienten: wenn sich sein Knie durch das Versagen eines Medizinprodukts dauerhaft versteift, oder wenn er sich kurzfristig in einer lebensbedrohlichen Situation befand, die dank des Intensivmediziners ohne Folgeschäden gelöst wurde?
- Sind zwei Monate Lebenszeit, die man einem Todkranken nimmt, der nur noch ein halbes Jahr zu leben hat, anders zu bewerten als zwei Monate fehlende Lebenszeit für einen Menschen, der noch 10 Jahre zu leben hat?
3. Bestehende Lösungsansätze
a) Definition der MPAIMV
Die MPAIMV definiert in § 2 den Begriff des ’schwerwiegenden Vorkommnisses‘ als ein Vorkommnis mit den folgenden potenziellen Folgen:
- 1. den Tod eines Patienten, Anwenders oder einer anderen Person,
- 2. die vorübergehende oder dauerhafte schwerwiegende Verschlechterung des Gesundheitszustands eines Patienten, Anwenders oder einer anderen Person oder
- 3. eine schwerwiegende Gefahr für die öffentliche Gesundheit.
Doch die dazu verwendeten Begriffe wie „schwerwiegend“ definiert die Verordnung nicht.
b) Definition der MEDDEV
Die MEDDEV-2.12. enthält eine Definition des Begriffs „schwerer Schaden“:

Doch auch diese Definition nutzt nicht definierte Begriffe und erlaubt nur die Abgrenzung von schweren und nicht schweren Schäden.
c) NACA-Score
Eine Klassifizierung zur Einteilung (kurzfristiger) Schäden finden Sie bei Wikipedia (NACA Score). Diese Einteilung stammt vom National Advisory Committee for Aeronautics und wurde ursprünglich entwickelt für die Klassifizierung von Unfällen in der Luftfahrt.
Das Problem dieses Scores besteht darin, dass nur die „Amplitude“ des Schadens Berücksichtigung findet, nicht aber dessen zeitlicher Verlauf.
d) Tabellen der Versorgungsmedizin-Verordnung
Zur Einteilung langfristiger Schäden (d. h. Behinderungen) sind die Tabellen der Versorgungsmedizin-Verordnung – VersMedV hilfreich. Beispielsweise enthält diese Tabelle folgende Einträge:
| Erkrankung | Behinderungsgrad |
| Hirnschäden mit kognitiven Leistungsstörungen (z. B. Aphasie, Apraxie, Agnosie) – leicht (z. B. Restaphasie) 30–40 – mittelgradig (z. B. Aphasie mit deutlicher bis ausgeprägter Kommunikationsstörung) – schwer (z. B. globale Aphasie) | 30–40 % 50–80 % 90–100 % |
| Linsenverlust eines Auges: Sehschärfe 0,1 bis weniger als 0,4 | 20 % |
| Atemnot bereits bei leichtester Belastung oder in Ruhe; statische und dynamische Messwerte der Lungenfunktionsprüfung um mehr als 2/3 niedriger als die Sollwerte | 80–100 % |
| Verlust eines Daumens | 25 % |
Wenn Sie an weiteren Werten interessiert sind, werfen Sie einen Blick in die o. g. VersMedV oder googeln Sie die Begriffe Grad der Behinderung (GdB) und Grad der Schädigungsfolgen (GdS).
Dieser Beitrag zur International Classification of Functioning, Disability and Health (ICF) gibt ebenfalls Anregungen zur Klassifizierung von Schweregraden von Schäden.
e) Zwischenfazit
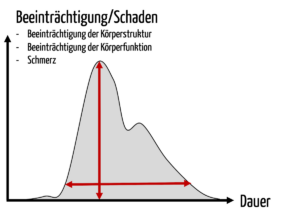
Viele Scores betrachten nur den Schweregrad von akuten Schäden. Ein nicht lebensbedrohlicher und gleichzeitig nicht reversibler Schaden wie eine dauerhafte Behinderung lässt sich in dieses Schema nicht gut einordnen.
Es hilft auch nicht bei der ethischen Diskussion darüber, ob man bei Schäden
- den maximalen kurzfristigen Effekt („die Höhe der Schadenskurve“) oder
- die zeitliche Dauer des Effekts oder
- das „Integral“ dieser Kurve nutzen soll.
4. Neuer Ansatz zur Quantifizierung der Schweregrade von Schäden
Schritt 1: Relevante Klassifizierungsmerkmale bestimmen
Um Schweregrade von Schäden zu klassifizieren, benötigen Hersteller Klassifizierungsmerkmale.
- Tod (j/n)
- Hospitalisierungsdauer > n Tage (j/n)
- Grad der Behinderung > x % (j/n)
- Intensivmedizinische Behandlung (eines Nicht-Intensivpatienten) notwendig (j/n)
- Ärztliche Intervention notwendig (j/n)
- Reversibel (j/n)
- Verkürzung der Lebenserwartung > n Monate (j/n)
- Verkürzung der Lebenserwartung > x % verglichen mit der Lebenserwartung bei „richtiger Behandlung“ (j/n)
- Schmerz-Level > X (j/n)
- Lebensqualität, psychische Belastung gemäß „Quality of Life“-Kriterien
Schritt 2: Diese Kriterien zur Definition von Schweregradklassen nutzen
Im zweiten Schritt können die Hersteller die ausgewählten Klassifizierungsmerkmale nutzen, um die Schweregradklassen zu definieren.
Beispiele für die Definition von Schweregradklassen
| Schweregradklasse | Klassifizierungsmerkmale |
| Katastrophal | Tod von einem oder mehreren Patienten |
| Kritisch | Intensivmedizinische Behandlung notwendig oder/und nicht reversibler Schaden mit mindestens n % Behinderung. |
| … |
Schritt 3: Beispiele ergänzen
Ergänzen Sie als Hersteller die Definition der Schwergradklassen durch konkrete Beispiele für Ihr Medizinprodukt. Dann wird es bei der Risikoanalyse (konform mit ISO 14971) einfacher fallen, abzuschätzen, wie hoch der Schweregrad von Schäden sein kann, die durch Ihr Produkt verursacht werden.
Schritt 4: Eigene Definitionen prüfen
- Nutzen Sie die o. g. Tipps zum Definieren von Schweregraden. Es reicht nicht aus, nur Attribute wie „leicht“, „ernst“, „schwer“ und „katastrophal“ zu nennen, aber nicht schriftlich zu definieren, was ein „schwerer“ Schaden ist.
- Verwechseln Sie Schweregrade von Schäden nicht mit Wahrscheinlichkeiten. Daher sind Schweregradklassen wie „Potenziell tödlich“ oder „Birgt Gefahr einer lebensbedrohlichen Verletzung“ falsch. Die Wahrscheinlichkeitsachse ist davon unabhängig, zumal bereits Risiken als die Kombination aus Wahrscheinlichkeit und Schweregrad definiert sind.
- Vermeiden Sie ethisch diskussionsbedürftige Reihenfolgen beim Schweregrad von Schäden: Sind zwei Verletzte schlimmer als ein Toter?
- Achten Sie darauf, dass Sie die Schweregrade von Schäden vollständig definieren; also z. B. auch mehrere „schwere irreversible Verletzungen“ oder „für mehrere Personen“.
Das Risikomanagement-Team des Johner Instituts hilft Ihnen beim Erstellen und Prüfen Ihrer Risikomanagementakten, damit Sie Audits und Zulassungen problemlos und sicher bestehen. Zu diesen Akten zählen auch die Risikopolitik und der Risikomanagementplan, welche die Risikoakzeptanzkriterien und damit die Definition der Schweregradklassen enthalten sollten.
Das Seminar „Risikomanagement & ISO 14971“ verschafft Ihnen einen schnellen Einstieg. Dort lernen Sie u. a., wie Sie Risikoakzeptanzkriterien festlegen.
5. Fazit und Zusammenfassung
a) Die Festlegung der Schweregradklassen von Schäden ist die Basis
Eine der wichtigsten gesetzlichen Forderungen ist die nach dem Risikomanagement. Ein gesetzeskonformes Risikomanagement bedarf präziser Risikoakzeptanzkriterien. Und diese wiederum setzen eine präzise Definition der Schweregrade voraus.
b) Klassifizierungskriterien ermöglichen die Reproduzierbarkeit
Hersteller müssen Schäden reproduzierbar – d. h. über viele Personen und lange Zeiträume hinweg – den Schweregradklassen zuweisen können. Andernfalls steht das ganze Risikomanagement und damit der Erfolg von Audits und Zulassungen auf tönernen Füßen.
Die Definition von Schweregradklassen anhand klarer, am besten binärer Klassifizierungsmerkmale ermöglicht diese Reproduzierbarkeit.
c) Die Kompetenz des Risikomanagement-Teams ist entscheidend
Ohne ein kompetentes Risikomanagement-Team wird die Definition von Schaden und Schweregraden sowie die Einteilung von Schäden in die Schweregradklassen nicht gelingen. Denn die Herausforderungen sind groß:
- Welchen Schaden in der Schadenskette soll in die Risikotabelle eingetragen werden?
Diese Entscheidung wirkt sich auch auf die zugehörigen Wahrscheinlichkeiten der ausgewählten Schäden aus. - Wie ist der Schweregrad dieses Schadens bezüglich der Attribute zu bewerten und damit zu klassifizieren?
- Wie geht man mit den oben angesprochenen ethischen Bewertungen um?
Ihr Risikomanagement-Team sollte neben den Risikomanagern auch Ärztinnen und Ärzte sowie Kontextexperten wie medizinisches Fachpersonal umfassen.
Das Johner Institut bildet Risikomanagement-Teams aus und hilft, ISO 14971-konforme Risikomanagementakten zu erstellen.
Änderungshistorie
- 2024-10-01: Kapitel 1 (Schäden) inklusive Tabelle 3 in den Artikel zu den Schäden verschoben. Verbleibende Überschriften und Beschriftungen neu nummeriert
- 2024-09-17: Kapitel 1.c) neu strukturiert und erweitert. Tabelle 3 eingefügt. Redaktionelle Änderungen in Kapitel 3.
- 2023-04-27: Artikel neu geschrieben
- 2017-11: Erste Version erstellt

Mit dem NACA Score wird eine Schweregradskala präsentiert, die sich vor allem für unfallbedingte Verletzungen eignet. CTCAE hingegen ist eine auf Erkrankungen und chronische Zustände ausgerichtete 5-stufige Skala. Sie wurde vom (US) National Cancer Institut urspünglich zur Klassifizierung von Nebenwirkungen von Krebsmedikamenten geschaffen, enthält aber inzwischen viele andere Zustände, die ursächlich auch von Medizinprodukten (Material, Energieeinwirkung) herrühren können. Siehe https://evs.nci.nih.gov/ftp1/CTCAE/ für die aktuellen Downloads.
Danke für Ihre Ergänzung!
Guten Tag Herr Prof. Johner,
Zunächst einmal vielen Dank für die vielen wirklich guten Artikel!
Nun zu meiner Frage:
Es gibt in der DIN EN ISO 14971 zwar eine Schadensdefinition aber keine für Gesundheit und damit treten plötzlich sowohl in der DIN EN ISO 14971 als auch in der ISO/TR24971 Ungereimtheiten/Probleme auf.
Um dies zu umreissen würde ich zunächst in Anlehnung an die WHO folgende verkürzte Definition für den Medizinproduktebereich nutzen: „Das Fehlen von Krankheit oder Gebrechen.“
Schaden wird in 3.3 der 14971 Norm definiert als: Verletzung oder Schädigung der Gesundheit von Menschen oder Schädigung von Gütern oder der Umwelt
Tabelle C3 der Norm sagt nun z.B. das Fortschreiten einer Krankheit sei ein Schaden, dass kann aber nicht sein, denn die Schädigung/Verletzung ist schon eingetreten im Beginn der Krankheit. Ich verstehe den Hintergrund aber die Norm ist hier sprachlich einfach falsch.
In der ISO/TR 24971 wird es dann noch haarsträubender:
Hier werden auch Nichtschäden als Schaden definiert um die Schweregrade zu definieren.
In Tabelle 2 wird der Nichtschaden und die leichte Schädigung zusammen in die niedrigste Schweregradkategorie gepackt.
Ein Nichtschaden muss aber garnicht genannt werden, da er kein Schaden im Sinne der ist Definition ist und somit kein Risiko inne haben kann. Ergo muss er nicht im Risikomanagement aufgezeigt werden, hier geht es ja um die Beherrschung von Risiken.
Noch absurder wird es in Tabelle 4 der ISO/TR 24971. Hier plötzlich sind auch Unannehmlichkeiten und Unwohlsein ein Schaden, wenn auch ein vernachlässigbarer.
Aber z.B. wäre damit folgende Situation ein Schaden:
Ein Produkt braucht zum Erzielen des Ergebnisses eine gewisse Zeit. Wenn es dem Patienten aber nicht schnell genug geht, verursacht das Produkt eine Unannehmlichkeit, welche dann ein Schaden wäre.
Mit freundlichen Grüßen
Dr. Andreas Breß
Sehr geehrter Herr Dr. Breß,
danke für Ihre Anmerkungen. Ich bin nicht ganz sicher, ob Sie eine Antwort erwarten. In der Vermutung, dass dem so ist, hier ein paar Gedanken:
Mangelnde Präzision im Denken und Schreiben sowie fehlende Modelle und Konzepte rächen sich gerade im Bereich des Risikomangements. Genau darauf haben Sie hingewiesen. Vielen Dank dafür!
Viele Grüße
Christian Johner
Sehr geehrter Herr Prof. Johner,
vielen Dank für diese Antwort, ja genau ich hatte auf eine Antwort gehofft.
Zwei Dinge möchte ich aber noch erwähnen:
1. Problem ist der eher der Begriff der Gesundheit. Dieser wird nicht in der Norm definiert also müssen wir z.B. auf die Definition der WHO zurückgreifen. Die WHO ist hier konkreter und besagt: „„Health is a state of complete physical, mental and social well-being and not merely the absence of disease or infirmity.“ Die Definition des Schadens, wie sie in der Norm auftaucht, wäre meine Meinung nach damit viel zu weit gefasst, wenn die Norm die WHO-Definition von Gesundheit nutzt. Es bräuchte also eine eigene Definition von Gesundheit.
2. Bezüglich der Nicht-Schäden zu Schäden haben Sie natürlich Recht, was die Intention der Normen-Autoren betrifft. Allerdings wurde hier, wie Sie ebenfalls erwähnt haben, nicht sauber genug gerabeitet. Sie haben ebenfalls bewusst die Position des Unwohlseins als Schaden reingenommen aber den Begriff Unannehmlichkeiten ausgeklammert, was ich genauso gemacht hätte.
Ich sehe allerdings mit größter Sorge auf die Machbarkeit der Erfüllung der Normen für MP-Hersteller, wenn selbst die Normen-Autoren nicht genau genug arbeiten.
Vielen Dank für diesen Austausch.
Mit freundlichen Grüßen,
Dr. Andreas Breß
Guten Tag Herr Prof. Johner,
warum ist es denn so „absurd“, wie es im bisherigen Verlauf des Diskussion genannt wird, die „Customer dissatisfaction“ mit aufzunehmen?
Gerade heute mit der neuen Rechtslage, die das Funktionieren der Produkte zwecks Sicherstellung der Therapie und nicht das bloße Vermeiden von Gefahren in den Mittelpunkt rückt, ist es doch hilfreich, die Kundenunzufriedenheit (z.B. durch erkannte Leckagen vor Eintreten des klinisch messbaren Patienten-Schadens) messen zu können?
Welche andere Disziplin außer dem Risikomanagement untersucht denn strukturiert alle Funktionen, die zum Intended Use beitragen?
Und nur durch diese strukturierten Analysen lassen sich doch potentielle Fehler identifizieren und beheben?
Ob diese „Customer dissatisfaction“ nun als „S0“ oder als „S1“ eingestuft wird, ist dann doch eher Geschmackssache, ändert aber nichts am Vorgehen?
Mit freundlichen Grüßen,
Jörg Bigalke
Lieber Jörg,
Kundenzufriedenheit ist nicht direkt ein Aspekt der ISO 14971, eher ein Aspekt der ISO 9001.
Die ISO 14971 zielt auf Schäden am Menschen ab, die durch Einschränkungen bei Sicherheit oder Leistungsfähigkeit von Medizinprodukten entstehen.
Es gibt dabei Fälle, wo sowohl die Leistungsfähigkeit des Produktes, als auch gleichzeitig die Kundenzufriedenheit betroffen sind: Eine Dialysemaschine, die bei Behandlungsstart ausfällt, ist zum einen ein Ärgernis für den Anwender, aber gleichzeitig möglicherweise eine Gefährdung für den Patienten, der dringend eine Entgiftungsbehandlung benötigt und damit durch den Ausfall des Medizinproduktes geschädigt werden kann.
Ich würde empfehlen, die Risikotabelle nach ISO 14971 sauber auf Sicherheit und Leistungsfähigkeit der Produkte einzugrenzen.
Die einzelnen FMEA-Methoden (P-FMEA, D-FMEA, SW-FMEA, etc.), die oft Input in die Risikobetrachtung nach ISO 14971 liefern, können ruhig auch reine Qualitätsthemen und Themen rund um Kundenzufriedenheit abdecken.
Wie man dann in der Post Market Surveillance damit umgeht, ist wieder eine andere Sache. Rein regulatorisch ist zunächst gemäß ISO 14971 gefordert, die Defizite der Produkte hinsichtlich Sicherheit und Leistungsfähigkeit zu erkennen und zu dokumentieren. Reine Kundenzufriedenheit („Die Gehäusefarbe finde ich schrecklich“) ist natürlich unternehmerisch zusätzlich relevant. Aber auch hier gibt es untrennbare Mischformen: Wenn sich die Anwender beschweren, weil das Produkt wiederholt wegen Fehlermeldungen nicht angewendet werden kann, dann ist sowohl die Kundenzufriedenheit verletzt, als auch der Patient in Gefahr, falls kein Ersatzgerät zur Verfügung steht. Auch hier würde ich beide Aspekte sorgfältig trennen. Nimmt man die Kundenzufriedenheit als S0- oder S1-Schaden mit in die Risikobetrachtung auf, käme man eventuell über Artikel 88 (Trendanalyse) der MDR in die Verpflichtung, bei reiner Kundenunzufriedenheit eine Meldung an Behörden absetzen zu müssen.
Du hast das Beispiel „Erkannte Leckagen vor Eintreten des klinisch messbaren Patienten-Schadens“ genannt. Das führt zwar zu Kundenunzufriedenheit und als solche würde man dem unter unternehmerischen Gesichtspunkten nachgehen wollen. Muss es aber regulatorisch nicht zwingend. Regulatorisch relevant im Sinne von Sicherheit und Leistungsfähigkeit wird es, wenn die Leckage dazu führt, dass jemand ausrutschen könnte, oder dass der Flüssigkeitsentzug am Patienten zu hoch wird, oder dass unerkannt die Entgiftungsleistung der Dialysemaschine nicht mehr ausreichend gegeben ist. Und das würde man sehr sorgfältig in der Risikobetrachtung und Ursachenanalyse zur Meldung aus dem Markt berücksichtigen und dokumentieren.
Herzliche Grüße
Christian Rosenzweig
Hallo Herr Johner,
Produkte die nun auf dem Markt kommen unterliegen der IVDR (EU) 2017/746
heißt das auch, dass die Risikoanalyse 14971:2019 angewendet werden muss?
Eine Risikoanalyse nach 14971:2012 wäre also ungültig für dieses Produkt , dh. würde es den normativen Forderungen nicht erfüllen?
(Es geht um ein (jetzt) Klasse A ( nicht steril ) Produkt.)
Dora
Liebe Dora,
rein formal ist die derzeit harmonisierte Norm unter der IVDR die „EN ISO 14971:2019/A11:2021“. Wenn Sie noch immer die Version aus 2012 verwenden, soll(t)en Sie eine schriftliche Betrachtung der Unterschiede beider Normen durchführen und Konsequenzen ableiten. Oder Sie gehen eben gleich auf die neue Version. Aber keine Sorge, die Unterschiede zwischen den beiden Versionen sind minimal und eher formaler Natur. Wenn Sie Hilfe dabei benötigen, kommen Sie auf unser Berater-Team zu. Wir prüfen gerne Ihre derzeitige Akte auf Konformität.
Herzliche Grüße
Christian Rosenzweig