In einer Verfahrensanweisung (VA), auch Standard Operating Procedure (SOP) oder Prozessbeschreibung genannt, legen Firmen ihre Abläufe fest, beispielsweise wie sie Produkte entwickeln oder Dienstleistungen erbringen.
Die Normen wie die ISO 9001 und die ISO 13485 fordern solche Verfahrensanweisungen. Diese Vorgaben können Firmen direkt im Qualitätsmanagementhandbuch oder in eigenständigen Dokumenten festlegen.
Mit kostenlosem Download eines Musters für eine Verfahrensanweisung im Abschnitt 3. b) dieses Artikels.
1. Verfahrensanweisungen: Einführung, Definitionen
a) Definition
Die ISO 9000 definiert ein Verfahren wie folgt:
„festgelegte Art und Weise, eine Tätigkeit oder einen Prozess auszuführen“
Quelle: ISO 9000:2015 3.4.5
Ein Prozess wird in der ISO 9000 folgendermaßen definiert:
„Satz zusammenhängender oder sich gegenseitig beeinflussender Tätigkeiten, der Eingaben zum Erzielen eines vorgesehenen Ergebnisses verwendet“
Quelle: ISO 9000:2015 3.4.1
Eine Verfahrensanweisung dokumentiert somit, wie eine Firma (z. B. ein Hersteller) eine einzelne Tätigkeit oder einen Prozess (Satz von Tätigkeiten) ausführen will. Die Begriffe Verfahrensanweisung und Verfahrensbeschreibung sind synonym zu verstehen.
Im Englischen spricht man von einer Standard Operating Procedure (SOP).
b) Unterschied von Prozessanweisungen und Verfahrensanweisung
Geht man von den obigen Definitionen aus, ist eine Verfahrensanweisung bei der Beschreibung mehrerer zusammenhängender oder einander beeinflussender Tätigkeiten gleichzusetzen mit einer Prozessbeschreibung.
Eine Prozessbeschreibung umfasst den ganzen Prozesse, z. B. den Software-Entwicklungsprozess. Sie legt Phasen, Rollen und Aktivitäten fest. Beispielsweise fordert sie einen Software-Systemtest am Ende der Entwicklung. Wie, d. h. mit welcher Tätigkeit, diese Tests (z. B. mit Äquivalenzklassen) durchgeführt werden, kann Teil einer referenzierten Arbeits- oder Verfahrensanweisung sein.
c) Unterschiede von Arbeitsanweisungen und Verfahrensanweisungen
Arbeits- und Verfahrensanweisungen unterscheiden sich bezüglich mehrerer Aspekte:
| Aspekt | Verfahrensanweisung | Arbeitsanweisung |
| Betroffene Rollen | Meist mehrere | Meist eine |
| Granularität | Viele Arbeitsschritte. Für den einzelnen Arbeitsschritt verweist die Verfahrensanweisung auf die Arbeitsanweisung. Sie erwähnen die zu verwendenden Werkzeuge, ohne deren Bedienung zu beschreiben. | Feingranulare Beschreibung eines Arbeitsschritts inklusive genauer Anleitung, wie Werkzeuge zu benutzen sind |
| Dauer der Tätigkeit | Das Verfahren kann oft nicht in einem Schritt und ohne Unterbrechung abgeschlossen werden. | Eine Arbeitsanweisung beschreibt eine Tätigkeit, die man i. d. R. ohne Unterbrechung und Abhängigkeiten abschließen kann. |
| Verantwortlichkeit | Prozesseigner | Personen, welche die Tätigkeiten durchführen |
| Schulung und Nutzung | Verfahrensanweisungen werden geschult. Sie dienen als Referenz, um Abläufe zu verstehen. | Arbeitsanweisungen liegen am Ort der Tätigkeit vor. |
Beispiel 1: Software-Entwicklung
Die Verfahrensanweisung „Software-Entwicklung“ beschreibt die Aktivitäten, deren Reihenfolge und Abhängigkeiten und die jeweils verantwortlichen Rollen. Eine dieser Tätigkeiten besteht darin, die Software-Architektur zu erstellen.
Die Arbeitsanweisung beschreibt, wie man Software-Architekturen mithilfe eines Werkzeugs wie Enterprise Architect modelliert, wie man das Werkzeug nutzt und welche Best Practices beim Modellieren beachtet werden sollen.
Beispiel 2: Post-Market Surveillance
Die Verfahrensanweisung „Post-Market Surveillance“ verschafft einen Überblick über die Aktivitäten bei der „Überwachung nach der Inverkehrbringung“.
Die zugehörige Arbeitsanweisung beschreibt, wie man in der Sicherheitsdatenbank des BfArM sucht und wie man die Suchergebnisse dokumentiert und bewertet.
d) Unterschiede von Verfahrensanweisungen und Plänen
Die Entwicklung von Produkten muss Verfahrensanweisungen und Plänen folgen. Das sind regulatorische Anforderungen.
Die Verfahrensanweisungen (z.B. SOP Entwicklung) unterscheiden sich von den Plänen (Entwicklungsplänen) dadurch, dass die Verfahrensanweisungen allgemein gelten, wohingegen die Entwicklungspläne produktspezifisch erstellt werden.
Sie finden hier nicht nur eine genauere Abgrenzung von Verfahrensanweisungen für die Entwicklung und Entwicklungsplänen, sondern auch Tipps, wie Sie die Inhalte auf beide Dokumente aufteilen, um den Dokumentationsaufwand zu minimieren.
2. Was eine Verfahrensanweisung beinhalten sollte
a) Inhalt
Die Verfahrensanweisung muss beschreiben,
- welche Rolle(n),
- welche Tätigkeiten
- auf welche Art (Methode),
- mit welchen Hilfsmitteln und Werkzeugen,
- in welcher Reihenfolge (z. B. sequenziell, parallel) durchführt und dabei
- welche Inputs,
- in welche Outputs überführt.
Ist die Beschreibung der Methode zu einer Tätigkeit umfangreicher, empfiehlt es sich, diese in eine Arbeitsanweisung auszulagern.
Im Gegensatz zu einer Arbeitsanweisung beschreibt eine Verfahrensanweisung meist eine geforderte Abfolge von Tätigkeiten, die oft durch mehrere Personen geleistet werden.
b) Metainformationen
Eine gute Verfahrensanweisung sollte Folgendes auf der Metaebene beschreiben bzw. beinhalten:
- Eindeutige Identifikation der Verfahrensanweisung, z. B. Dokumenten-ID und Titel
- Version
- Autor(en)
- Verantwortlichkeiten
- Geltungsbereich
- Ziel
- Änderungshistorie
3. Inhalt von Verfahrensanweisungen
a) Kapitelstruktur
Die Beraterinnen und Auditoren des Johner Instituts nutzen meist folgende Kapitelstruktur
- Metainformationen
- Zweck
- Anwendungsbereich
- Verantwortlichkeiten
- Adressaten
- Verteiler
- Prozesseigner
- Schulung
- Kennzahlen
- Allgemeines (optional)
- Prozessbeschreibung
- Übersicht (z. B. Ablaufdiagramme)
- Schritt 1
- Input
- Beschreibung der Tätigkeit
- Output
- Schritte 2 bis n (analog)
- Anhang
- Referenzierte Dokumente
- Versionshistorie
Nutzen Sie Ablaufdiagramme. Damit ermöglichen Sie einen schnellen Überblick.
b) Beispiel/Muster/Template für eine Verfahrensanweisung
Das folgende Muster zeigt exemplarisch die Struktur einer Verfahrensanweisung. Sie können das Template direkt kostenfrei heruntergeladen werden (Word-Format) und für eigene Projekte verwendet werden.
c) Beschreibung der Abläufe
Grafische Beschreibung
Verschiedene Modellierungssprachen wie UML-Aktivitätsdiagramme, BPMN und klassische Flussdiagramm bieten sich an. Es stehen zahlreiche Werkzeuge zur Verfügung, darunter auch kostenfreie (z. B. draw.io).
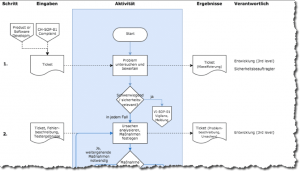
Tabellarische Beschreibung
Eine alternative Darstellung sind Tabellen. Diese eignen sich bei sequenziellen Abläufen.
| Schritt | Input | Tätigkeit | Output | Rolle | Kommentar |
| 1 | Use Scenarios Stakehholder-Anforderungen | Spezifikation der SW-Anforderungen | Software-Requirements-Specification. | User Interface Designer |
4. Liste der Verfahrensanweisungen
a) Überblick über die regulatorischen Anforderungen
Die Anforderungen, welche Verfahrensanweisungen Hersteller festlegen und befolgen müssen, finden sich u. a. in diesen Regularien:
- ISO 13485
- Medizinprodukteverordnung MDR
- FDA 21 CFR part 820 (welcher wieder auf die ISO 13485 verweist)
b) ISO 13485
Die Normen wie die ISO 13485 fordern, dass die Firmen Verfahren wie die Dokumentenlenkung, die Design- und Entwicklungsplanung, die Beschaffung, die Korrekturmaßnahmen etc. festlegen.
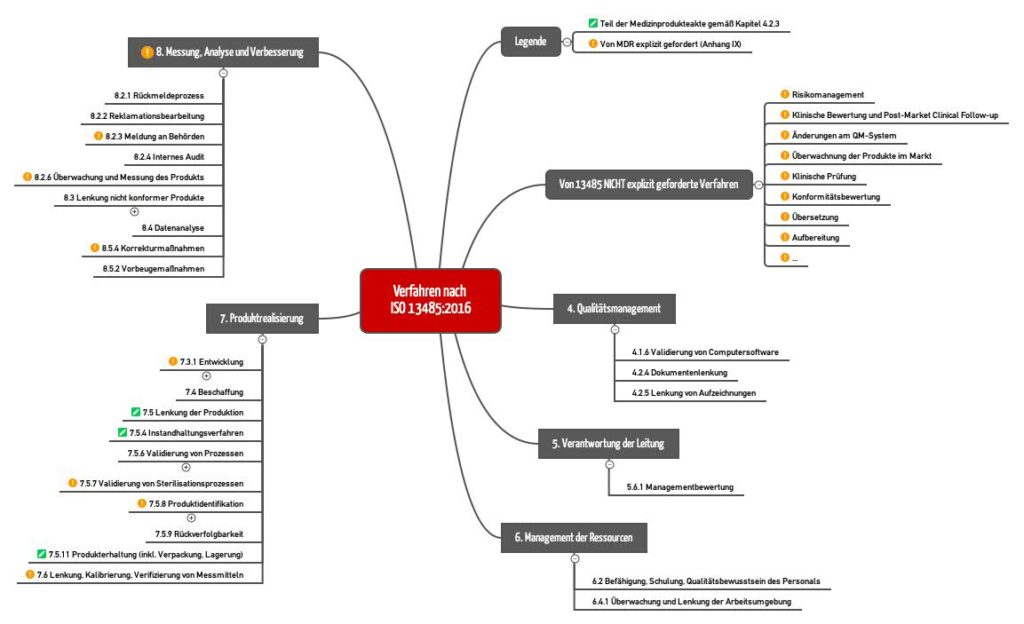
Die ISO 13485:2016 hat die Liste notwendiger Verfahrensanweisungen zu ihrer Vorgängerversion angepasst. Die Mindmap in Abb. 2 enthält eine genaue Betrachtung der geforderten Verfahren.
Hier eine etwas weniger granulare Liste der vorgeschriebenen Verfahren (auf Englisch):
- Validation of the application of computer software used in the quality management system
- Control of documents
- Control of records
- Management review
- Design and development including transfer of design and development and control design and development changes
- Purchasing
- Procedures and methods for the control of production
- Servicing (if applicable)
- Validation of processes for production and service provision including validation of the application of computer software
- Validation of sterilization and sterile barrier systems (if applicable)
- Product identification
- Traceability.
- Preserving the conformity of product
- Control of monitoring and measuring equipment including validation of the application of computer software
- Feedback
- Complaint handling
- Reporting to regulatory authorities
- Internal Audits
- Monitoring and measurement of product
- Control of Non-Conforming Products
- Analysis of data
- Corrective Actions
- Preventive Actions
Genau genommen fordern Normen wie z. B. die ISO 13485, dass die Hersteller all die oben genannten Verfahren
- festlegen,
- dokumentieren (schriftlich! Genau das ist dann die Verfahrensanweisung),
- umsetzen,
- schulen und
- aufrechterhalten.
Beachten Sie, dass die ISO 13485 viele weitere Aktivitäten fordert, die aber nicht notwendigerweise durch eine Verfahrensanweisung beschrieben sein müssen.
c) MDR und IVDR versus ISO 13485
Die MDR bzw. IVDR fordert einerseits weniger Verfahrensanweisungen als die ISO 13485. Zumindest nicht explizit. Andererseits gibt es Verfahren, die die Hersteller laut MDR festlegen müssen, die die ISO 13485 nicht so explizit nennt, etwa das Risikomanagement.
Dabei ist zu beachten, dass die ISO 13485 das Risikomanagement sehr wohl als Aktivität fordert.
Fazit: Wenn Sie konform der jeweils aktuellen Ausgabe der ISO 13485 handeln, erfüllen Sie im Wesentlichen die Anforderungen an das Qualitätsmanagement, die die MDR und IVDR z. B. im Artikel 10 und im Anhang IX fordern.
5. Weiteres
a) Verfahrensanweisungen als Teil des QM-Handbuchs?
Es gibt Argumente dafür, die Verfahrensanweisungen direkt ins QM-Handbuch zu integrieren, und es gibt Argumente dagegen. Zu diesen Argumenten gegen eine Integration von Verfahrensanweisung und QM-Handbuch zählen:
- Trennung von vertraulichen und nicht vertraulichen Inhalten
Manche Hersteller möchten ihr QM-Handbuch stolz nach außen präsentieren. Wenn dieses Handbuch firmeninternes Know-how enthält, ist das nicht möglich. Bei getrennten Verfahrensanweisungen tritt das Problem nicht auf. - Austauschbarkeit von Verfahrensanweisungen
Besonders Entwicklungsdienstleister sind häufig gezwungen, nach Vorgaben ihrer Kunden zu entwickeln. Das ist einfacher möglich, wenn sie statt der eigenen Verfahrensanweisung die des Kunden nutzen. Das QM-Handbuch bleibt davon unberührt. - Schnellere Freigabe
Änderungen an Verfahrensanweisungen sind einfacher möglich, weil nicht bei jeder Änderung eine erneute und gerade bei großen Firmen aufwändige Freigabe des QM-Handbuchs notwendig wird. Komponenten-Trennung ergibt auch in der Dokumentenlandschaft manchmal Sinn.
QM-Handbuch und SOPs zu trennen, ist aber nicht immer die beste Lösung. Kleine Firmen mit nur einem oder wenigen Produkten kommen mit einem integrierten Dokumentensatz manchmal schneller klar.
Sind Sie unsicher, welche Variante für Sie die bessere ist? Dann nehmen Sie Kontakt mit uns auf. Wir helfen gerne.
b) Abkürzungen in der Verfahrensanweisung
Gängige Abkürzung werden in der Verfahrensanweisung häufig genutzt, um das Dokument übersichtlicher zu gestalten. Alle verwendeten Abkürzungen sollen in einem Dokument separat vermerkt werden. Beispiele:
- GF: Geschäftsführung
- UB: Umweltbeauftragter
- UM: Umweltmanagement
- VA: Verfahrensanweisung
- AA: Arbeitsanweisung
- QM: Qualitätsmanagement
Änderungshistorie
- 2025-04-16: Kapitel 1.b) mit Beispielen ergänzt; Kapitel 1.c) neu eingefügt; Kapitel 3.b) mit Download eingefügt und deshalb folgende Nummerierung geändert; Hinweis auf Download am Artikelbeginn ergänzt
- 2023-08-16: Zwischenüberschriften im Kapitel 2 eingefügt
- 2023-05-31: Redaktionelle Änderungen





Vielleicht an dieser Stelle einmal der Hinweis, dass es im Sinne „Stand der Technik“ im Engineeringumfeld eine wenig bekannte, aber mit ISO/IEC/IEEE 15288/15289, 12207 und auch ISO 9000 harmonisierte Norm zum Thema „Erstellung und Inhalte von Prozessbeschreibungen“ gibt:
IEEE Std 24774-2012; ISO/IEC TR 24774 Ed. 2.0 2010-09 Systems and Software Engineering – Life cycle management – Guidelines for process description
welche über das ITTF-Programm sogar frei zugänglich ist:
„The electronic version of this International Standard can be downloaded from the ISO/IEC Information Technology Task Force (ITTF) web site“
http://standards.iso.org/ittf/PubliclyAvailableStandards/index.html
Gibt es einen schriftlichen Beleg für die Forderung nach einem QM-System für Klasse 1 Produkte (ohne r, s und m) mit der MDR?
Sehr geehrte Frau Schumacher,
Die Forderung nach einem QM-System finden Sie in der MDR in Artikel 10 (9).
Danach fragten Sie, oder?
Beste Grüße, Christian Johner
Ja, genau! Vielen Dank.
Ich hoffe, ich bin mit meinem Anliegen hier richtig.
Inwieweit ist es möglich, Zugangsdaten (Login+Passwort), die als Teil bei der Durchführung eines Prozesses dringend benötigt werden, mit in eine entsprechende Verfahrensanweisung einzubinden?
Ist das zulässig?
Und wenn nicht, wie ist mit derartigen „Daten“ stattdessen umzugehen, wenn sie nicht irgendwo dokumentiert sein dürfen?
Mit freundlichen Grüßen
Sehr geehrte Frau Slomka,
vertrauliche Daten gehören nie in eine Verfahrensanweisung (VA) — auch deshalb, weil sie die VA nicht ändern wollen, wenn sich die Zugangsdaten ändern.
Sauber wäre es, wenn Sie die Zugangsdaten auf einem dritten Kanal übermitteln und den Empfänger zwingt, sein Passwort nach der ersten Anmeldung zu ändern.
Beste Grüße, Christian Johner
Sehr geehrter Herr Professor Johner,
zunächst vielen Dank für die rasche und hilfreiche Antwort.
Das Problem in unserem Fall (wir sind ein vergleichsweise kleiner Betrieb) ist, dass die für den durch die VA beschriebenen Prozess benötigten „vertraulichen Daten“ eigentlich statisch sein sollen.
Um genau zu sein: Es handelt sich um eine automatisierte Temperaturüberwachung. Für die Durchführung der mit diesem System im Zusammenhang stehenden, kleinen Subprozesse (die ob ihrer Fülle und der besseren Übersichtlichkeit halber in dieser einen VA beschrieben werden sollen) werden eben mitunter verschiedene „vertrauliche“ Informationen benötigt.
Dies betrifft beispielsweise die Handynummer des Mobilgerätes, an welches Alarm- und Status-Meldungen gesendet werden, sowie die zugehörigen PINs, PUKS und Zugangsdaten für z.B. die Anmeldung an einem Konto, das für den Bezug von Apps benötigt wird, aber auch jene Daten, die benötigt werden, um sich am entsprechenden Server anzumelden, um Änderungen in der Konfiguration des Überwachungssystems vorzunehmen.
Die Daten sind demnach zwar vertraulich, jedoch nicht per se mitarbeiter-/personenbezogen und sollten im Optimalfall auch nicht geändert werden, sofern es nicht unbedingt nötig wird.
Unter Punkt 5.a) 1. gehen Sie auf die Trennung von vertraulichen und nicht vertraulichen Inhalten ein. Wenn ich VAen vom QMH trenne um der vertraulichen Informationen willen, warum können dann diese VAen nicht auch vertrauliche Informationen wie (möglichst über längeren Zeitraum gleich bleibende) allgemeine Zugangsdaten enthalten?
Ich hätte die oben genannten Daten eigentlich eher gemäß Punkt 2.a) Inhalt: als (nicht physische) „Hilfsmittel“ bzw. „Werkzeuge“ eingeordnet.
Bestünde alternativ die Möglichkeit, eben jene Daten in Dokumente des Typs Arbeitsanweisung einzubinden?
Ziel der angestrebten VA ist eigentlich nur, sämtliche (der bald unüberschaubaren) Informationen soweit zu bündeln, dass man nicht mehr die unterschiedlichsten Ordner (sei es „analog“ oder im DMS) nach Vertragsunterlagen oder diversen Anmeldeinformationen durchsuchen muss.
Über einen Tipp in die richtige Richtung wäre ich Ihnen sehr dankbar.
Mit freundlichen Grüßen
Sehr geehrte Frau Slomka,
Sie haben alle Möglichkeiten offen: Ob in einer Verfahrens- oder Arbeitsanweisung oder einem sonstigem Dokument, das ist Ihnen überlassen. Ich würde wahrscheinlich die Zugangsdaten in einen passwort-geschützten Dokument im gleichen Ordner speichern, das vielleicht sogar „Zugangsdaten“ heißt. Dass Passwort, um die Datei zu öffnen, könnten Sie dann per Telefon oder SMS übertragen. Auf dieses Dokument würden Sie in Ihrer VA bzw. AA verweisen (einschließlich Name und Pfad).
Hilft das? Falls nicht, haken Sie einfach nach.
Viele Grüße, Christian Johner
Sehr geehrter Herr Johner,
die Zugangsdaten in eine extra Datei mit Passwortschutz einzubinden, klingt tatsächlich nach einem ziemlich guten Kompromiss.
Ich werde versuchen, das so umzusetzen.
Nochmals vielen Dank für Ihren Rat und den hilfreichen Lösungsansatz!
Mit freundlichen Grüßen
R. Slomka
Sehr geehrter Herr Prof. Dr. Johner,
wie Sie beschrieben haben trennen wir unser QM-Handbuch und Verfahrensanweisungen. Unter anderem ist in den Verfahrensanweisungen firmeninternes Know-How enthalten. Deshalb galt es für uns immer diese Verfahrensanweisungen werden nicht an Kunden oder dritte Parteien versendet. Bei z.B. einem Audit können diese eingesehen und überprüft werden.
Nun kommt es jedoch immer häufiger vor, dass bei neuen Projekt der Kunde als kritisch definierte Verfahren erst freigeben muss. Dazu fordern diese natürlich unsere vertraulichen Verfahrensanweisungen mit firmeninternem Know-How. Das ist eine Zwickmühle, denn ohne dass der Kunde dies Anweisungen nicht erhält und freigibt, laufen die Projekte nicht weiter.
Haben Sie mit solchen Situationen schon Erfahrungen gemacht und haben eine Idee für eine Lösung?
Mit freundlichen Grüßen
D. Kämper-Lankoff
Sehr geehrter Herr Kämper-Kankoff,
diese Situationen sind nicht ganz unüblich. Die einfach Lösung gibt es nicht. Aber hier ein paar Gedanken:
Vielleicht ist etwas Hilfreiches für Sie dabei.
Viele Grüße, Christian Johner
Guten Tag,
bei uns stellt sich aktuell die Frage, ob wir in eine unserer SOP’s als Geltungsbereich den gesamten Konzern angeben können.
Ich hoffe auf eine kurze Antwort und Danke im Voraus.
Mit freundlichen Grüßen
Beate Jenne
Sehr geehrte Frau Jenne,
ja, das können Sie machen. Es ist sogar bei einigen SOPs üblich, eine unternehmensweite Gültigkeit zu deklarieren. Entsprechend muss sich dann das ganze Unternehmen danach richten.
Viele Grüße, Christian Johner
Hallo,
„Weiterführende Informationen
Das kostenlose Starter-Kit beinhaltet zum einen obige Mindmap und zum anderen eine Infografik, die Ihnen die Verfahrensanweisungen benennt, die Sie ergänzen oder überarbeiten müssen, um die Forderungen der ISO 13485:2016 zu erfüllen.“
Leider konnten wir im vor einiger Zeit runter geladenen Starter Kit weder die genannte Mindmap, noch die Infografik mit den Verfahrensanweisungen finden. Können Sie uns einen Tipp geben, welche Datei diese Infos beinhalten soll.
Danke!
Sehr geehrte Frau Henrich,
ich danke Ihnen vielmals für Ihren wertvollen Hinweis.
Die neueste Version des Starter Kits enthält nun eine Mindmap, die die Kapitelstruktur der ISO 13485:2016 abbildet.
Entsprechend haben wir direkt ein Update dieses Artikels vorgenommen.
Gerne sende ich Ihnen ein Bild der Mindmap mit den Verfahren per Mail zu.
Liebe Grüße,
Ulrich Hafen
Sehr geehrter Herr Prof. Dr. Johner,
erst einmal vielen Dank für Ihre ausführlichen Informationen auf Ihrer Webseite. Hier hole ich mir gern Input. Nun habe ich zum Thema gelenkte Dokumente nach ISO 13485 gesucht. Ich bin mir noch immer recht unsicher, welche Dokumente alle tatsächlich übers QM gelenkt werden müssen. Neben den unstrittigen Arbeits-/Verfahrensanweisungen und Prozessen haben wir eine ordentliche Menge an Formularen u Vorgabedokumenten. Müssen bspw. Gebrauchsanweisungen, Wartungsanweisungen und Beratungsbögen und Produktinfos für den Vertrieb zwingend übers QM gelenkt werden? Oder handelt es sich hierbei um Dokumente im jeweiligen Verantwortungsbereich, in welchem auch die Bereitstellung sichergestellt werden muss?
Vielen Dank für Ihre Antwort.
Freundliche Grüße
Stefanie Bade
Sehr geehrte Frau Bade,
ich danke Ihnen sehr für Ihr Kompliment zu unseren Inhalten!
Formulare, die Sie zur Erfüllung von Anforderungen nutzen, sollten Sie definitiv auch als gelenkte Dokumente in Ihr QMS mit aufnehmen und, wo sinnvoll, in Ihren Arbeits- und Verfahrensanweisungen darauf verweisen.
Dokumente wie Gebrauchsanweisungen zu z. B. beschafften Produkten sollten Sie ebenfalls, dann als sogenannte „Externe Dokumente“, in Ihre Dokumentenlenkung mit aufnehmen (ISO 13485 4.2.4 f)).
Dokumente wie Gebrauchsanweisungen zu ihren Eigenen Produkten sind Bestandteil der Medizinproduktakte (ISO 13485 4.2.3). Zudem sind Gebrauchsanweisungen Bestandtel der Technischen Dokumentation nach MDR/IVDR Anhang II und werden über Ihre Entwicklungsvorgaben gelenkt. Dennoch empfiehlt sich ausdrücklich die Aufnahme der von Ihnen genannten Dokumente in die Dokumentenlenkung Ihres QMS (bei Werbematerial zumindest solches nach MDR Artikel 20 (5)), da es eher die Regel als die Ausnahme ist, dass Gebrauchsanweisungen, weitere Begleitdokumente und auch Werbeflyer etc. wesentlich öfter eine Anpassung erfahren (müssen), als dass das zugehörige Produkt einem Update unterzogen wird.
Liebe Grüße,
Ulrich Hafen