Die ISO 13485 ist eine harmonisierte Norm, die Anforderungen an das Qualitätsmanagement (QM) bzw. an die QM-Systeme (QMS) von Medizinprodukteherstellern formuliert.
Hersteller können mithilfe der ISO 13485 nachweisen, dass sie die gesetzlichen Anforderungen der MDR und der IVDR an ein QM-System erfüllen. Selbst die FDA verweist in ihren Quality System Regulations (21 CFR part 820) verbindlich auf die ISO 13485.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel, die beim Aufbau, Betreiben und Auditieren von Qualitätsmanagementsystemen helfen:
- Fachartikel zu den Grundlagen
- Fachartikel zu den Verfahrensanweisungen
- Fachartikel zu Prüfungen (Audits und Validierungen)
- Fachartikel zu weiteren Themen
- Unterstützung beim Aufbau und Verbessern von QM-Systemen
1. Fachartikel zu den Grundlagen
a) FAQ zum Qualitätsmanagement und zur ISO 13485
Für einen schnellen Einstieg eignen sich die FAQ zu Qualitätsmanagementsystemen und zur ISO 13485. Es beantwortet u. a. die folgenden Fragen:
- Wer benötigt ein QM-System?
- Muss das QM-System die Anforderungen der ISO 13485 oder der ISO 9001 erfüllen?
- In welchen Fällen muss das QM-System nach ISO 13485 zertifiziert sein?
- Was muss man tun, um eine Zertifizierung nach ISO 13485 zu erhalten?
- Wie lange dauert und wie viel kostet eine Zertifizierung nach ISO 13485?
- Wie verläuft der Weg bis zu einer Zertifizierung nach ISO 13485?
b) Normen
Es gibt viele Normen und Versionen zum Qualitätsmanagement:
c) QM-Handbuch
Im Gegensatz zur ISO 9001 verpflichtet die ISO 13485 die Organisationen zu einem QM-Handbuch. Dieses Handbuch muss die Qualitätsziele und die Qualitätspolitik beschreiben.
Die Pflege dieses Handbuchs übernimmt meist der Qualitätsmanagementbeauftragte (QMB).
2. Fachartikel zu den Verfahrensanweisungen
a) Allgemeines
Die ISO 13485 verlangt, das eigene Vorgehen zu beschreiben. Üblicherweise erfolgt das mithilfe von Verfahrensanweisungen und Arbeitsanweisungen, die wiederum andere Vorgabedokumente wie Formulare und Checklisten referenzieren.
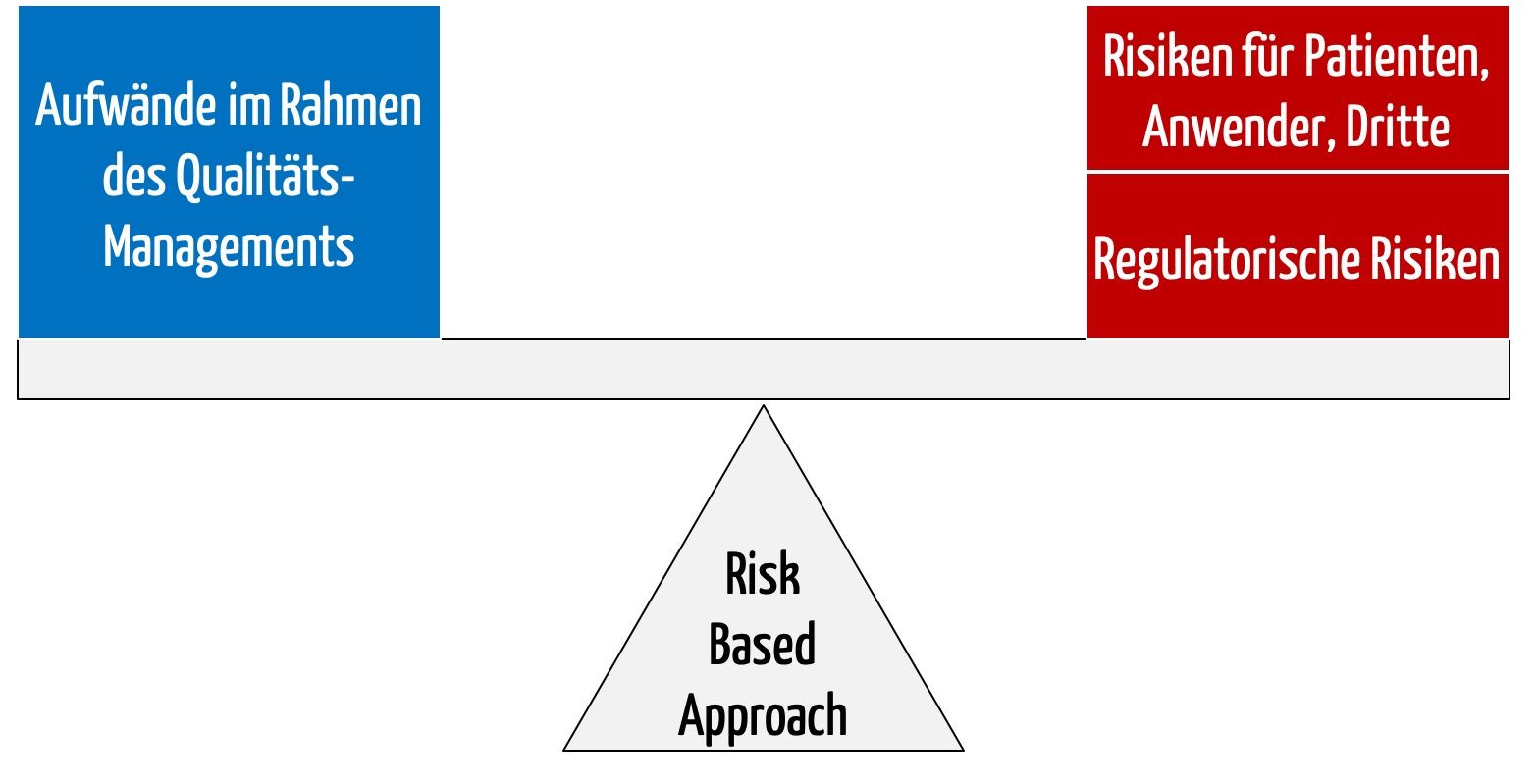
Dieser Artikel verschafft Ihnen einen Überblick über die notwendigen Verfahrensanweisungen. Beim Schreiben dieser Verfahrensanweisungen empfiehlt sich die Wahl eines risikobasierten Ansatzes (Risk Based Approach).
Ein weiterer Beitrag beschreibt die Unterschiede zwischen Prozessorientierung und Prozessmanagement.
b) Einzelne Verfahrensanweisungen
Zu einzelnen Verfahrensanweisungen finden Sie weitere Fachartikel:
c) Validierung von Verfahren, Prozessen und Werkzeugen
Die ISO 13485 besteht auf die Validierung von Prozessen und Werkzeugen. Beachten Sie dazu die folgenden Fachartikel:
3. Fachartikel zu den Audits
Die Wirksamkeit des Qualitätsmanagementsystems wird im Rahmen von externen Audits durch Benannte Stellen sowie durch interne Audits geprüft. Für das letztere sind die internen Auditoren verantwortlich.
Ein Teil dieser Audits muss auch die Lieferantenaudits enthalten. Ferner sind Benannte Stellen zu unangekündigten Audits der Hersteller verpflichtet.
Zumindest für die externen Audits gibt es Vorgaben zur Auditdauer. Anforderungen an die Dauer und den Gegenstand der Audits legt auch das Medical Device Single Audit Program (MDSAP) fest. Damit können die Hersteller den Nachweis erbringen, dass sie die regulatorischen Anforderungen an das QM-System in vielen Ländern erfüllen (EU, FDA, Australien, Japan, Brasilien).
4. Fachartikel zu weiteren Themen
Für Organisationen, die Medizinprodukte entwickeln, sind auch die folgenden Artikel relevant:
5. Unterstützung für Ihr QM-System
Haben Sie noch Fragen, beispielsweise zum Aufbau Ihres QM-Systems? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Johner Institut unterstützt Medizinproduktehersteller, deren Dienstleister und Labore beim Aufbau und der kontinuierlichen Verbesserung von QM-Systemen.
a) Aus- und Weiterbildung
Die Seminare vermitteln Ihnen die notwendigen Kompetenzen:
In der Johner Academy verschaffen Sie sich mit Videos und mit Selbsttests das regulatorische Grundlagenwissen (nicht nur zum Qualitätsmanagement).
b) Hilfe zur Selbsthilfe
Der Auditgarant unterstützt Sie bei der Erstellung Ihres QM-Systems. Das Programm beinhaltet:
- Onboarding mit Überblick über den Fahrplan
- Videotrainings
- Mustervorlagen, die Sie noch an die eigene Situation anpassen müssen
- Wöchentliche Sessions mit Experten, die Ihre Fragen beantworten
c) Beratung und Übernahme von Rollen
Nutzen Sie die Beraterinnen und Berater des Johner Instituts! Diese …
Interessiert? Dann nehmen Sie gleich Kontakt mit uns auf.
Unter QM-Zertifizierung bezeichnet man die Zertifizierung eines Qualitätsmanagementsystems (QM-System oder QMS) durch eine Zertifizierstelle. Die Zertifizierung bestätigt dem zertifizierten Unternehmen, dass sein QM-System einem Standard genügt, typischerweise einer Norm (z. B. ISO 9001, ISO 13485) oder einem Gesetz (z. B. MDR, IVDR).
Regularien wie die MDR und die ISO 13485 fordern von den Herstellern, die Qualitätsziele und die Qualitätspolitik festzulegen. Sie bilden eine Voraussetzung für die Konformität des QM-Systems und damit für das Erreichen des zugehörigen Zertifikats.
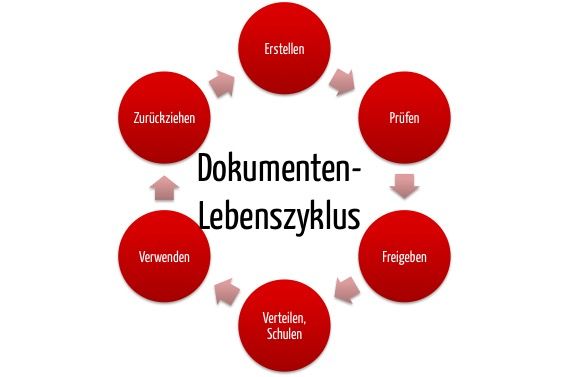
Unter Dokumentenlenkung versteht man ein dokumentiertes Verfahren, das festlegt, wie Dokumente erstellt, geprüft, genehmigt, gekennzeichnet, verteilt und aktualisiert werden. Nach ISO 9001 oder ISO 13485 zertifizierte Organisationen sind zur Dokumentenlenkung verpflichtet.
Details
Interne Audits sind Prüfungen des Qualitätsmanagement-Systems (QM-Systems) und seiner Prozesse durch die Organisation selbst. Daher werden sie auch 1st Party Audits genannt. Die ISO 13485 fordert interne Audits ebenso wie ihre „Schwesternorm“, die ISO 9001, und andere Normen und Regularien. Deshalb sind interne Audits auch Gegenstand der externen Audits und Voraussetzung für die QM-Zertifizierung. Dieser…
Details
In einer Verfahrensanweisung (VA), auch Standard Operating Procedure (SOP) oder Prozessbeschreibung genannt, legen Firmen ihre Abläufe fest, beispielsweise wie sie Produkte entwickeln oder Dienstleistungen erbringen. Die Normen wie die ISO 9001 und die ISO 13485 fordern solche Verfahrensanweisungen. Diese Vorgaben können Firmen direkt im Qualitätsmanagementhandbuch oder in eigenständigen Dokumenten festlegen.
Details
Die ISO/IEC 42001 trägt den Titel „Information technology – Artificial intelligence – Management system“. Erste Medizinproduktehersteller haben sich auf den Weg gemacht, sich nach dieser Norm zertifizieren zu lassen. Doch sind die Aufwände dafür gerechtfertigt? Hilft die ISO/IEC 42001 dabei, die Anforderungen des AI Act zu erfüllen? Antworten gibt dieser Artikel.
Details
Die DAkkS, die Deutsche Akkreditierungsstelle, ist die nationale Akkreditierungsbehörde der Bundesrepublik Deutschland.
MDR und IVDR sowie die ISO 13485:2016 formulieren ebenso wie die FDA klare Anforderungen an die Lieferantenbewertung, Lieferantenauswahl und Lieferantenüberwachung. Dieser Artikel verschafft Ihnen einen Überblick über die regulatorischen Anforderungen an das Lieferantenmanagement. Er gibt zudem Tipps zur praxisnahen Umsetzung und verrät, wann ein Lieferantenaudit notwendig ist.
Details
Viele Behörden und Regularien sprechen von einem Risk-Based Approach (RBA), auf Deutsch: risikobasierter Ansatz. Allerdings definieren sie diesen Begriff nicht und nennen auch keine Beispiele. Dieser Artikel verschafft einen Überblick darüber, wie das Risikomanagement und die ISO 13485 zusammenspielen und was ein „Risk-Based Approach“ ist und gibt konkrete Hinweise dazu, wie
Details
Gesetze und Normen (z. B. FDA, ISO 13485) fordern eine „objective evidence“, auf Deutsch einen „objektiven Nachweis“. Antworten auf diese Fragen gibt dieser Artikel.
Details