Die ISO 13485 ist eine harmonisierte Norm, die Anforderungen an das Qualitätsmanagement (QM) bzw. an die QM-Systeme (QMS) von Medizinprodukteherstellern formuliert.
Hersteller können mithilfe der ISO 13485 nachweisen, dass sie die gesetzlichen Anforderungen der MDR und der IVDR an ein QM-System erfüllen. Selbst die FDA verweist in ihren Quality System Regulations (21 CFR part 820) verbindlich auf die ISO 13485.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel, die beim Aufbau, Betreiben und Auditieren von Qualitätsmanagementsystemen helfen:
- Fachartikel zu den Grundlagen
- Fachartikel zu den Verfahrensanweisungen
- Fachartikel zu Prüfungen (Audits und Validierungen)
- Fachartikel zu weiteren Themen
- Unterstützung beim Aufbau und Verbessern von QM-Systemen
1. Fachartikel zu den Grundlagen
a) FAQ zum Qualitätsmanagement und zur ISO 13485
Für einen schnellen Einstieg eignen sich die FAQ zu Qualitätsmanagementsystemen und zur ISO 13485. Es beantwortet u. a. die folgenden Fragen:
- Wer benötigt ein QM-System?
- Muss das QM-System die Anforderungen der ISO 13485 oder der ISO 9001 erfüllen?
- In welchen Fällen muss das QM-System nach ISO 13485 zertifiziert sein?
- Was muss man tun, um eine Zertifizierung nach ISO 13485 zu erhalten?
- Wie lange dauert und wie viel kostet eine Zertifizierung nach ISO 13485?
- Wie verläuft der Weg bis zu einer Zertifizierung nach ISO 13485?
b) Normen
Es gibt viele Normen und Versionen zum Qualitätsmanagement:
c) QM-Handbuch
Im Gegensatz zur ISO 9001 verpflichtet die ISO 13485 die Organisationen zu einem QM-Handbuch. Dieses Handbuch muss die Qualitätsziele und die Qualitätspolitik beschreiben.
Die Pflege dieses Handbuchs übernimmt meist der Qualitätsmanagementbeauftragte (QMB).
2. Fachartikel zu den Verfahrensanweisungen
a) Allgemeines
Die ISO 13485 verlangt, das eigene Vorgehen zu beschreiben. Üblicherweise erfolgt das mithilfe von Verfahrensanweisungen und Arbeitsanweisungen, die wiederum andere Vorgabedokumente wie Formulare und Checklisten referenzieren.
Dieser Artikel verschafft Ihnen einen Überblick über die notwendigen Verfahrensanweisungen. Beim Schreiben dieser Verfahrensanweisungen empfiehlt sich die Wahl eines risikobasierten Ansatzes (Risk Based Approach).
Ein weiterer Beitrag beschreibt die Unterschiede zwischen Prozessorientierung und Prozessmanagement.
b) Einzelne Verfahrensanweisungen
Zu einzelnen Verfahrensanweisungen finden Sie weitere Fachartikel:
c) Validierung von Verfahren, Prozessen und Werkzeugen
Die ISO 13485 besteht auf die Validierung von Prozessen und Werkzeugen. Beachten Sie dazu die folgenden Fachartikel:
3. Fachartikel zu den Audits
Die Wirksamkeit des Qualitätsmanagementsystems wird im Rahmen von externen Audits durch Benannte Stellen sowie durch interne Audits geprüft mit dem Ziel einer QM-Zertifizierung. Für das letztere sind die internen Auditoren verantwortlich.
Ein Teil dieser Audits muss auch die Lieferantenaudits enthalten. Ferner sind Benannte Stellen zu unangekündigten Audits der Hersteller verpflichtet.
Zumindest für die externen Audits gibt es Vorgaben zur Auditdauer. Anforderungen an die Dauer und den Gegenstand der Audits legt auch das Medical Device Single Audit Program (MDSAP) fest. Damit können die Hersteller den Nachweis erbringen, dass sie die regulatorischen Anforderungen an das QM-System in vielen Ländern erfüllen (EU, FDA, Australien, Japan, Brasilien).
4. Fachartikel zu weiteren Themen
Für Organisationen, die Medizinprodukte entwickeln, sind auch die folgenden Artikel relevant:
5. Unterstützung für Ihr QM-System
Haben Sie noch Fragen, beispielsweise zum Aufbau Ihres QM-Systems? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Johner Institut unterstützt Medizinproduktehersteller, deren Dienstleister und Labore beim Aufbau und der kontinuierlichen Verbesserung von QM-Systemen.
a) Aus- und Weiterbildung
Die Seminare vermitteln Ihnen die notwendigen Kompetenzen:
In der Johner Academy verschaffen Sie sich mit Videos und mit Selbsttests das regulatorische Grundlagenwissen (nicht nur zum Qualitätsmanagement).
b) Hilfe zur Selbsthilfe
Der Auditgarant unterstützt Sie bei der Erstellung Ihres QM-Systems. Das Programm beinhaltet:
- Onboarding mit Überblick über den Fahrplan
- Videotrainings
- Mustervorlagen, die Sie noch an die eigene Situation anpassen müssen
- Wöchentliche Sessions mit Experten, die Ihre Fragen beantworten
c) Beratung und Übernahme von Rollen
Nutzen Sie die Beraterinnen und Berater des Johner Instituts! Diese …
Interessiert? Dann nehmen Sie gleich Kontakt mit uns auf.
Die NIS-2 (Network and Information Security) Richtline ist eine europäische Richtlinie (Directive (EU) 2022/2555), die innerhalb der EU die Mindeststandards für die Cybersecurity festlegt. Betrifft diese Richtlinie auch IVD- und Medizinproduktehersteller? Falls ja, was verlangt sie und was sollten die Hersteller tun? Antworten gibt Ihnen dieser Fachartikel.
Details
Das Medical Device Single Audit Program (MDSAP) wurde ins Leben gerufen, um einen Wunsch vieler Medizinproduktehersteller zu erfüllen: Statt vieler Audits und Inspektionen durch die Behörden verschiedener Länder soll es nur noch eines geben. Die Teilnahme am MDSAP soll ausreichen, um die Wirksamkeit und Konformität von QM-Systemen (z. B. Konformität mit ISO 13485 oder 21…
Details
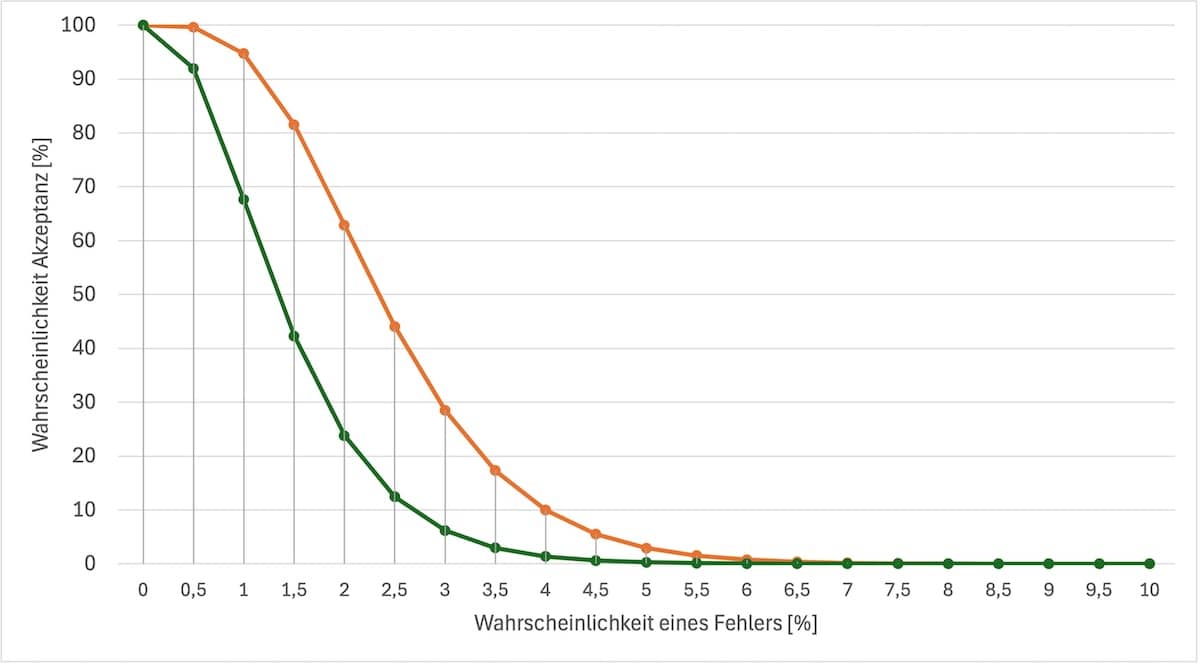
AQL steht für Acceptable Quality Level und wird manchmal mit „erlaubte Ausschussquote“ übersetzt. Das AQL bestimmt, wann ein Los an Teilen oder Produkten auf Basis einer Stichprobenprüfung zurückgewiesen bzw. akzeptiert wird. Doch regelmäßig akzeptieren Auditoren das AQL nicht mehr. Was tun? Dieser Artikel gibt Antworten. 1. Wen das Thema „AQL“ wann betrifft 1.1 Betroffene Rollen…
Details
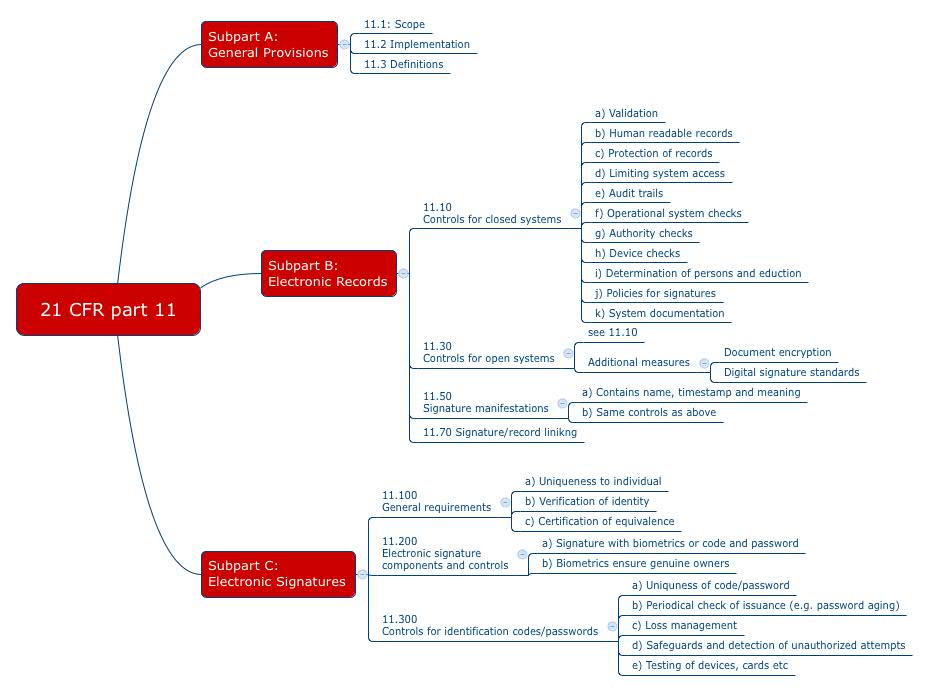
Mit dem 21 CFR Part 11 formuliert die FDA ihre Anforderungen an die elektronischen Aufzeichnungen und Unterschriften. Diese Anforderungen richten sich auch an Medizinproduktehersteller. Viele Firmen drucken Dokumente auf Papier aus und unterschreiben diese dann mit Hand, um die Anforderungen des „Part 11“ zu umgehen. Andere nutzen Signatur-Dienstleister. Doch ist das alles notwendig?
Details
Was MDR und IVDR verwechseln und weshalb Sie nicht von CAPA sprechen sollten Die FDA (im 21 CFR part 820 – QSR) und die ISO 13485 unterscheiden Leider unterscheiden die MDR und die IVDR diese Konzepte nicht präzise. Auch viele Hersteller glauben, „corrective and preventive actions“ zu einem CAPA-Prozess zusammenfassen zu können. Doch das ist genauso unpräzise wie die mangelnde…
Details
Im 21 CFR part 820 formuliert die FDA die Anforderungen an die Qualitätsmanagementsysteme u.a. von Medizinprodukteherstellern. Damit ist bzw. war der 21 CFR part 820 (Quality System Regulation QSR) das Pendant zur ISO 13485.
Eine FDA-Inspektion ist für viele Hersteller von Medizinprodukten mit großem Stress verbunden. Viele Firmen kennen die möglichen Konsequenzen wie einen öffentlichen Warning Letter und gar eine strafrechtliche Verfolgung. Aber sie wissen oft nicht, wie sie diese Konsequenzen sicher vermeiden können, ohne tagelang das ganze Unternehmen stillzulegen. Dieser Artikel zeigt, wie So wird eine FDA-Inspektion für…
Details
Diese FAQ geben Antworten auf die häufigsten Fragen, die Firmen wie Medizinproduktehersteller zu Qualitätsmanagementsystemen (QM-Systemen) und zur ISO 13485 haben.
Die Digitalisierung der Produktion ist ein wesentlicher Bestandteil der digitalen Transformation von produzierenden Unternehmen. Doch nicht alle Unternehmen profitieren im gleichen Maß von Digitalisierungsmaßnahmen. Dieser Artikel beschreibt,
Details
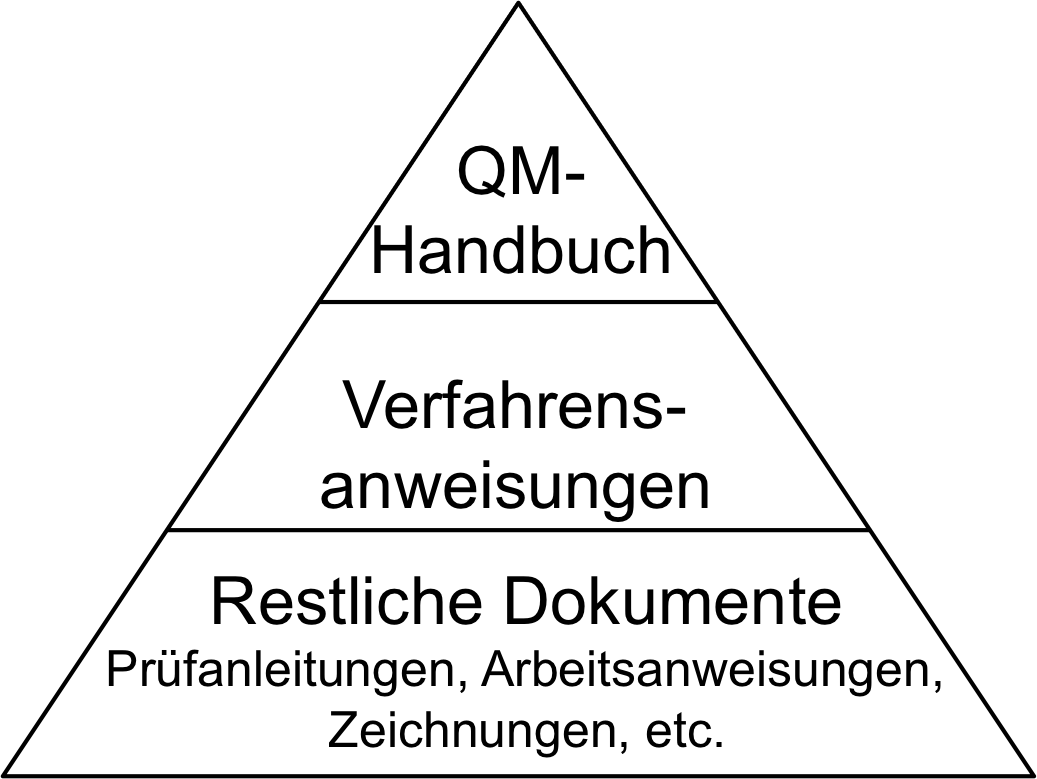
Das QM-Handbuch stellt in der Dokumentenpyramide des QM-Systems das oberste Dokument dar. Es dient als Einstiegspunkt für Mitarbeiter und Auditoren, um einen schnellen Überblick über das QM-System zu verschaffen. Erfahren Sie in diesem Beitrag, wann Sie ein QM-Handbuch benötigen, welche Ziele es verfolgt und welche Inhalte es enthalten sollte.
Details