Die ISO 20417:2021 Medical devices – Information to be supplied by the manufacturer stellt Anforderungen an die allgemeinen Informationen, die Hersteller mit ihrem Medizinprodukt bzw. IVD ausliefern müssen. Den Autoren ist es gelungen, in übersichtlicher und verständlicher Weise die Kriterien zusammenzustellen.
Die ISO 20417:2021 steht auch auf der Liste der unter der EU-Medizinprodukteverordnung (MDR) zu harmonisierenden Normen. Sie soll die EN 1041:2008+A1:2013 ersetzen, welche bisher unter der EU-Medizinprodukterichtlinie (MDD) die Anforderungen an die zu liefernden Informationen beschrieb. Deshalb sollten Medizinproduktehersteller die ISO 20417 kennen und jetzt schon anwenden.
Dieser Beitrag verschafft Ihnen einen Überblick über die Norm und stellt Ihnen die wichtigsten Unterschiede zur EN 1041 vor. Damit ist es Ihnen möglich, die Konformität Ihrer „Begleitmaterialien“ rasch zu überprüfen.
1. Anwendungsbereich der ISO 20417
a) Von der ISO 20417 berücksichtigte Regularien
Die Norm schreibt im Vorwort, dass sie als zentrale Quelle von allgemeinen und anzugebenden Informationen dienen soll. Sie berücksichtig dabei die Anforderungen an die zu liefernden Informationen aus folgenden Regularien:
- IMDRF/GRRP WG/N47:2018 Essential Principles of Safety and Performance of Medical Devices and IVD Medical Devices
- IMDRF/GRRP WG/N52:2019 Labelling Principles for Medical Devices and IVD Medical Devices on the information supplied by the manufacturer of a medical device
- MDR (EU) 2017/745
- IVDR (EU) 2017/746
b) Von der ISO 20417 gelieferte Informationen
Die ISO 20417 stellt gleich zu Beginn klar, für welche Arten der zu liefernden Informationen sie Vorgaben machen möchte. Sie gibt dazu auch wichtige Begriffsdefinitionen.
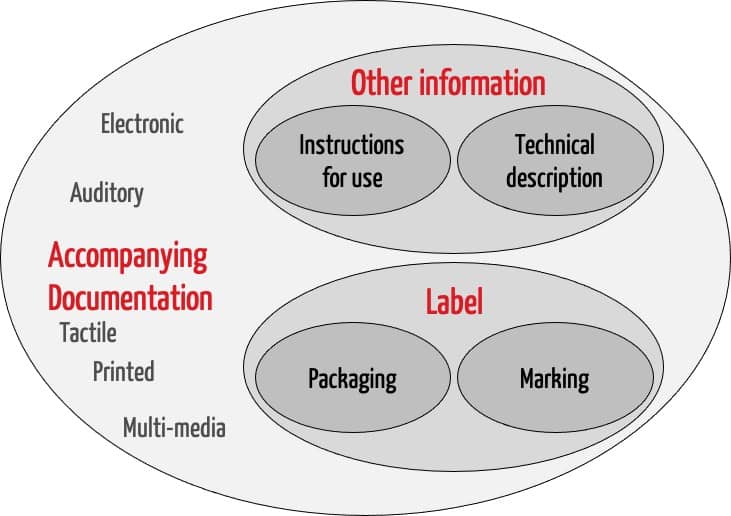
Die ISO 20417 ist anwendbar für die zu liefernden Informationen (Accompanying information). Ein Teil dessen sind das Label und Other information. Das Label wiederum besteht aus Angaben auf der Verpackung (Packaging) und dem Etikett (Marking) auf dem Produkt selbst. „Other information“ bestehen aus der Gebrauchsanweisung (Instructions for use) und der technischen Beschreibung (Technical description).
2. Definitionen und Abgrenzung der Begriffe „Label“ und „Labelling“
a) Vorsicht, Begriffschaos!
Die Definition des Begriffs Label in der ISO 20417 deckt sich mit der Definition in der MDR bzw. IVDR. Leider verwenden MDR und IVDR nicht konsistent den Begriff Label, sondern nutzen synonym an vielen Stellen den Begriff Labelling. Das führt zu Verwirrung, da Labelling in anderen relevanten Regularien eine andere Bedeutung als Label hat.
So verwenden z. B. die ISO 13485 und die IMDRF den Begriff Labelling (oder Labeling) als Synonym für Accompanying information. Dort bezeichnetLabelling also alle gelieferten Informationen einschließlich Label und IFU (Instructions for use).
Lesen Sie hier mehr zum Thema Labeling bei Medizinprodukten.
Im Deutschen wird es noch verwirrender, da sowohl für Label als auch für Labelling häufig das Wort „Kennzeichnung“ verwendet wird (siehe 13485).
Dass die ISO 20417 statt Labelling durchgehend Accompanying information verwendet, dürfte Verwechselungen mit dem Begriff Label vorbeugen (anders als in der MDR/IVDR geschehen). Die Trennung der verschiedenen Begriffe sowie die eindeutigen Definitionen der ISO 20417 dürften Klarheit schaffen und für ein einheitliches Begriffsverständnis sorgen.
Ob die ISO 20417 dies auch in der deutschen Übersetzung leisten kann, bleibt abzuwarten. Zur Zeit liegt die finale Version noch nicht auf Deutsch vor. Der deutsche Entwurf aus 2019 nährt diese Hoffnung nicht.
b) Klarstellungen durch Definitionen
Die ISO 20417 hilft mit einer Vielzahl an Definitionen, das Begriffschaos zu lichten.
Die Norm nutzt zwar nicht den Begriff Labelling, definiert aber den Begriff Label.
Auch für die anderen Begriffe, die das Venn-Diagramm in Abb. 1 aufführt, liefert die Norm die Definitionen.
Ein Sonderfall der „sonstigen Informationen“ ist die Gebrauchsanweisung (Instructions for use).
Diese Definition stimmt nicht ganz mit der Definition der MDR überein:
Ebenfalls zu den „sonstigen Informationen“ zählt die technische Beschreibung (Technical description).
Den Begriff Labelling kennt die ISO 20417 nicht, aber die ISO 13485:2016.
Damit entspricht das Labelling gemäß ISO 13485 am ehesten den Accompanying information der ISO 20417.
3. Kapitelstruktur der ISO 20417
Die Kapitelstruktur der ISO 20417 wurde gegenüber der der EN 1041 komplett überarbeitet, um dem erhöhtem Umfang gerecht zu werden.
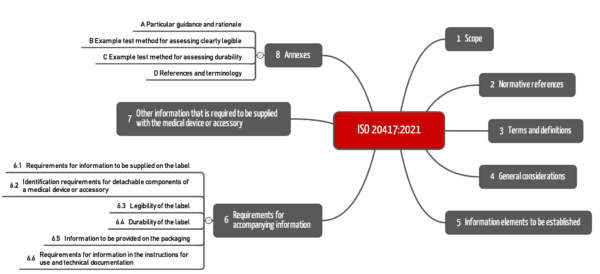
Kapitel 4 und 5 stellen generelle Anforderungen an Informationen der Accompanying documentation, also sowohl an das Label als auch an Gebrauchsanweisung und technische Beschreibung.
Kapitel 6 nennt jeweils spezifische Anforderungen an die Informationen
- auf den Labels (6.1, 6.3, 6.4),
- auf den abtrennbaren Produktteilen (6.2),
- auf der Verpackung (6.5) und
- auf der Gebrauchsanweisung (6.6).
Kapitel 7 stell weitere Anforderungen zu Angaben bezüglich
- des Importeurs (7.1),
- des Händlers (7.2),
- der Wiederverpackung (7.3),
- der Übersetzung (7.4) und
- der Regularien (7.5).
Die informativen Anhänge enthalten hilfreiche Hinweise zur Verifizierung der Leserlichkeit (Legibility) und der Haltbarkeit (Durability) sowie Referenzen zur IVDR/MDR, den oben genannten IMDRF-Dokumenten und zur ISO 16142- 1 und-2.
4. Anforderungen der ISO 20417:2021 (Auswahl)
Die ISO 20417 hat mit über 80 Seiten enorm an Inhalt hinzugewonnen. Das rührt daher, dass alle Anforderungen der MDR/IVDR und der IMDRF-Dokumente integriert wurden. Einige Anforderungen ergänzen die MDR/IVDR, andere präzisieren diese und geben hilfreiche Hinweise. Im Folgenden werden einige Beispiele besonders hervorgehoben.
a) Risk Management und Usability Engineering
Im Risk-Management- und Usability-Engineering-Prozess sollte ermittelt werden, welche Informationen die Accompanying information enthalten müssen, um eine sicherere Benutzung des Produkts zu fördern.
Die Informationen müssen so gestaltet sein, dass sie von den vorgesehenen Nutzern verstanden werden (siehe Kapitel 4).
b) Verwendung von Symbolen
Aus der MDR geht nicht eindeutig hervor, ob für die Kennzeichnung (Label) Symbole verwendet werden müssen. Die ISO 20417 stellt in Kapitel 5.2 „Graphical information“ klar, dass Informationen der Kennzeichnung entweder textlich oder mit Hilfe von Symbolen beschrieben werden können. Falls Symbole verwendet werden, gibt die Norm vor, aus welchen Normen diese Symbole entnommen werden sollten (z. B. ISO 15223-1). Falls nicht anders vom Gesetzgeber bestimmt, sollten diese Symbole in der Gebrauchsanweisung erklärt werden.
Das Johner Institut empfiehlt, verwendete Symbole immer in der Gebrauchsanweisung zu beschreiben, da gerade Laienanwendern die Bedeutung einiger Symbole nicht klar sein dürfte.
c) Sprach-Codes
Um bei mehrsprachigen Informationen die verwendeten Sprachen zu kennzeichnen, können die Sprach-Codes aus der ISO 639, Teile 1-3 verwendet werden (siehe Kapitel 5.3).
d) Datum
Das Datum muss im Format JJJJ-MM-TT oder JJJJ-MM oder JJJJ angegeben werden (siehe Kapitel 5.4).
e) Kennzeichnung (Label) auf dem Produkt selbst oder der Verpackung
Die MDR schreibt etwas schwammig, dass die Kennzeichnung (Label) auf dem Produkt selbst oder, falls “dies nicht praktikabel oder angemessen” ist, auf der Verpackung gegeben werden muss (siehe MDR, Anhang I 23.1 (b)). Die ISO 20417 präzisiert im Kapitel 6.1.1, dass die Angaben nur dann nicht auf dem Produkt selbst gemacht werden müssen, falls
- die Dimension des Produkts dies nicht zulässt,
- das Oberflächenmaterial des Produkts dies nicht ermöglicht oder
- das Weglassen der Angaben auf dem Produkt selbst nicht zu Risiken führen könnte.
f) eIFU
Falls eine elektronische Gebrauchsanweisung anstatt einer Gebrauchsanweisung (Instructions for use) in Papierform vorliegt, muss darauf auf dem Label aufmerksam gemacht werden. Dazu kann das entsprechende Symbol aus der ISO 15223-1 verwendet werden (siehe Kapitel 6.1.3 (d)).
g) Nanotechnologie
Falls das Produkt Nanomaterialien enthält, sollte das auf dem Label vermerkt werden. Dazu kann das entsprechende Symbol aus der ISO 15223-1 verwendet werden (siehe Kapitel 6.1.3 (e)).
h) Gebrauchsanweisung als Risikokontrollmaßnahme
Falls die Gebrauchsanweisung einen Teil der Risikokontrollmaßnahmen darstellt, muss auf dem Label darauf hingewiesen werden, dass die Gebrauchsanweisung gelesen werden muss (siehe Kapitel 6.1.5). Dies kann in Form von Text, dem Sicherheitszeichen ISO 7010-M002 oder dem Symbol ISO 7000-1641 (bzw. Symbol 5.4.3 der ISO 15223-1) bewerkstelligt werden.
i) Kennzeichnung von abtrennbaren Produktteilen
Wenn die Fehlidentifizierung von abtrennbaren Produktteilen ein Risiko darstellt, müssen gemäß ISO 20417, Kapitel 6.2 diese Teile eine eigene verkürzte Kennzeichnung (Label) mit folgenden Angaben erhalten:
- Herstellername (ohne Adresse)
- Produktidentifikation
- Lot-Nummer
j) Angaben auf der Verpackung
Zusätzlich zum Etikett (Marking) auf dem Produkt selbst müssen auch auf der Verpackung Informationen angegeben werden wie Hersteller (inkl. Adresse), Produktidentifikation usw. (siehe Kapitel 6.5).
k) Minimalismus der Gebrauchsanweisung
Die Gebrauchsanweisung sollte nur die regulatorisch geforderten Angaben enthalten sowie alle weiteren Angaben, die der Anwender für die sichere und effektive Benutzung benötigt. Auf Informationen, die nicht vom Anwender benötigt werden bzw. regulatorisch nicht gefordert sind, sollte verzichtet werden.
Diese Angaben können in die technische Beschreibung (Technical description) ausgelagert werden (siehe Kapitel 6.6.2 b).
l) Bereitstellung von Informationen auf der Webseite
Die MDR formuliert etwas schwammig:
„Each device shall be accompanied by the information needed to identify the device and its manufacturer, and by any safety and performance information relevant to the user, or any other person, as appropriate. Such information may appear on the device itself, on the packaging or in the instructions for use, and shall, if the manufacturer has a website, be made available and kept up to date on the website, taking into account the following: […]“
MDR Anhang I Absatz 23.1
Bedeutet das nun, dass die gesamte Gebrauchsanweisung auf der Webseite verfügbar sein muss oder nur die Teile, die Sicherheit und Leistung betreffen?
Die ISO 20417 schreibt, dass die gesamte Gebrauchsanweisung auf der Webseite zur Verfügung gestellt werden sollte (also nicht muss; siehe Kapitel 6.6.5 (a)). Wirklich Klarheit bringt das aber nicht.
m) Angaben bei Wiederverpackung und Übersetzung
Falls das Produkt von jemand anderem als vom Hersteller wiederverpackt oder die Kennzeichnung (Label) oder Gebrauchsanweisung übersetzt wurde (bspw. bei Importen), müssen auf der Kennzeichnung der Name und die Anschrift dieses Dritten angegeben werden. Dazu dürfen die Hersteller die entsprechenden Symbole aus der ISO 15223-1 verwenden.
5. Unterschiede zur EN 1041
Das Kapitel 4 „Requirements“ der EN 1041 ist in der ISO 20417 in zwei Kapitel aufgeteilt worden, welche nun deutlich mehr Anforderungen enthalten:
- 4 „General considerations“
- 5 „Information elements to be established“
Das Kapitel 5 der EN 1041, „Requirements for provision of information“, ist in Kapitel 6 der ISO 20417, „Requirements for accompanying information“, aufgegangen. Es hat folgende neue Unterkapitel erhalten:
- 6.1 „Requirements for information to be supplied on the label“
- 6.2 „Identification requirements for detachable components of a medical device or accessory“
- 6.5 „Information to be provided on the packaging“
- 6.6 „Requirements for information in the instructions for use and technical description“
Die Kapitel
- 6.3 „Legibility of the label“ (in der EN 1041 betitelt als “Legibility”) und
- 6.4 „Durability of markings“ (in der EN 1041 betitelt als “Availability”)
der ISO 20417 sind schon aus der EN 1041 bekannt, haben allerdings an Umfang hinzugewonnen.
Das Kapitel 5.2.2 „Accessibility“ der EN 1041 findet sich nun in Kapitel 4 e der ISO 20417 wieder, das Kapitel 5.2.5 „Security“ ist entfallen. Die ISO 20417 fordert im Gegensatz zur EN 1041 nicht mehr explizit, dass das Etikett gegen Korrumpierung und vorsätzliche Veränderung geschützt sein muss.
Auch kommt das Kapitel 5.2.6 der EN 1041, „Changes to information provided“, nicht mehr in der ISO 20417 vor. Änderungen an den bereitgestellten Informationen müssen nach ISO 20417 den bestehenden Anwendern nun nicht mehr zwangsläufig mitgeteilt werden. Kapitel 6 “Documentation“ ist ebenfalls entfallen.
6. Fazit
Die ISO 20417 fasst die Anforderungen verschiedener relevanter Regularien übersichtlich und verständlich zusammen. Sie präzisiert einige unklare Anforderungen der MDR/IVDR und gibt praktische Hinweise, wie diese erfüllt werden können. Somit können die Hersteller mit der Norm effizient die Anforderungen der MDR/IVDR sowie weiterer Regularien erfüllen.
Eine klare Definition und die Abgrenzung der Begriffe ist gelungen und dürfte hoffentlich dazu beitragen, Verwechselungen der Begriffe Label und Labelling vorzubeugen sowie für ein gemeinsames Begriffsverständnis zu sorgen.
Die ISO 20417 bietet Herstellern eine echte Hilfestellung, um die Anforderungen an die zu liefernden Informationen (Accompanying information) zu erfüllen.
Den Herstellern sei empfohlen, ihre zu liefernden Informationen (Accompanying information) anhand der ISO 20417 zu überprüfen und, sofern vorhanden, ihre Checklisten für die Accompanying information (das Labelling) zu aktualisieren.
Benötigen Sie Unterstützung bei der Überprüfung Ihres Labels oder der Gebrauchsanweisung oder beim Erstellen der Gebrauchsanweisung? Dann nehmen Sie gerne Kontakt mit uns auf.




An einer Stelle ist der Norm leider keine klare Definition und die Abgrenzung der Begriffe ist gelungen, nämlich bei den verschiedenen Ebenen der Kennzeichnung der Produktidentität.
Einerseits wird der „commercial product name“ in der Norm an vielen Stellen als Oberbegriff für model number und catalogue number verwendet, andererseits ist er in der Definition von catalogue number explizit als Synonym festgelegt, also auf derselben Ebene.
Statt „commercial product name“ hätte man bei vielen Stellen im Text lieber den des „brand or trade name“ verwendet, wie es das referenzierte Dokument IMDRF/GRRP WG/N52 macht. Das würde auch deutlich besser zum Beispiel in 6.1.3 passen.
Sie schreiben bei h)
„Falls die Gebrauchsanweisung einen Teil der Risikokontrollmaßnahmen darstellt, muss auf dem Label darauf hingewiesen werden, dass die Gebrauchsanweisung gelesen werden muss (siehe Kapitel 6.1.5).“ Die Norm schreibt aber nur vor, dass das Symbol auf dem Gerät oder Zubehör angegeben werden muss.
„When the manufacturer uses consulting the accompanying information as a primary risk control
measure for a specific risk, (e.g., the instructions for use contain information for safety), the medical
device or accessory shall be labelled with: (…).“
Sehr geehrter Herr Herber,
vielen Dank für Ihren Hinweis.
Ich habe den Blogartikel entsprechend aktualisiert.
Danke nochmal und herzliche Grüße
Nils Becker
Sehr geehrter Herr Becker,
mit der Einhaltung der ISO 20417 weist man die Erfüllung der Forderungen der MDR hinsichtlich Begleitdokumentation für Medizinprodukte nach. Genügt der Nachweis der Umsetzung der ISO 20417 auch als Nachweis, dass man die in der MDR genannte Verordnung (EU) Nr. 207/2012 erfüllt? Oder sollte man diese in den Checklisten zusätzlich separat adressieren?
Herzlichen Dank für eine Einschätzung schon vorab!
Beste Grüße
Sonja Oechsler
Sehr geehrte Frau Oechsler,
vielen Dank für Ihre Frage.
Ob Sie eine eIFU bereitstellen dürfen und welche Anforderungen daran verknüpft sind, regelt nun die EU VO 2021/2226. Diese hebt die VO 207/2012 auf.
Die 207/2021 gilt allerdings noch weiterhin für Produkte, die unter der MDD in Verkehr gebracht worden sind, entsprechend der jeweiligen Übergangsfristen (siehe https://www.johner-institut.de/blog/johner-institut/uebergangsfristen-mdr/).
Leider genügt in keinem Fall die ISO 20417 zum Nachweis der Erfüllung der VO 2021/2226 oder der VO 207/2012, da die Norm die Anforderungen der Verordnungen nicht adressiert.
Ich hoffe, ich konnte Ihnen weiterhelfen.
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Becker,
das Kapitel „7.5 Behördliche Identifizierung“ der DIN EN 20417 empfinde ich als teilweise unverständlich. Darin werden „behördliche Bezugsinformationen“ und „graphische Darstellungen zur behördlichen Klassifizierung“ verlangt.
Wissen Sie, was hier mit „behördliche Bezugsinformationen“ gemeint ist?
Mit ein wenig Phantasie interpretiere ich die „graphische Darstellung zur behördliche Klassifizierung“ als die Risikoklasse des Medizinprodukts. Sind Sie mit mir da einer Meinung?
Danke und beste Grüße
C. Molewicz
Sehr geehrter Herr Molewicz,
vielen Dank für Ihre Frage.
in der englischen Version nennt sich das Kapitel „7.5 Regulatory identification“ und „graphische Darstellung zur behördliche Klassifizierung“ übersetzt sich als „regulatory classification graphics“. Ich gebe zu, dass ich mir nicht ganz sicher bin, was Kapitel 7.5 fordert, aber die englische Übersetzung lässt mich vermuten, dass hiermit graphische Symbole wie das CE-Kennzeichen oder das „MD“- oder „IVD“-Symbol gemeint sein könnten.
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Becker,
im Zuge der Erstellung von GAP-Analysen für die 20417:2021 und 15223-1:2021 für unsere Produkte ist mir insbesondere der Abschnitt 6.1.5 „Gebrauchsanweisung beachten“ der 20417 aufgefallen. Meiner Meinung finden sich hier Widersprüche in den beiden Normen:
Während die 15332-1 für das Symbol 5.4.3 sagt: „..zeigt dem Anwender an, dass es NOTWENDIG ist, die Gebrauchsanweisung zu beachten“, unterscheidet die 20417, ob die Beachtung der Begleitinfo als eine primäre Risikobeherrschungsmaßnahme behandelt wird (die Begleitinfo also sicherheitsbezogene Infos enthält). Wenn ja, MUSS das Zeichen ISO 7010 verwendet werden (blaues Gebotszeichen), anderenfalls DARF das oben erwähnte Zeichen aus der 15223-1 Kapitel 5.4.3. verwendet werden, „..um den Anwender darauf hinzuweisen, dass die IfU zu Rate zu ziehen ist“.
Die 15223-1 erlaubt gemäß Definition, dass ich das Zeichen nutze, wenn sicherheitsbezogene Infos in der Begleitinfo sind („notwenig“). Genau dies verbietet mir aber die 20417.
Da die meisten IfU’s der Medizinprodukte Warnungen enthalten, die über die Risikoanalyse dort hineinfließen, dürfte in Zukunft das Zeichen 5.4.3 aus der 15223-1 kaum verwendet werden.
Sind dies nicht unterschiedliche Sichtweisen, wie die Zeichen verwendet werden sollten? Oder wie sehen Sie dies? Interpretiere ich da vielleicht etwas falsch?
Mit freundlichen Grüßen
Kai Just
Sehr geehrter Herr Just,
vielen Dank für Ihre spannende Frage. Gerne gebe ich Ihnen meine Sicht auf dieses Thema.
Sie haben recht, wenn im Risikomanagement Sicherheitshinweise in der IFU als Risikokontrollmaßnamen festgelegt werden, müssen Sie laut ISO 20417 auf dem Label das Symbol ISO 7010-M002 verwenden oder textlich darauf aufmerksam machen. In dem Fall wäre nur das Anbringen des Symbols aus der ISO 15223-1 Kapitel 5.4.3 nicht zulässig.
Wenn keine entsprechenden Risikokontrollmaßnahmen festgelegt wurden, darf das Symbol aus der ISO 15223-1 verwendet werden. Auch wenn keine primären Risikokontrollmaßnamen in der IFU umgesetzt sind, kann es dennoch „notwendig“ sein, die IFU zu lesen, um den bestimmungsgemäßen Gebrauch effektiv durchführen zu können. In dem Fall würde ein Hinweis aufs Lesen der IFU mit Hilfe des Symbols aus der ISO 15223-1 sinnvoll sein.
Ich gebe Ihnen aber recht, in den meisten Fällen wird das Anbringen des Symbols ISO 7010-M00 notwendig sein.
Ich hoffe, meine Antwort hilft Ihnen weiter. Ansonsten haken Sie gerne nach.
Herzliche Grüße
Nils Becker
Um mich der Diskussion anzuschließen:
Bedarf es dann dem Symbol ISO 7010-M002 oder kann ich tatsächlich alternativ auch Text verwenden? Es stellt uns nämlich insbesondere bei der aktuellen „Schwarz-Weiß“ Etiketten Situation vor enorme Herausforderungen, künftig blaue Symbole (insbesondere aufgrund von großen Mengen) umsetzen zu müssen. Lieben Dank für Ihr Feedback!
Lieber Herr Jung,
vielen Dank für Ihre Frage.
Als Hinweis die IFU zu lesen, erlaubt die ISO 20417 in Kapitel 6.1.5. auch einen Text anstatt des Symbols zu verwenden. Falls Sie doch das Symbol verwenden, muss es in der Originalfarbe abgedruckt werden (siehe „Application rules“ unter https://www.iso.org/obp/ui#iso:grs:7010:M002).
Ich hoffe meine Antwort hilft Ihnen weiter. Ansonsten haken Sie gerne nach.
Herzliche Grüße
Nils Becker
Sehr geehrter Herr Becker,
mir ist hier eine verwirrende Anforderung an die Etikettierung bezüglich des Verfallsdatums in der ISO 20417 aufgefallen.
In Kapitel 6.1.4 3) wird als Angabe (muss) gefordert: „das Jahr, den Monat und den Tag, bis zu dem sein Gebrauch sicher ist“
In der MDR Anhang I 23.2 i) steht aber: „eine eindeutige Angabe der Frist, innerhalb der das Produkt sicher verwendet oder implantiert werden kann, die mindestens das Jahr und den Monat umfasst, sofern dies zweckdienlich ist“
Übergeht die Norm hier die MDR mit der Forderung nach der Datumsangabe in Jahr/Monat/Tag oder ist es nur verwirrend formuliert und die MDR Minimalforderung Jahr/Monat ist weiterhin ausreichend?
Eine obligatorische Angabe des Tages ist in keinem Vorgängerdokument vorhanden. Nicht in der Richtlinie, nicht in der Verordnung und auch nicht in der alten Norm 1041 bzw. ZLG papieren (3.3 A 5 ).
Mit freundlichen Grüßen
M. Lehmann
Sehr geehrter Herr Lehmann,
vielen Dank für Ihre Frage.
Ich habe mir das Kapitel 6.1.4. 3) nochmal in der englischen Ausgabe der Norm angesehen. Dort heißt es „the year, month and day by which it is safe to use; or“. Ich fürchte, hier liegt keine verwirrende Formulierung vor. Ich interpretiere die ISO 20417 folglich so, dass die Frist mit Jahr-Monat-Tag angegeben werden muss. Die Anforderung der Norm ist somit schärfer als die MDR.
Mit freundlichen Grüßen
Nils Becker
Hallo,
Meint das Wort Label (Englisch) bzw. Etikett (Deutsch) in der Norm ALLE Labels / Etiketten die auf das Gerät angebracht werden (können) oder meint es nur ein Label, nämlich das Label, das alle Medizinprodukte ausreichend kennzeichnet – bei uns wäre das das Typenschild.
Die Frage ist ob man UDI ausgeschrieben vor den DataMatrix Code bringen muss, sobald irgendwo anders auf dem Gerät ein weiterer (nicht UDI) DataMatrix Code ist.
Mit freundlichen Grüßen
Randy Vogel
Lieber Herr Vogel,
danke für Ihre Frage. In der Tat gibt es mehrere Auffassungen, was die Begriffe bedeuten und die Übersetzungen erschweren zusätzlich ein gemeinsames Verständnis. Ich kann Ihnen aber zumindest darlegen, wie die ISO 20417 die Begriffe definiert. Mit Label ist jegliche Information auf dem Produkt selbst und auf der Verpackung gemeint (“written, printed, or graphic information appearing on the item itself, on the packaging of each item or on the packaging of multiple items“). Label wird von der Norm als „Etikett“ übersetzt. Informationen auf dem Produkt selbst werden als „Marking“ bezeichnet („information, in text or graphical format, durably affixed, printed, etched (or equivalent) to a medical device or accessory“), auf Deutsch „Kennzeichnung“ (was Sie als Typenschild bezeichnen). Die regulatorisch geforderten Informationen sollten auf dem Produkt selbst angebracht werden (Kennzeichnung) und nur falls dies nicht möglich ist, dürfen diese auf der Verpackung angebracht werden.
Wenn Sie mehrere DataMatrix Codes (AIDC) auf dem Label haben, also auf dem Produkt selbst und/oder auf der Verpackung, müssen Sie die UDI zusätzlich als solche durch das entsprechende Symbol 5.7.10 der ISO 15223-1 kennzeichnen (siehe 6.1.4 b und 6.5.1 b der ISO 20417).
Ich hoffe, meine Antwort hilft Ihnen weiter. Ansonsten fragen Sie gerne nach.
Herzliche Grüße
Nils Becker
Recht herzlichen Dank, für die schnelle, ausführliche, aber vor allem konkrete Antwort.
Viele Grüße
Randy Vogel
Guten Tag,
wir wollen ein neues Produkt auf den Markt bringen und ich hadere nun mit dem Abschnitt 6.1.3 a).
Bei Punkt 1) steht, dass man die Verwendung identifizieren können muss.
Heißt das, dass ich das Produkt nicht einfach z.B. „MUSTERLight LED 10“ nennen kann sondern noch „Untersuchungsleuchte“ dazuschreiben muss?
Die Leuchte ist nur für Fachpersonal.
Beim Beispiel in A.2 steht ja auch nciht „Flugzeug“ dabei :/
Vielen Dank schon mal für Ihre Antwort 🙂
Liebe Frau Lerch,
vielen Dank für Ihre spannende Frage.
Genau genommen wird in der Norm gefordert, Einzelheiten anzugeben, „die der Anwender benötigt, um: i) das Medizinprodukt oder das Zubehör und ii) dessen Verwendung zu identifizieren“.
Ich denke die Betonung liegt hier auf dem Anwender. Benötigt der Anwender keine weiteren Angaben auf dem Etikett (Verpackung oder Kennzeichnung auf dem Produkt), um das Produkt identifizieren zu können, müssen auch keine gegeben werden. Gerade wenn aber die Identifikation aus Risikosicht wichtig ist, sollte das Etikett durch Text oder Graphiken Einzelheiten für die Identifikation angeben. Das kann bedeuten, dass man „Untersuchungsleuchte“ für XY dazuschreeben muss.
Ich hoffe meine Antwort hilft Ihnen weiter. Ansonsten haken Sie gerne nach.
Herzliche Grüße
Nils Becker
Guten Tag,
bei uns ist die Frage aufgekommen, ob es Vorgaben/Normen gibt, in denen die Gestaltung der eIFU und „Papier“-IFU vorgegeben wird oder ob die Gestaltung „egal“ ist.
Die Papier IFU ist nämlich zum Falten und als PDF-Datei ist das Titelbild ganz unten rechts zu finden, was natürlich nicht anwenderfreundlich ist. Deshalb wollten wir ein anderes Layout nehmen , die beigelegte IFU bleibt allerdings ein Faltblatt.
Ich bedanke mich für jegliche Hilfe.
Liebe Frau W.,
hierzu schreibt EU Verordnung 2021/2226:
„Die gesamte elektronische Gebrauchsanweisung liegt als Text vor, der Symbole und Grafiken enthalten kann, und enthält mindestens die gleichen Angaben wie die Gebrauchsanweisung in Papierform. Video- oder Audiodateien können zusätzlich bereitgestellt werden.“
Auch wenn diese Formulierung für mich etwas verwirrend erscheint, so zeigt dies jedoch auf, dass es vorrangig auf den Inhalt ankommt. Dieser muss identisch sein. Kleinere Änderungen, die die Gebrauchstauglichkeit nicht beeinflussen können (Sie sollten dies in Ihrem Usability File zumindest erwähnen), sollten daher kein Problem darstellen. Es dürfen nur keine neuen oder veränderten Inhalte aufgenommen werden.
Herzliche Grüße
Christopher Seib
Geschätzte Damen und Herren
Bei Punkt 6.1.3 Identifizierung des Medizinprodukts oder Zubehörs werden Beispielbegriffe wie „Medikamentenbeschichteter Stent“ zur Identifikation der Verwendung genannt. Sämtliche Beispielbegriffe der englischen Variante der ISO 20417 scheinen der Liste der EMDN ‚codes‘ & ‚descriptions‘ entlehnt zu sein. Ist daraus zu schliessen, dass die zutreffende EMDN ‚description‘ zur Identifizierung der Verwendung auf dem Etikett genannt werden muss, genannt werden soll oder man sich damit zumindest regulatorisch einen Gefallen tut? Die Begriffe sind ja häufig etwas sperrig und werden inklusive den Übersetzungen viel Platz auf dem Etikett erfordern, auf der anderen Seite darf man auf offizielle Übersetzungen in die relevanten Unionssprachen hoffen. Kennen Sie hierzu noch Hinweise auf den Zeithorizont, wann man mit den entsprechenden Übersetzungen rechnen darf?
Vielen Dank für Ihre geschätzte Einschätzungen und freundliche Grüsse
Adrian Müller
Sehr geehrter Herr Müller,
es gibt keine regulatorische Vorgabe, die Sie an den Wortlaut der EMDN Codes bindet. Die Formulierungen bieten sich an, um es dem Anwender einfacher zu machen (Stichwort Gebrauchstauglichkeit, sofern durch den Namen ein Verwechslungsrisiko reduziert werden kann), jedoch auch nur bis zu einem bestimmten Grad.
Wann bzw. ob überhaupt eine Übersetzung vorliegen wird, bleibt abzuwarten. Hier habe ich auch keine näheren Informationen – bedenkt man jedoch, wie lange es gedauert hat, die italienischen Bezeichnungen ins Englische zu übersetzen (und das teilweise auch noch fehlerhaft), dann würde ich in den nächsten Jahren nicht damit rechnen.
Herzliche Grüße
Christopher Seib
Hallo zusammen,
aktuell steht bei uns das Thema der „empfohlenen Qualitätskontrollverfahren“ [Kapitel 6.6.2 Abschnitt d) Punkt 6)] an, die die ISO 20417 mit der Einschränkung „falls zutreffend“ fordert. Sinnvollerweise sind hier Verfahren gemeint, die der Hersteller selbst für das Produkt festlegt und dem Nutzer kommunizieren will.
Gibt es hier nach Ihrer Meinung Vorgaben zu den Verfahren, die allgemein empfehlenswert sind? Also eine Art „Best Practice“ für die Umsetzung dieser Anforderung?
Danke und Beste Grüße!
Hallo Christian,
ich bin mir nicht ganz sicher, ob ich Ihre Frage bereits vollständig erfasst habe. Sie sollten immer die vom Hersteller vorgegebenen und validierten (!) Verfahren zur Qualitätskontrolle an den Anwender weitergeben. Dabei müssen mindestens die Punkte i – v des genannten Abschnitts adressiert werden. Mehr wenn sinnvoll und notwendig, weniger nur dann, wenn nicht zutreffend (zum Beispiel bei keinen bekannten Einschränkungen).
Zum Umfang der nötigen Qualitätskontrolle kann ich keine Aussage treffen, ohne Ihr Produkt genau zu kennen.
Herzliche Grüße
Christopher Seib
Sehr geehrte Damen und Herren,
die Umsetzung der ISO 20417 im operativen Bereich führt immer wieder zu Fragen oder offenbart Widersprüche zu anderen Normen/ anwendbaren Standards (siehe z.B. Konversation Just-Becker am 02/03.08.2022 zu den anwendbaren Symbolen).
Dadurch stellt sich die Frage, was man tatsächlich als Hersteller in welcher Form beachten muss, um mit den geltenden regulatorischen Anforderungen konform zu sein (und einen roten Faden bei der Implementierung der Kennzeichnungspflichten zu haben).
Grundsätzlich werden die rechtlichen Rahmenbedingungen für die Kennzeichnung von Medizinprodukten durch die Anforderungen der MDR definiert.
Da die gesetzlichen Anforderungen, (meist prioritär) über denen von anwendbaren Standards stehen (also auch der ISO 20417), stellt sich für mich die Frage:
1. Ob ich diese überhaupt anwenden muss (auch im Hinblick auf den State-Of-The-Art)?
Weiterhin (wie eingangs schon erwähnt) widersprechen sich die Anforderungen hinsichtlich der Anwendung von Symbolen zwischen der ISO 20417 und der ISO 15223-1. Nun ist aber so, dass die MDR im Annex I, 23.1. unter Punkt h) fordert, dass
[…] Any symbol or identification colour used shall conform to the harmonised standards or CS […]
Dies bedeutet, dass ich als Hersteller, prioritär die vorgegebene Symbolik der ISO 15223-1 beachten müsste, da die Ausgabe der ISO 15223-1:2021 durch den Durchführungsbeschluss (EU) 2022/6 mit der MDR harmonisiert worden ist (die ISO 20417 ist hingegen nicht mit der MDR harmonisiert).
2. Bin ich als Hersteller bzgl. der Symbolverwendung konform mit den regulatorischen Anforderungen, wenn ich alleinig die Symbole der ISO 15223-1 verwende (um den Widerspruch mit der ISO 20417 bezüglich der Verwendung des Symbols ISO 7010-M002 aufzulösen)?
Vielen Dank vorab und viele Grüße
Norman Kaufmann
Sehr geehrter Herr Kaufmann,
die Reihenfolge haben Sie korrekt definiert: Erst kommt die MDR, dann die harmonisierte EN ISO 15223-1 und dann die EN ISO 20417. Letztere ist zwar auf der Liste der zu harmonisierenden Normen, das ist aber aktuell eben noch nicht umgesetzt. Das bedeutet, Sie müssen das „Was“ aus der MDR einhalten, unterstützt durch das „Womit“ aus der EN ISO 15223-1 (außer, Sie haben eine sehr gute Rationale, warum ein anderes Symbol besser ist…). Die EN ISO 20417 würde ich dennoch als Stand der Technik nicht ganz außen vor lassen, zumal sie von der FDA ebenfalls „recognized“ wurde. Sie sollten diese Norm soweit anwendbar und sinnvoll erfüllen, können aber im Zweifel auch Argumente finden, warum die Anwendung teilweise nicht angebracht ist.
Am Beispiel Gebrauchsanweisung beachten (ich sehe hier keinen Widerspruch in den Normen): Die MDR macht die Vorgabe „Dass“. Die EN ISO 15223-1 beschreibt Symbol 5.4.3, verweist aber wiederum auf die EN ISO 20417, um ggf. das Symbol ISO 7010-M002 als konkretes Sicherheitszeichen anzuwenden (was in den meisten Fällen zutreffen wird).
Ich hoffe, ich könnte Ihre Fragen damit klären!
Herzliche Grüße
Christopher Seib
Sehr geehrte Damen und Herren,
trotz intensiver Recherche auf den EU-Webseiten ist es mir nicht gelungen, herauszufinden, ob die DIN EN ISO 20417:2022-03 inzwischen harmonisiert wurde oder nicht. Mir scheint, es ist noch nicht soweit.
Vielleicht könnten Sie mir bitte den aktuellen Stand nennen (ja oder nein 😉
Besten Dank!
Mit herzlichen Grüßen
Claudia Klöckl
Sehr geehrte Frau Klöckl,
kurze Antwort: Nein.
Ausführliche Antwort: Die Norm befindet sich aktuell auf der langen Warteliste der bis 2028 zu harmonisierenden Normen (https://ec.europa.eu/transparency/documents-register/detail?ref=C(2024)3371&lang=en). Ich würde sie bis dahin tatsächlich als Stand der Technik ansehen, da sie mehr oder weniger gut die Anforderungen der MDR ans Labeling erklärt, dabei aber (fast) keine zusätzlichen Vorgaben macht, und auch von der FDA „recognized“ ist.
Herzliche Grüße
Christopher Seib