Die Einteilung, ob ein Produkt ein Arzneimittel oder ein stoffliches Medizinprodukt ist, hat weitreichende regulatorische Folgen. Diese Einteilung ist so anspruchsvoll, dass es regelmäßig Dispute mit Behörden und Benannten Stellen gibt und 2023 sogar der EuGH dazu urteilen musste.
Dieser Artikel hilft Herstellern, Behörden und Benannten Stellen bei der „Qualifizierung“ eines Produkts. Er geht auf das erwähnte EuGH-Urteil sowie die regulatorischen Vorgaben und Leitlinien ein. Sie erfahren, was ein Präsentationsarzneimittel ist und in welchen Fällen die nationalen Gerichte doch noch gefragt sein werden.
1. Zusammenfassung für eilige Leser
- Ein Produkt, das seine medizinische Zweckbestimmung (fast) ausschließlich physikalisch erreicht, zählt als (stoffliches) Medizinprodukt.
- Ein Produkt, das seine medizinische Zweckbestimmung pharmakologisch, immunologisch oder metabolisch erreicht, wird als Arzneimittel qualifiziert.
Falls die physikalische Hauptwirkungsweise nicht eindeutig belegt ist, muss das Produkt als Arzneimittel behandelt werden.
Sie finden hier eine kompakte Übersicht über die regulatorischen Anforderungen an stoffliche Medizinprodukte.
2. Grundlagen
a) Was sind stoffliche Medizinprodukte?
Definition
Auch wenn die MDR die Existenz von “Produkten, die aus Stoffen oder Kombinationen von Stoffen bestehen” mit den Klassifizierungsregeln 3 und 21 anerkennt und einen Rechtsrahmen schafft, versäumt sie dennoch eine eindeutige Definition für stoffliche Medizinprodukte. Aus diesem Grund liefert die MDCG im Dokument MDCG 2022-5 nach und legt folgende Definition fest:
“A substance-based medical device is a medical device which:
· is composed of substances that are permitted in a medical device, and
· does not achieve its principal intended action by pharmacological, metabolic or immunological means.”
Quelle: MDCG 2022-5 / Part: 3.1
Stoffliche Medizinprodukte bestehen also aus Stoffen und ähneln in ihrer Aufmachung und Darreichungsform den Arzneimitteln. Sie erreichen jedoch ihre bestimmungsgemäße Hauptwirkung nicht über einen pharmakologischen, metabolischen oder immunologischen Mechanismus, sondern primär auf physikalischem Weg.
Beispiele
Beispiele für stoffliche Medizinprodukte sind:
- Salzwasserhaltige Nasen- oder Rachensprays
- Schleimhautbefeuchtende Sirupe, Rachensprays oder Lutschtabletten
- Künstliche Tränenflüssigkeiten
- Orale Mittel zur Neutralisierung von Magensäure
- Produkte mit entschäumender Wirkung bei gasbedingten Magen-Darm-Beschwerden
b) Was sind Arzneimittel?
Definition
Die Definition für Arzneimittel liefert die Richtlinie 2001/83/EG:
“a) Alle Stoffe oder Stoffzusammensetzungen, die als Mittel mit Eigenschaften zur Heilung oder zur Verhütung menschlicher Krankheiten bestimmt sind, oder
b) alle Stoffe oder Stoffzusammensetzungen, die im oder am menschlichen Körper verwendet oder einem Menschen verabreicht werden können, um entweder die menschlichen physiologischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen oder eine medizinische Diagnose zu erstellen.”
Quelle: Richtlinie 2001/83/EG, Artikel 1(2)
Diese Definition besteht aus zwei Teilen, wobei sich Teil a) eher auf die Präsentation bzw. Aufmachung eines Produkts (Präsentationsarzneimittel) bezieht und Teil b) auf die Funktion (Funktionsarzneimittel). Bei einem Produkt handelt es sich also dann um ein Arzneimittel, wenn es unter Teil a) oder Teil b) oder unter beide Teile der Definition fällt.
Die Begriffe „Präsentationsarzneimittel“ und „Funktionsarzneimittel“ sind nicht Bestandteil der Begriffsdefinition, sondern stellen gemäß BfArM eher gebräuchliche Bezeichnungen für die unterschiedlichen Präparate dar. Diese Unterscheidung wird vor allem zur Abgrenzung in der Rechtsprechung herangezogen.
- Demnach liegen Präsentationsarzneimittel vor, wenn ihre Bezeichnung oder Aufmachung (Werbung) beim durchschnittlich informierten Verbraucher den Eindruck erwecken, dass sie zur Heilung oder Verhütung menschlicher Krankheiten bestimmt sind, unabhängig von ihrer tatsächlichen Wirkungsweise.
- Hingegen nehmen Funktionsarzneimittel durch ihre Wirkung einen nennenswerten Einfluss auf die physiologischen Funktionen des menschlichen Organismus.
Das bedeutet in der Konsequenz, dass sich nur Funktionsarzneimittel definitionsgemäß durch eine tatsächliche (wissenschaftlich nachweisbare) pharmakologische, immunologische oder metabolische Wirkungsweise auszeichnen.
Beispiele
Beispiele für Arzneimittelgruppen sind:
- Analgetika
- Gerinnungshemmer
- Insulin
- Zytostatika
- Röntgenkontrastmittel
c) Unterschied von Arzneimittel und Medizinprodukt
Da stoffliche Medizinprodukte auch aus Stoffen bestehen und zum Zwecke der Behandlung, Linderung oder Verhütung menschlicher Krankheiten bestimmt sind, ist eine klare Abgrenzung von Medizinprodukten und (Präsentations-)Arzneimitteln oft nicht ohne Weiteres möglich.
Produkte, bei denen nicht von vornherein klar ist, ob es sich um ein Medizinprodukt oder um ein Arzneimittel handelt, werden gemäß MDCG 2022-5 als Grenzprodukte (Borderline-Produkte) bezeichnet. Bei der Abgrenzung dieser Produkte ist die hauptsächliche Wirkungsweise entscheidend.
Ein Produkt kann nicht unter beide Rechtsverordnungen fallen, also nicht gleichzeitig Arzneimittel und Medizinprodukt sein.
Für den Fall, dass ein Produkt sowohl unter die Definition ‚Medizinprodukt‘ als auch unter die Definition ‚Arzneimittel‘ fallen kann, ist das Produkt nach der sogenannten Zweifelsfallregelung ein Arzneimittel:
“In Zweifelsfällen, in denen ein Erzeugnis unter Berücksichtigung aller seiner Eigenschaften sowohl unter die Definition von „Arzneimittel“ als auch unter die Definition eines Erzeugnisses fallen kann, das durch andere gemeinschaftliche Rechtsvorschriften geregelt ist, gilt diese Richtlinie.”
Quelle: Richtlinie 2001/83/EG, Artikel 2(2)
d) Unterschied zwischen Arzneimittel und Medikament
Dieser Artikel betrachtet bewusst den Unterschied zwischen Arzneimitteln und Medizinprodukten und nicht zwischen Medikamenten und Medizinprodukten. Die Arzneimittel sind die Übermenge der Medikamente (s. Abb. 1). Zudem ist im Kontext dieses Artikels „Arzneimittel“ der relevante juristische Begriff. So spricht die MDR von Arzneimitteln, nicht von Medikamenten.
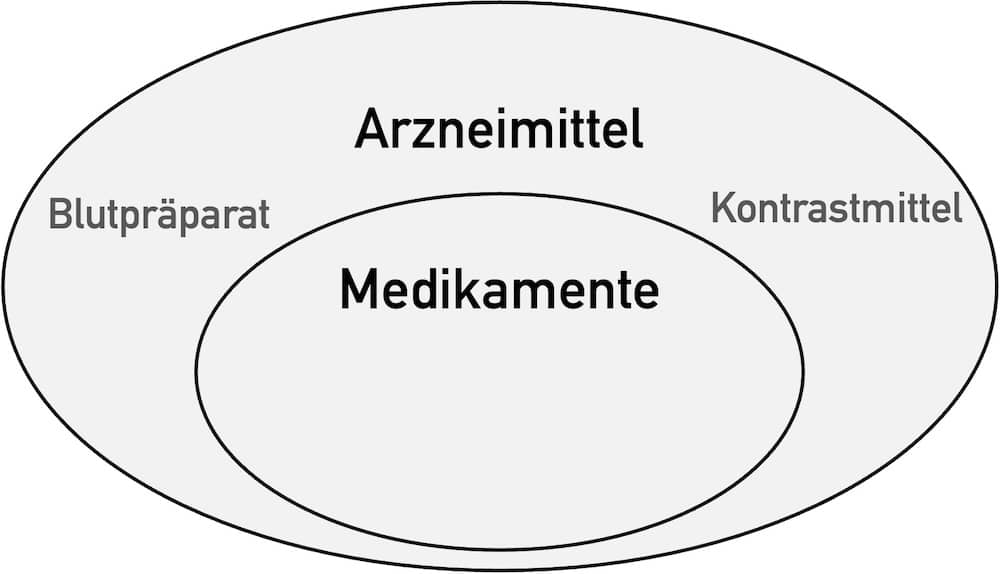
3. Das folgenreiche EuGH-Urteil
a) Der Sachverhalt
Der Europäische Gerichtshof beschäftigte sich auf Ersuchen des Bundesverwaltungsgerichts mit diversen Vorlagefragen zur Abgrenzung von stofflichen Medizinprodukten und Arzneimitteln. Ausgangspunkt waren Rechtsstreitigkeiten zur Qualifizierung von als Medizinprodukt deklarierten Präparaten zur Anwendung in der Nasenschleimhaut, für die jedoch laut Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) eine vorherige Zulassung als Arzneimittel erforderlich sei.
b) Die Entscheidung des EuGH
Das EuGH stellt mit seinem Urteil vom 19.01.2023 nochmals klar:
- Die bestimmungsgemäße Hauptwirkung von stofflichen Medizinprodukten ist überwiegend physikalischer Natur.
- Arzneimittel wirken hingegen auf pharmakologische, metabolische oder immunologische Weise.
Die Zweifelsfallregelung gemäß Artikel 2 (2) der RL 2001/83/EG ist dabei gleichermaßen auf Funktions- und Präsentationsarzneimittel anzuwenden.
Lässt sich jedoch die bestimmungsgemäße Hauptwirkung anhand der verfügbaren wissenschaftlichen Erkenntnisse für ein Produkt nicht eindeutig erklären, so ist dieses weder als Medizinprodukt noch als Arzneimittel einzustufen – so das EuGH.
Borderline-Produkte
Wie sind diese Borderline-Produkte in diesem Fall künftig einzuordnen?
Laut EuGH-Urteil bleibt die mögliche Einstufung als Präsentationsarzneimittel, denn dies sind gemäß Definition Produkte, die nicht aufgrund ihrer nachgewiesenen Wirkungsweise, sondern aufgrund ihrer Aufmachung und ihrer beworbenen Eigenschaften als Mittel zur Heilung oder zur Verhütung menschlicher Krankheiten bestimmt sind.
„Ist die Hauptwirkungsweise eines Erzeugnisses nicht wissenschaftlich festgestellt, kann dieses Erzeugnis weder unter die Definition des Begriffs „Medizinprodukt“ im Sinne der Richtlinie 93/42 in der durch die Richtlinie 2007/47 geänderten Fassung noch unter die Definition des Begriffs „Funktionsarzneimittel“ im Sinne der Richtlinie 2001/83 in der durch die Richtlinie 2004/27 geänderten Fassung fallen.
Es ist Sache der nationalen Gerichte, im Einzelfall zu beurteilen, ob die Voraussetzungen für die Definition des Begriffs „Präsentationsarzneimittel“ im Sinne der Richtlinie 2001/83 in der durch die Richtlinie 2007/47 geänderten Fassung erfüllt sind.“
EuGH-Urteil
Der EuGH sprach in diesem Kontext der Richtlinie für Arzneimittel (RL 2001/83/EG) ein höheres Verbraucherschutzniveau zu, da für die Inverkehrbringung der Arzneimittel die vorherige Erteilung einer behördlichen Genehmigung erforderlich ist.
4. Mögliche Folgen für Hersteller
Das Urteil des EuGH könnte erhebliche Folgen für die Hersteller vieler am Markt befindlicher stofflicher Medizinprodukte haben. Zu spät erkannte Fehler bei der Qualifizierung und Klassifizierung können Zeit, Aufwand und Geld kosten. Zudem riskieren die Hersteller rechtliche Auseinandersetzungen.
Fehlt der wissenschaftliche Nachweis, dass die bestimmungsgemäße Hauptwirkung im oder am menschlichen Körper auf physikalischem Weg und nicht durch pharmakologische, immunologische und metabolische Mittel erreicht wird, besteht die Gefahr, dass diese Grenzprodukte regelmäßig als Präsentationsarzneimittel eingestuft werden müssen und demzufolge der Rechtsverordnung für Arzneimittel unterliegen.
Wissenschaftlicher Nachweis ist entscheidend
Um kosten- und zeitintensive gerichtliche Streitfälle zur Abgrenzung zu verhindern, ist es wichtig, die Wirkung des Produkts wissenschaftlich nachzuweisen. Dabei gilt:
- Nur ein Produkt, das durch ausschließlich physikalische Wirkmechanismen seine Zweckbestimmung erfüllt, fällt unter die Definition des Begriffs ‚Medizinprodukt‘ im Sinne der MDR.
- Werden Stoffe verwendet, die grundsätzlich pharmakologisch, immunologisch oder metabolisch wirken können, ist besondere Vorsicht geboten: In diesem Fall ist zu demonstrieren, dass diese Stoffe bei der Erfüllung der bestimmungsgemäßen Hauptwirkung des Produkts keine Rolle spielen (z. B. Aroma- und Konservierungsstoffe).
- Ein Produkt, das seine bestimmungsgemäße Hauptwirkung ausschließlich auf pharmakologischen, immunologischen oder metabolischen Weg erreicht, fällt unter die Definition des Begriffs ‚Arzneimittel‘ im Sinne der RL 2001/83/EG
- Kann ein Produkt sowohl unter die Definition ‚Medizinprodukt‘ als auch unter die Definition ‚Arzneimittel‘ fallen, so gilt die Zweifelsfallregelung gemäß Artikel 2 (2) der RL 2001/83/EG und das Produkt wird als Arzneimittel eingeordnet
- Bei unklarer Wirkungsweise bzw. fehlendem wissenschaftlichem Nachweis fällt das Produkt weder unter die Definition des Begriffs ‚Medizinprodukt‘ noch unter die Definition des Begriffs ‚Arzneimittel‘.
- Wenn ein Produkt in seiner Aufmachung einem Medizinprodukt entspricht, aber zur Erreichung der Zweckbestimmung einen pharmakologischen, metabolischen oder immunologischen Effekt eines Inhaltsstoffs nutzt, muss das Produkt als Arzneimittel zugelassen werden.
5. Abgrenzung mittels MDCG 2022-5
Die Koordinierungsgruppe Medizinprodukte hat in ihrem Leitfaden zur Abgrenzung von Medizinprodukten und Arzneimitteln bereits vor Verkündung des EuGH-Urteils klargestellt: Ein Produkt kann nicht als Medizinprodukt eingestuft werden, wenn nicht eindeutig nachgewiesen wird, dass seine bestimmungsgemäße Hauptwirkung nicht auf einer hauptsächlich pharmakologischen, immunologischen oder metabolischen Wirkweise basiert.
a) Die Hauptwirkungsweise entscheidet
Das entscheidende Kriterium für die Abgrenzung von stofflichen Medizinprodukten und Arzneimitteln ist die hauptsächliche Wirkungsweise eines Produkts zur Erfüllung seiner bestimmungsgemäßen Hauptwirkung.
Das MDCG-Dokument definiert die hauptsächliche Wirkungsweise (gemäß Artikel 1(6) b) MDR) als das Prinzip, mit dem das Produkt seine bestimmungsgemäße Hauptwirkung erzielt, d. h. pharmakologisch, immunologisch, metabolisch, physikalisch oder auf andere Art.
Diese Wirkung muss objektiv und auf dem neusten Stand der Wissenschaft nachgewiesen werden. Die Auslobungen des Herstellers für sein Produkt sind dabei irrelevant.
Das Guidance-Dokument MDCG 2022-5 erklärt jedoch nicht, wie diese Nachweise konkret aussehen können. Das stellt die Hersteller stofflicher Medizinprodukte vor nennenswerte Herausforderungen!
b) Pharmakologisch, metabolisch, immunologisch, physikalisch
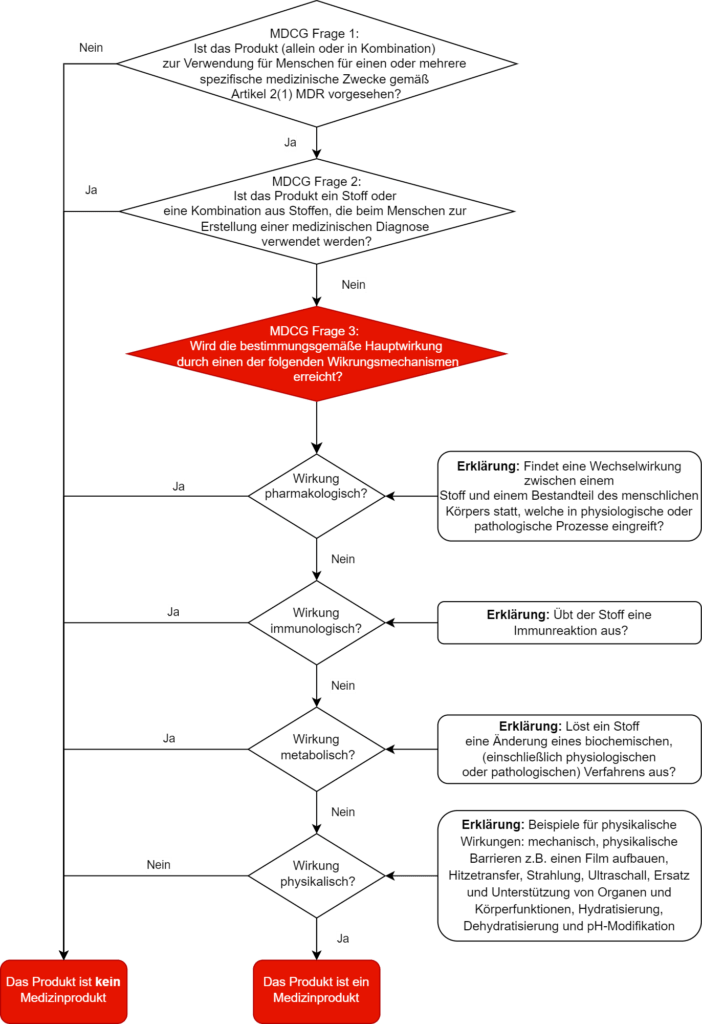
Immerhin: Die MDCG legt in diesem Zusammenhang im Abschnitt 1.2.2 dar, was sie unter ‚pharmakologisch‘, ‚immunologisch‘, ‚metabolisch‘ und auch ‚physikalisch‘ versteht, und nennt Beispiele.
Definitionen
| Definition | Erläuterung |
| ‘Pharmacological means’ is understood as an interaction typically at a molecular level between a substance or its metabolites and a constituent of the human body which results in initiation, enhancement, reduction or blockade of physiological functions or pathological processes | Eine pharmakologische Wirkung bedeutet eine typischerweise auf molekularer Ebene verstandene Interaktion zwischen einem Stoff oder seinen Metaboliten und einem Bestandteil des menschlichen Körpers, die zu einer Auslösung, Verstärkung, Verringerung oder Blockierung physiologischer Funktionen oder pathologischer Prozesse führt. |
| ‘Immunological means’ is understood as an action initiated by a substance or its metabolites on the human body and mediated or exerted (i.e. stimulation, modulation, blocking, replacement) by cells or molecules involved in the functioning of the immune system. | Eine immunologische Wirkung entspricht der Wirkung eines Stoffs oder seiner Metaboliten auf den menschlichen Körper, die durch Zellen oder Moleküle des Immunsystems (z. B. Lymphozyten, Toll-Like Rezeptoren, Zytokine …) vermittelt bzw. ausgeübt wird (z. B. Stimulation, Veränderung, Blockierung oder Ersatz durch beteiligte Zellen oder Moleküle des Immunsystems). |
| ‘Metabolic means’ is understood as an action of a substance or its metabolites which involves an alteration, including stopping, starting or changing the rate, extent or nature of a biochemical process, whether physiological or pathological, participating in, and available for, function of the human body. The term ‘biochemical processes’ is understood as reactions available for the human body including anabolic and catabolic reactions and transport of substances between compartments. An interaction with a known receptor is not a prerequisite for the metabolic means of action. | Eine metabolische Wirkung bezeichnet die Wirkung eines Stoffs oder seiner Metaboliten auf den Stoffwechsel oder biochemische Prozesse des menschlichen Körpers. Als biochemische Prozesse gelten körpereigene Reaktionen, einschließlich anabolen und katabolen Reaktionen sowie körpereigene Transportprozesse von Substanzen. |
Beispiele
Zu den Beispielen für physikalische Mittel, mit denen ein Produkt seine bestimmungsgemäße Hauptwirkung erreicht, gehören:
- Mechanische Einwirkung
- Physikalische Barrieren, z. B. einen Film aufbauen
- Wärmeübertragung
- Strahlung
- Ultraschall
- Ersatz und Unterstützung von Organen und Körperfunktionen
- Hydrierung bzw. Dehydrierung
- Veränderung des pH-Werts
c) Ein Entscheidungsbaum als Hilfestellung
Das MDCG-Dokument gibt den Herstellern einen Entscheidungsbaum zur korrekten Qualifizierung an die Hand. Wir haben diesen Entscheidungsbaum um die Definitionen zur pharmakologischen, immunologischen, metabolischen oder physikalischen Hauptwirkungsweise erweitert.
6. Hinweise für Hersteller
a) Qualifizierung und Klassifizierung in der Alltagspraxis
Mit Einführung von Regel 21 der MDR, Anhang VIII werden viele stoffliche Medizinprodukte, die unter der MDD regelmäßig in die Klasse I eingestuft worden sind, höher klassifiziert. Dadurch wird die Einbindung einer Benannten Stelle wird notwendig.
Bereits für die Antragstellung bei einer Benannten Stelle muss die Begründung zur Qualifizierung als Medizinprodukt vorgelegt werden.
Für die Qualifizierung als stoffliches Medizinprodukt ist der Wirkmechanismus ausschlaggebend.
Borderline-Produkte sind schwer abgrenzbar. Ohne hinreichend begründete Qualifizierung riskieren Hersteller eine Einordnung dieser Produkte durch die nationalen Gerichte und damit Verzögerungen bei der Inverkehrbringung.
b) Tipps
Tipp 1: Produkt frühzeitig qualifizieren und klassifizieren
Beginnen Sie rechtzeitig! Die Qualifizierung und Klassifizierung eines Produkts als (stoffliches) Medizinprodukt ist der erste Schritt. Erst dann sollten Sie sich mit der Sicherstellung der Konformität mit den Anforderungen der MDR befassen.
Beachten Sie bei der Qualifizierung von stofflichen Medizinprodukten u. a. die spezifischen Klassifizierungsregeln 3 und 21.
Zu spät erkannte Fehler bei der Qualifizierung und Klassifizierung können Zeit, Aufwand und Geld kosten. Zudem riskieren Sie rechtliche Auseinandersetzungen.
Wir unterstützen Sie mit einer Expertenmeinung bei der Qualifizierung Ihres Produkts und beim Sammeln und Dokumentieren der notwendigen Nachweise.
Tipp 2: Nachweisdokumente prüfen
Wenn Sie die bestimmungsgemäße Hauptwirkung Ihres Produkts kennen, sollten Sie die Wirkungsweisen der einzelnen Substanzen prüfen, die dazu beitragen. Nur Produkte mit ausschließlich physikalischen Hauptwirkungsweisen werden durch die MDR abgedeckt.
Stellen Sie sicher, dass Sie alle Nachweise haben, mit denen Sie die Wirkungsweisen belegen können. Für Medizinprodukte muss diese physikalisch sein.
Orientieren Sie sich an den Begriffsdefinitionen für die Hauptwirkungsweise im MDCG 2022-5.
7. Fazit
Obwohl das EuGH-Urteil vom Januar 2023 bei seinen Entscheidungen das MDCG-Dokument 2022-5 nicht berücksichtigte, bestätigte es die Anforderungen an die Abgrenzung zwischen Medizinprodukt und Arzneimittel.
Demnach ist das entscheidende Kriterium die hauptsächliche Wirkungsweise eines Produkts zur Erfüllung seiner bestimmungsgemäßen Hauptwirkung.
Die MDCG definiert, was sie unter pharmakologischen, immunologischen und metabolischen Wirkungsweisen versteht, und untermauert damit die Pflicht der Hersteller, diese Wirkungsweisen bei Medizinprodukten auszuschließen.
Um ein stoffliches Produkt als Medizinprodukt zu qualifizieren, muss zusätzlich die physikalische Wirkungsweise bestätigt werden. Erst dieser Nachweis verweist auf die Anwendbarkeit der MDR. Wie diese Nachweise für die Vielzahl an stofflichen Medizinprodukten am Markt konkret aussehen können, bleibt offen.
Dieser Beitrag wurde in Zusammenarbeit mit Alexander Müller erstellt.
Durch Einführung der Regel 21 werden viele stoffliche Medizinprodukte zukünftig höher klassifiziert, was die Einbindung einer Benannten Stelle zur Konformitätsbewertung notwendig macht. Diese wird bei Antragstellung prüfen, ob das Produkt ein Medizinprodukt gemäß Begriffsdefinition der MDR ist und korrekt klassifiziert ist.
Laut den Ergebnissen einer durch die Europäische Kommission durchgeführten Befragung der Benannten Stellen stellt die falsche Qualifizierung und Klassifizierung von Medizinprodukten den dritthäufigsten Grund für abgelehnte MDR-Anträge dar. Darüber hinaus bemängelten die Benannten Stellen explizit fehlende Nachweise einer nicht-pharmakologischen bzw. nicht-metabolischen Wirkungsweise von Inhaltsstoffen.
Wir möchten dazu Ihre Erfahrungen einholen, um uns ein Bild von der tatsächlichen Situation am Markt zu verschaffen. Sind Sie Hersteller von stofflichen Medizinprodukten? Dann freuen wir uns auf Ihr kurzes Feedback!
Änderungshistorie
- 2025-01-01: Interne Links ergänzt; Abschnitt 2 d) eingefügt; Nummerierung der Abbildungen angepasst
- 2023-10-04: Erste Version erstellt



