Diese Seite wendet sich an das Management, insbesondere Führungskräfte bei Medizinprodukteherstellern, Benannten Stellen, Behörden und Dienstleistern, die verantwortlich sind für die Bereiche Regulatory und Clinical Affairs, Qualitätsmanagement und Entwicklung.
Wichtige Aufgaben des Managements
Zu den Managementaufgaben dieser Führungskräfte zählen beispielsweise:
Informationsmanagement
Informationen von außen sammeln, überblicken und notwendige Maßnahmen ergreifen. Dazu zählen Informationen über
- regulatorische Änderungen,
- Markttrends (Technologien, Wettbewerber, Kunden) und
- die eigenen Produkte (Post-Market Surveillance)
Qualitätsmanagement und Strategie
Die eigenen Abteilungen besser aufstellen:
- Strategische Projekte (z.B. Digitalisierung, Outsourcing) initiieren
- Regulatorische Strategien festlegen
- Zur Verbesserung des QM-Systems beitragen (z.B. bei Management Reviews)
Ressourcenmanagement
Voraussetzungen für all dies schaffen:
- Dienstleister auswählen und Verträge verhandeln
- Budgets für die eigenen Abteilungen erstellen, sichern und überwachen
- Die Größe und Kompetenz der eigenen Expertenteams sicherstellen
Unterstützung des Managements
Viele Führungskräfte bauen auf die Unterstützung des Johner Instituts. Es nimmt dem Management Aufgaben ab oder unterstützt es dabei.
a) Outsourcing
Führungskräfte lagern regulatorische Tätigkeiten und Prozessen an das Johner Institut aus:
Hersteller lagern zudem Rollen aus wie QM-Beauftragte, EU-Bevollmächtigter oder verantwortliche Personen.
b) Beratung
Die Führungskräfte vertrauen auf die Beratung und die Meinung des Johner Instituts:
Für Executives sind die Standpunkte der beiden Gesellschafter des Johner Instituts relevant.
c) Software & digitale Transformation
Das Johner Institut unterstützt mittlere und große Hersteller bei der Digitalen Transformation regulatorischer Prozesse und des Qualitätsmanagements.
Seine Enterprise-Software unterstützt alle regulatorische Prozesse wie:
Nehmen Sie als Führungskraft gleich Kontakt auf. Sie erhalten schnelle, diskrete und kompetente Unterstützung.
Mit dem eStar-Programm möchte die FDA die Effizienz von Zulassungsverfahren (z. B. der 510(k)-Verfahren) durch Digitalisierung erhöhen. Bei der Weiterentwicklung von eStar arbeitet das Johner Institut mit der FDA zusammen. Wie zukunftsweisend dieser Ansatz ist und ob Sie daran teilnehmen sollten oder gar müssen, erfahren Sie in diesem Artikel.
Details
Die MDR legt in den Artikeln 120 bis 123 die Übergangsbestimmungen einschließlich der Übergangsfristen fest. Allerdings sind diese Übergangsbestimmungen und Übergangsfristen sehr komplex formuliert. Daher laufen die Hersteller Gefahr, sie falsch zu verstehen und regulatorische Anforderungen nicht zu erfüllen oder unnötige Aufwände zu betreiben. Ein Ablaufdiagramm in Kapitel 2 dieses Artikels fasst die regulatorischen Anforderungen…
Details
Bereits im Dezember 2021 hat die EU die Übergangsfristen der Verordnung 2017/746 über In-vitro-Diagnostika (IVDR) verlängert (Verordnung 2022/112). Im März 2023 hat die Europäische Kommission den Wegfall der „Abverkaufsfrist“ für IVD, die konform mit der Richtlinie 98/79/EG (IVDD) sind, beschlossen (Verordnung 2023/607). Im Januar 2024 hat die Europäische Kommission einen Vorschlag zur Änderung der IVDR…
Details
Am 14.09.2024 ist die neue Fassung der Gesundheits-Interoperabilitäts-Governance-Verordnung (oder IOP-Governance-Verordnung, kurz GIGV) in Kraft getreten. Einen Referentenentwurf, welcher die Erwägungsgründe enthält, hatte das Bundesgesundheitsministerium am 24. April des Jahres veröffentlicht. Damit ist die GIGV in der Fassung vom Oktober 2021 überholt. In diesem Artikel erfahren Sie, was die Verordnung fordert und ob Sie davon betroffen…
Details
Gesetzgeber ändern kontinuierlich die Regelwerke für Medizinprodukte. So ist das in Europa mit den EU-Verordnungen 2017/745 (MDR) und 2017/746 (IVDR) geschehen. Dadurch kommen Fragen zum Umgang mit Legacy Devices auf. Das sind Medizinprodukte, die Hersteller nach den alten Regelungen legal auf den Markt gebracht haben und weiterhin bringen, die aber gegebenenfalls die neuen Regelungen nicht…
Details
Die EU Datenschutzgrundverordnung (DSGVO) – auf englisch „General Data Protection Regulation“ (GDPR) – muss seit dem 25. Mai 2018 eingehalten werden. Nach mehr als 5 Jahren Praxiserfahrung haben sich viele Auslegungsfragen geklärt. Viele Firmen, darunter auch Medizinproduktehersteller und Betreiber wie Krankenhäuser, waren darauf nicht ausreichend vorbereitet. Dieser Beitrag verschafft einen Überblick über die wesentlichen Konzepte…
Details
Unternehmen müssen die digitale Transformation schnell und erfolgreich bewältigen. Das gilt auch für Medizinproduktehersteller. Denn ihre Zukunft hängt davon ab. Bei dieser Transformation begehen viele Unternehmen folgenreiche Fehler (s. 4. Abschnitt). Daher gibt dieser Fachartikel insbesondere Führungskräften einen schnellen Überblick über die Möglichkeiten der digitalen Transformation. Sie erhalten sieben Tipps, damit diese zum Erfolg wird.…
Details
Gesetze fordern das Risikomanagement im Krankenhaus, vor allem, um die Patientensicherheit zu verbessern. Dennoch tun sich viele Krankenhäuser damit schwer. Dieser Artikel stellt die wichtigsten regulatorischen Anforderungen vor und gibt Tipps zur Umsetzung.
Details
Der Medizintechnik-Markt ist zwar weniger volatil als andere Branchen, aber auch er steht vor einer Umwälzung, auf die nicht alle optimal vorbereitet sind. Wer die Trends in der Medizintechnik kennt, kann seine Karriere darauf einstellen und die Aus- und Weiterbildung daraufhin optimieren. Trends in der Medizintechnik a) Trends, auf die sich Mitarbeitende und Hersteller einstellen sollten In den letzten Jahren…
Details
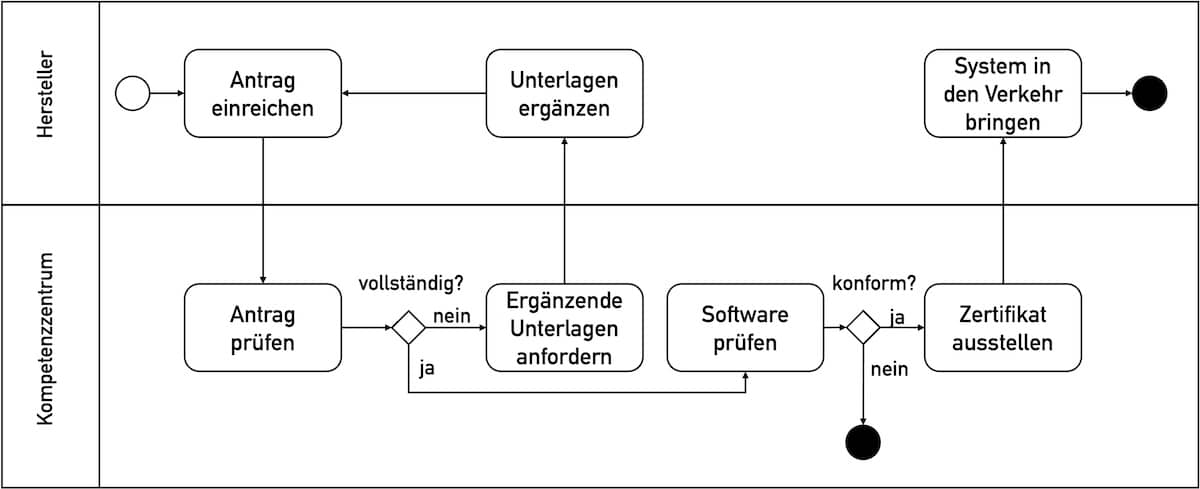
Die EU-Verordnungen stellen hohe Anforderungen an die sogenannte Inverkehrbringung von Medizinprodukten. Erfahren Sie in diesem Artikel, was diese Regularien unter einer Inverkehrbringung verstehen, welche Missverständnisse und Widersprüche Sie kennen müssen und welche Voraussetzung die Hersteller bzw. Produkte erfüllen müssen.
Details