Closed-Loop-Systeme bei Medizinprodukten
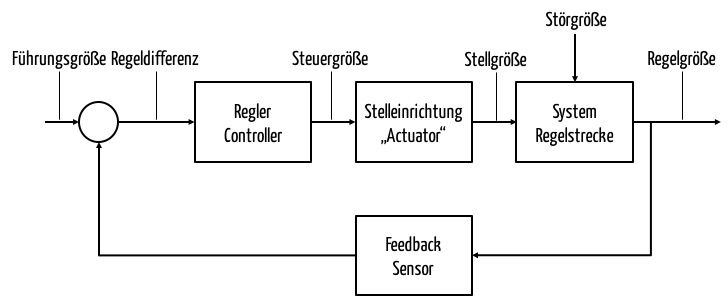
Medizinprodukte basieren zunehmend auf Closed-Loop-Systemen. Diese „geschlossenen Regelsysteme“ finden bereits in der Medizinprodukteverordnung MDR Erwähnung. Sie erfahren in diesem Artikel, was Closed-Loop-Systeme sind, wo sie in der Medizin zum Einsatz kommen und welche regulatorischen Anforderungen sie erfüllen müssen. Der Beitrag verrät Ihnen auch, wie Sie beim Kauf der Norm IEC 60601-1-10 einige Hundert Euro sparen…
Weiterlesen