Das Digitale-Versorgung-Gesetz (DVG) bietet Herstellern digitaler Medizinprodukte eine neue Möglichkeit, Geld zu verdienen.
Die Kostenerstattung soll schneller und einfacher erfolgen als herkömmliche Verfahren, z. B. die bisherige Aufnahme in den Hilfsmittelkatalog.
Das DVG ist ein Gesetz, das bestehende Gesetze (siehe unten) geändert hat. Mit dem DVPMG hat der Gesetzgeber eine weiteres solches Gesetz erlassen, das DiGA-Hesteller ebenfalls betrifft.
Ein weiterer Fachartikel beschreibt die 7 Schritte, mit denen Hersteller ihre Produkte in das DiGA-Verzeichnis bringen können und damit die Voraussetzung für die Kostenerstattung schaffen.
1. Was das Digitale-Versorgung-Gesetz erreichen möchte
Die Bundesregierung möchte mit dem Digitale-Versorgung-Gesetz mehrere Ziele erreichen:
- Digitalisierung und Innovation in Deutschland vorantreiben
Deutschland ist im internationalen Vergleich weit zurückgefallen: das betrifft die flächendeckende Breitbandversorgung ebenso wie den Marktanteil digitaler Anbieter und die Höhe von Fördertöpfen für Innovationsprojekte. Das DVG soll einen Beitrag leisten, um diesen Missstand zumindest etwas abzumildern. - Effizienz des Gesundheitssystems befördern
Auch nach Jahrzehnten gibt es noch keine durchgängige Telematikinfrastruktur. Weder die Leistungserbringer (Ärzte, Pflege) noch die Patienten nehmen flächendeckend daran teil, z. B. um Videosprechstunden durchzuführen, Rezepte zu erstellen bzw. zu erhalten, Leistungen abzurechnen oder gemeinsam auf Patientenakten zuzugreifen. - Güte des Gesundheitssystems verbessern und Daten für die Forschung erhalten
Die Verfügbarkeit von Daten ist für die Forschung und damit für den Fortschritt im Gesundheitswesen unverzichtbar. Diese Daten zu sammeln ist ebenso ein Ziel des DVGs wie die bessere Versorgung durch digitale Gesundheitsanwendungen (DiGA).
2. Was das Digitale-Versorgung-Gesetz regelt
Das Digitale-Versorgung-Gesetz DVG ist ein hundert Seiten umfassendes Gesetz, das bestehende Gesetze und Verordnungen ändert:
- Gesetzliche Krankenversicherung SGB V
- Bundespflegesatzverordnung BPflV
- Krankenhausentgeltgesetz KHEntgG
- Soziale Pflegeversicherung SGB XI
- Heilmittelwerbegesetz HWG
- Zweites Gesetz über die KLVG
- Risikostruktur-Ausgleichsverordnung RSAV
Diese Gesetze regeln künftig Folgendes:
- Anspruch auf die Erstattung digitaler Gesundheitsanwendungen (DiGA)
Die Versicherten haben innerhalb gewisser Grenzen und unter bestimmten Voraussetzungen Anspruch auf digitale Gesundheitsanwendungen, die die Kassen bezahlen müssen – genauso wie Krücken, Brillen und andere Hilfsmittel. Bisher konnten diese DiGA nicht in den Hilfsmittelkatalog aufgenommen werden.
Hersteller dieser digitalen Gesundheitsanwendungen müssen Voraussetzungen erfüllen, die dieser Artikel weiter unten beschreibt. - Vergütung von Telekonsilen
Die Krankenkassen müssen auch Telekonsilien in größerem Umfang vergüten. Die Voraussetzungen für die Videosprechstunden möchte das Gesetz (künftig) vereinfachen. - Zwang und Möglichkeit zur Teilnahme an der Telematikinfrastruktur
Den Apothekern und Krankenhäusern setzt das Gesetz eine Frist, um sich an die Telematikinfrastruktur anzuschließen. Zudem dürfen auch neue Gruppen von Leistungserbringern daran teilnehmen, z. B. Hebammen, Pflegeeinrichtungen und Physiotherapeuten. - Innovationsförderung
Die Krankenkassen dürfen digitale Innovationen wie digitale Medizinprodukte, telemedizinische Verfahren und IT-gestützte Verfahren in der Versorgung nicht nur fördern, sondern sogar entwickeln (lassen). Zudem wird in den Jahren 2020 bis 2024 ein Innovationsfond mit 200 Millionen Euro pro Jahr aufgesetzt. Neue Verfahren sollen helfen, die Ergebnisse in die Regelversorgung zu überführen. - Förderung der Forschung
Das DVG schafft die rechtlichen Grundlagen dafür, dass die Daten der Krankenkassen an ein Forschungsdatenzentrum weitergeleitet werden können. - Schließlich verpflichtet das Gesetz die Kassen, freiwillig Versicherte elektronisch beitreten zu lassen. Elektronische Arztbriefe fördert das Gesetz ebenfalls.
3. Was DiGAs sind
Vom Digitale-Versorgung-Gesetz profitieren diejenigen Medizinprodukte (vor allem hinsichtlich der Kostenerstattung), die laut MDR in die Klassen I und IIa fallen. In dem Entwurf vom 06.11.19 wurde dies sogar großzügiger formuliert:
Medizinprodukte mit niedriger Risikoklasse nach Absatz 1 Satz 1 sind solche, die der Risikoklasse I oder IIa nach Artikel 51 in Verbindung mit Anhang VIII der Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates vom 5. April 2017 über Medizinprodukte, zur Änderung der Richtlinie 2001/83/EG, der Verordnung (EG) Nr. 178/2002 und der Verordnung (EG) Nr. 1223/2009 und zur Aufhebung der Richtlinien 90/385/EWG und 93/42/EWG des Rates (ABl. L 117 vom 5.5.2017, S. 1; L 117 vom 3.5.2019, S. 9) zugeordnet und als solche bereits in den Verkehr gebracht sind, als Medizinprodukt der Risikoklasse IIa aufgrund der Übergangsbestimmungen in Artikel 120 Absatz 3 oder Absatz 4 der Verordnung (EU) 2017/745 in Verkehr gebracht wurden oder als Medizinprodukt der Risikoklasse I aufgrund unionsrechtlicher Vorschriften zunächst verkehrsfähig bleiben und im Verkehr sind.
DVG, Artikel Absatz 2.
Demnach kann auch ein Medizinprodukt der Klasse I nach MDD zu einer DiGA werden.
Zudem muss die Hauptfunktion dieser Produkte „wesentlich auf digitalen Technologien beruhen […] die dazu bestimmt sind, bei den Versicherten oder in der Versorgung durch Leistungserbringer die Erkennung, Überwachung, Behandlung oder Linderung von Krankheiten oder die Erkennung, Behandlung, Linderung oder Kompensierung von Verletzungen oder Behinderungen zu unterstützen (digitale Gesundheitsanwendungen)“.
Schließlich müssen die Produkte – um erstattet werden zu können – durch einen behandelnden Arzt, einen Psychotherapeuten oder ein Krankenhaus verordnet oder mit Genehmigung einer Krankenhasse verwendet werden. Es würde also nicht ausreichen, wenn sich ein Patient eine App herunterlädt und die Rechnung bei der Krankenkasse einreicht.
Für die Genehmigung durch die Krankenkasse muss auch das Vorliegen der medizinischen Indikation nachgewiesen werden, für die die digitale Gesundheitsanwendung bestimmt ist. Das heißt, dass eine Diagnose vorliegen muss.
Im Schlagwortartikel zu den DiGA finden Sie Beispiele (und Gegenbeispiele) für DiGA.
4. Welche Voraussetzungen die Hersteller erfüllen müssen
a) Produkt als Medizinprodukt „zertifizieren“
Zuerst verpflichtet das SGB V die Hersteller, ihre Produkte als Medizinprodukte der Klasse I bzw. IIa zu „zertifizieren“, d. h. die Konformität zu erklären. Bei Produkten der Klasse IIa müssen diese bekanntermaßen eine Benannte Stelle einbeziehen.
Mit dieser „Zertifizierung“ dürfte das Produkt auch den „Anforderungen an Sicherheit, Funktionstauglichkeit und Qualität des Medizinproduktes“ entsprechen. Ebenfalls sollten damit die Anforderungen nach einer Datensicherheit nach Stand der Technik erfüllt sein. Denn genau diese Forderung stellt bereits die MDR.
Nutzen Sie den Leitfaden zur IT-Sicherheit des Johner Instituts, den in abgewandelter Form auch die Benannten Stellen bei Audits und Reviews verwenden.
b) Anforderungen an Datenschutz und Datensicherheit erfüllen
Im Januar bzw. Juli 2024 müssen die Hersteller eine Zertifizierung für den Datenschutz und die Datensicherheit vorlegen können.
Beachten Sie den Artikel zu Datenschutz und Datensicherheit bei DiGA.
c) Anforderungen an die Interoperabilität erfüllen
Ferner muss eine DiGA noch die Voraussetzung der Interoperabilität erfüllen. Die DiGA sollte mit den gängigen Interoperabilitätsformaten zumindest adaptierbar sein.
d) „Positive Versorgungaspekte“ nachweisen
Schließlich hat der Hersteller Nachweise positiver Verordnungsaspekte zu erbringen. Der klinischen Bewertung kommt folglich eine besondere Bedeutung zu, denn darin muss der Hersteller den klinischen Nutzen nachweisen. Es ist jedoch zu befürchten, dass diese klinische Bewertung regelmäßig nicht ausreicht. Dazu gleich mehr.
Das DVG zielt nur auf positive Versorgungsaspekte, die einen direkten Patientenbezug haben. Medizinprodukte, die nur der Reduktion der Arbeitslast oder der Verbesserung der Ökonomie dienen, zählen nicht als DiGA.
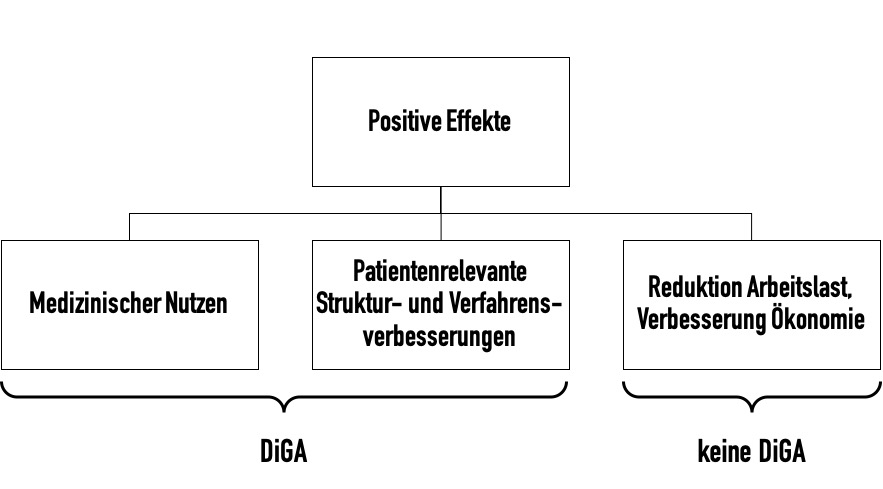
Das BfArM unterscheidet Produkte mit
- medizinischem Nutzen,
- patientenrelvanten Struktur- und Verfahrensverbesserungen sowie
- sonstigem ökonomischem Nutzen.
Medizinischer Nutzen
Ein medizinischer Nutzen wird in den folgenden Fällen angenommen:
- Verbesserung des Gesundheitszustands
- Verkürzung der Krankheitsdauer
- Verlängerung des Überlebens
- Verbesserung der Lebensqualität
Das BfArM schreibt dazu in seinem Leitfaden:
Wer einen medizinischen Nutzen für eine DiGA reklamiert, muss zeigen, dass patientenrelevante Endpunkte, insbesondere Morbidität, Mortalität oder Lebensqualität, positiv beeinflusst werden.
DiGA-Leitfaden des BfArM
Patientenrelevante Struktur- und Verfahrensverbesserungen
Auch Medizinprodukte, die nicht direkt den Gesundheitszustand verbessern, aber dennoch den Patienten eine bessere Versorgung ermöglichen, zählen zu den DiGAs. Die DiGAV bzw. das BfArM nennen die folgenden Punkte:
- Koordination der Behandlungsabläufe
- Ausrichtung der Behandlung an Leitlinien und anerkannten Standards
- Adhärenz
- Erleichterung des Zugangs zur Versorgung
- Patientensicherheit
- Gesundheitskompetenz
- Patientensouveränität
- Bewältigung krankheitsbedingter Schwierigkeiten im Alltag
- Reduzierung der therapiebedingten Aufwände und Belastungen der Patienten und ihrer Angehörigen
Der DiGA-Leitfaden des BfArM erläutert diese Punkte ausführlich.
Letztlich wirken sich auch diese Ziele zumindest indirekt positiv auf den Gesundheitszustand von Menschen aus, haben also zumindest indirekt einen medizinischen Nutzen.
Das BfArM betont, dass sowohl der medizinische Nutzen als auch die positiven Versorgungseffekte konsistent sein müssen mit
- „der Zweckbestimmung nach Medizinprodukterecht,
- den Funktionen der DiGA,
- den Inhalten der DiGA,
- den vom Hersteller veröffentlichten Aussagen zur DiGA, beispielsweise in Werbeaussagen und Vertriebsmaterial“.
5. Antragsprozess
a) Übersicht
Den Weg zum erstattungsfähigen Medizinprodukt möchte das Digitale-Versorgung-Gesetz verkürzen. Dennoch umfasst er mehrere Schritte und Beteiligte:
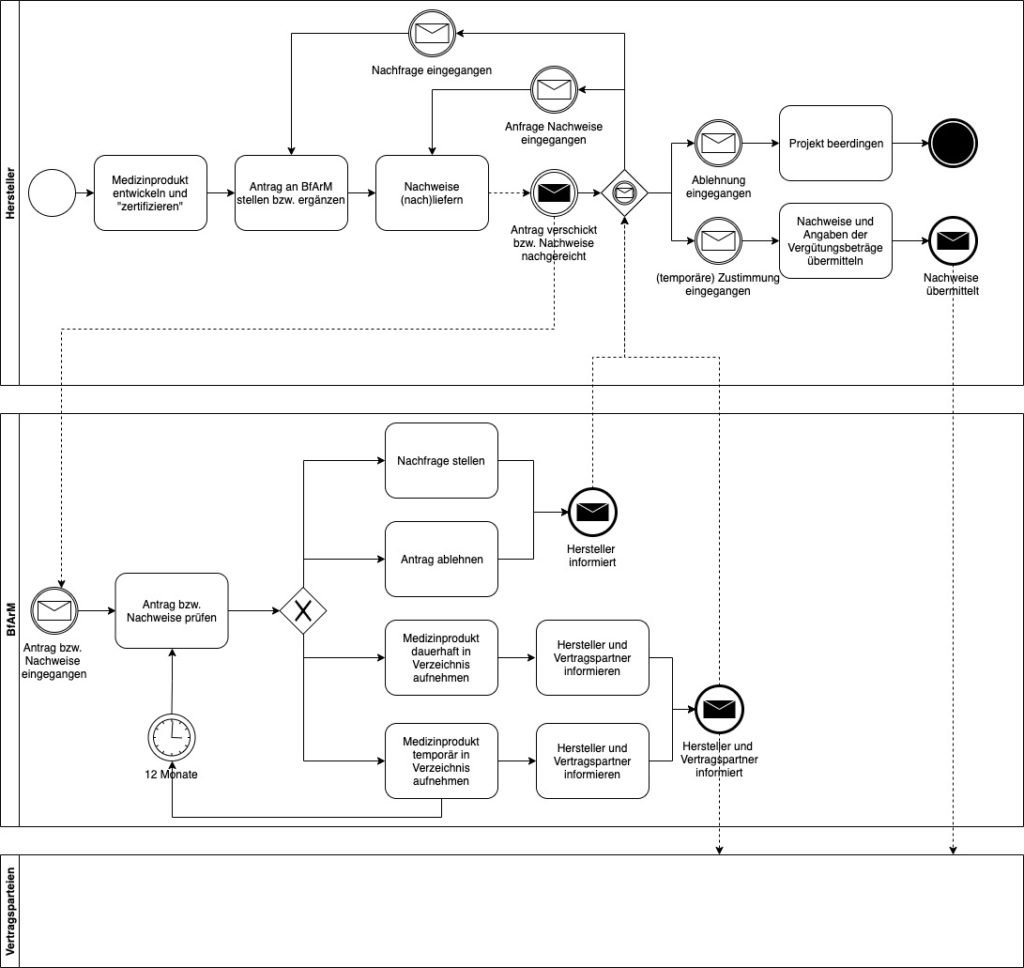
Das BfArM hat eine vereinfachte Form dieses Prozesses in seinem Leitfaden publiziert:
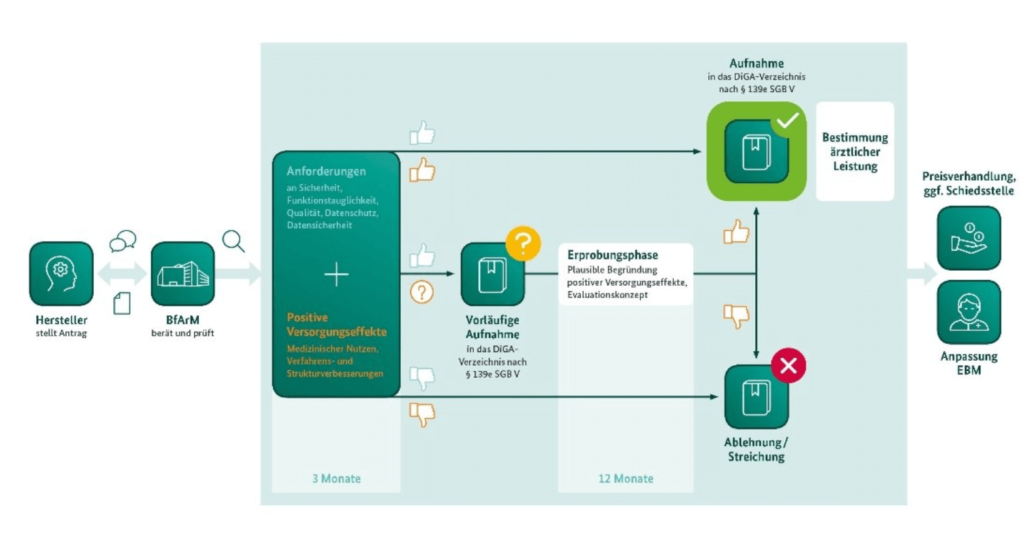
b) Antragstellung
Als nächster Schritt muss der Hersteller beim Bundesinstitut für Arzneimittel und Medizinprodukte BfArM die Aufnahme des Produkts in das „Verzeichnis erstattungsfähiger digitaler Gesundheitsanwendungen nach § 33a“ elektronisch beantragen.
c) Auf die Entscheidung des BfArMs warten
Das DVG bzw. der §139e des SGB V verpflichtet das BfArM, innerhalb von drei Monaten zu entscheiden. Die Bearbeitung muss folgende Fragen beantworten:
- Sind die Unterlagen ausreichend, um eine Entscheidung fällen zu können?
- Ist der Nachweis positiver Versorgungsaspekte erbracht?
- Welche ärztlichen Leistungen sind im Kontext des Produkts erforderlich?
- Wird das Produkt nicht, nur probeweise oder gar dauerhaft in das Verzeichnis aufgenommen?
Wenn der Hersteller die positiven Versorgungsaspekte nicht (ausreichend) nachweisen kann, kann er eine probeweise Aufnahme des Produkts in das Verzeichnis für ein Jahr beantragen. Das BfArM bestimmt dann die erforderlichen Nachweise und die dazu notwendigen ärztlichen Leistungen.
Neben dem Patientennutzen kommen auch Verfahrens- und Strukturverbesserungen als positive Versorgungseffekte in Betracht. Damit ist die Prüfung mit der Prüfung des klinischen Nutzens oft nicht vergleichbar.
Falls es dem Hersteller innerhalb dieser 12 Monate nicht gelingt, diese Nachweise zu erbringen, der Nachweis aber wahrscheinlich gelingen wird, dann kann das BfArM dem Hersteller eine Fristverlängerung von bis zu 12 Monaten gewähren.
d) Vertragspartner informieren
Die Hersteller informieren die Krankenkassen über deren Spitzenverband bzw. den Gemeinsamen Bundesausschuss über die Nachweise sowie über die Vergütungsbeträge, die sie von Selbstzahlern bzw. in anderen europäischen Staaten verlangen.
e) Produkt verfügbar machen
Die Hersteller müssen die digitale Anwendung „über öffentlich zugängliche Netze oder auf maschinell lesbaren Datenträgern zur Verfügung“ stellen. Das wäre bei einem App-Store oder bei einem Download der Fall. Es steht aber nirgends, dass die Downloads öffentlich verfügbar sein müssen. Einer Paywall widerspricht das Gesetz nicht.
Man geht nicht davon aus, dass das „Verfügbarmachen“ in App-Stores erfolgt, da Apple u. a. dafür Geld verlangen. Das wollen die Krankenkassen nicht bezahlen. Deshalb werden webbasierte Download-Möglichkeiten besprochen.
f) Änderungen am Produkt melden
Wenn ein Hersteller sein Produkt ändert, muss er das BfArM informieren. Andernfalls drohen bis zu 100.000 Euro „Zwangsgeld“.
„Kommt der Hersteller der Aufforderung zur Anzeige wesentlicher Veränderungen nicht innerhalb der gesetzten Frist nach nach, kann das Bundesinstitut für Arzneimittel und Medizinprodukte die digitale Gesundheitsanwendung aus dem Verzeichnis streichen.“
6. Wie viel Geld die Hersteller verdienen
a) Höhe der Vergütungen noch unklar
Bevor es ans Geldverdienen geht, haben die Hersteller zuerst die Kosten für das Verwaltungsverfahren zu bezahlen. Deren Höhe wird eine künftige nationale Verordnung regeln.
Wie hoch diese Vergütungsbeiträge ausfallen, sollen die Hersteller mit dem Spitzenverband aushandeln. §134 des SGB V legt dazu fest:
Der Spitzenverband Bund der Krankenkassen vereinbart mit den Herstellern digitaler Gesundheitsanwendungen mit Wirkung für alle Krankenkassen Vergütungsbeträge für digitale Gesundheitsanwendungen. Die Vergütungsbeträge gelten nach dem ersten Jahr nach Aufnahme der jeweiligen digitalen Gesundheitsanwendung in das Verzeichnis für digitale Gesundheitsanwendungen nach § 139e.
§134 des SGB V
Die Höhe dieser Vergütung scheint sich an den Beträgen zu orientieren, die der Hersteller von Selbstzahlern und in anderen europäischen Ländern verlangen würde.
Falls sich der Hersteller und der Spitzenverband nicht einigen, wird eine Schiedsstelle entscheiden. „Sie besteht aus einem unparteiischen Vorsitzenden und zwei weiteren unparteiischen Mitgliedern sowie aus jeweils zwei Vertretern der Krankenkassen und der Hersteller digitaler Gesundheitsanwendungen.“
Es gibt noch spezielle Vorschriften für Erstattung von Präventionen, z. B. § 20 V SGB V oder auch Reha-Leistung. § 20 SGB V ist relevant, da die Apps zur Prävention nicht unter der Definition der DiGA fallen. Zudem besteht die Möglichkeit der Anerkennung als Satzungsleistung ( § 11 SGB V), die in der Praxis oft genutzt wird.
b) Alternative Erstattungsformen
Falls das BfArM die Aufnahme in das Verzeichnis ablehnt, bleiben dem Hersteller die bisherigen Wege offen:
- Selektivverträge mit gesetzlichen Krankenversicherungen abschließen
- Direkter Verkauf im ambulanten Bereich bzw. Verfahren nach § 135 SGB V. Das betrifft auch die speziellen Regelungen zu Hilfsmitteln, Verbandmitteln und IVD.
- Verkauf an Krankenhäuser. Diese können die Produkte über die DRGs refinanzieren oder über weitere Verfahren nach § 137c SGB V, z. B. über das NUB-Verfahren oder das Verfahren nach § 137h SGB V.
NUB steht für „Neue Untersuchungs- und Behandlungsmethoden“. - Schließlich können Hersteller sogenannte „Erprobungsverfahren“ beantragen (s. §§ 135, 137c, 137e und 137h SGB V).
7. Daten & Datenschutz
Viele denken beim Digitale-Versorgung-Gesetz nur an Apps. Das Gesetz regelt aber auch, wie die Versichertendaten der Krankenkassen zur Verfügung gestellt werden müssen.
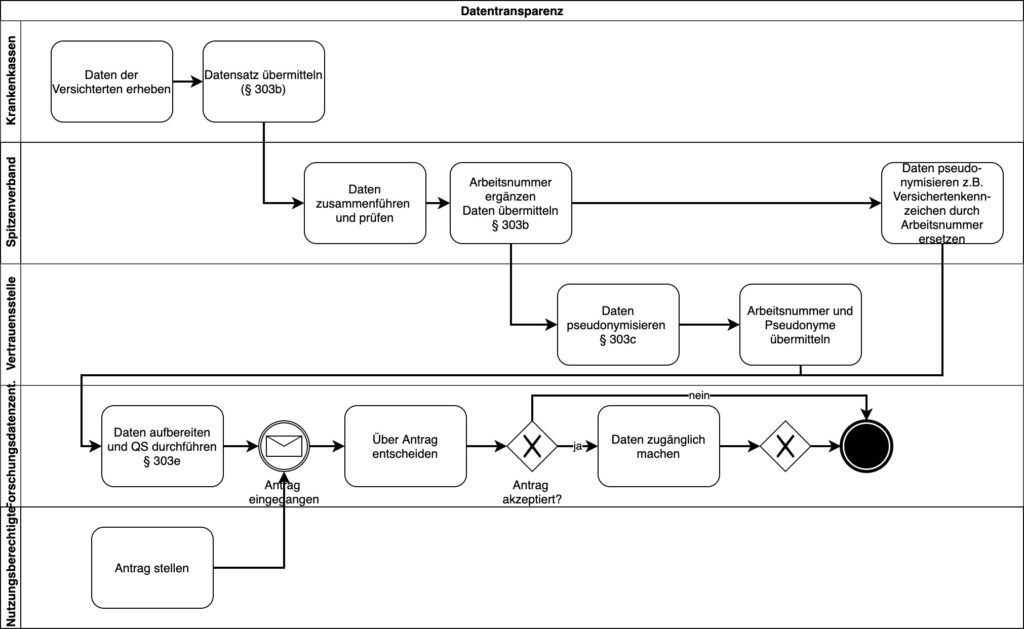
Diese Daten müssen die Krankenkassen an ihrenSpitzenverband übermitteln. Dieser pseudonymisiert die Daten und leitet diese an eine „Vertrauensstelle“ und ein „Forschungsdatenzentrum“ weiter. Letzteres enscheidet über Anträge von Berechtigten wie Krankenkassen, Universitäten und vielen mehr (siehe § 303e SBB V).
Lesen Sie hier mehr zum Thema Pseudonymisierung und Anonymisierung und möglichen Problemen. Beachten Sie auch den Artikel zur Datensicherheit und dem Datenschutz bei DiGA.
8. Fazit, Zusammenfassung, Kritik
a) Es konnte so nicht weiter gehen
Wie bei allen Gesundheitssystemen geht es auch beim deutschen um viel Geld. Da überrascht es nicht, wenn dieses Gesundheitssystem manchmal wie eine Schlangengrube wirkt, in der Partikularinteressen dazu führen, dass jeder Fortschritt im Keim erstickt wird. Der Status quo scheint diesen Eindruck zu erwecken:
- Peinliches technologische Niveau
Auch nach Jahrzehnten kann Deutschland von einer durchgängigen Telematik-Infrastruktur wie in anderen Ländern nur träumen. Nach wie vor ist das Fax Stand der Technik und wird entsprechend vergütet. - Mangelnde Datenverfügbarkeit blockiert medizinischen Fortschritt
Der Datenschutz und die mangelnde Vernetzung der Beteiligten tragen dazu bei, dass wertvolle Daten ungenutzt in Silos liegen. Die Forschung profitiert nicht von diesen Daten. Selbst wenn es neue Ergebnisse gibt, dauert es Jahre, bis diese Ergebnisse in die Routine Einzug halten. - Bürokratie behindert Fortschritt und Gesundheitsversorgung
Junge Firmen haben es sehr schwer, sich zu etablieren. Die Erstattung eines neuen Produkts oder eines neuen Verfahrens dauert meist Jahre und damit länger, als viele Startups überleben können. Diese Produkte fehlen in der Gesundheitsversorgung.
Vor diesem Hintergrund ist es verständlich, ja sogar zu begrüßen, dass der Staat mit dem Digitale-Versorgung-Gesetz versucht, diese Blockaden aufzubrechen.
b) Wie das DVG nützen kann
Beim Digitale-Versorgung-Gesetz geht es um weit mehr als nur um Medical Apps. Vielmehr verfolgt das DVG das Ziel, die Gesundheitsversorgung durch eine bessere Digitalisierung zu fördern. Dazu wendet das Gesetz Zwang an. Beispielsweise verpflichtet es Vertragsärzte und Krankenhäuser, sich an die Telematikinfrastruktur anschließen zu lassen.
Andere Leistungserbringer wie Hebammen, Physiotherapeuten und Pflegeeinrichtungen bekommen nun die Möglichkeit, dies auch zu tun. Das wird der Vernetzung der am Gesundheitswesen Beteiligten dienlich sein.
Für Startups wird das DVG einen Push bedeuten, vielleicht aber auch nur ein Strohfeuer. Ihnen können jetzt die Krankenkassen zu übermächtigen Konkurrenten werden, denn das Gesetz berechtigt jene, Medizinprodukte selbst entwickeln zu lassen.
c) Staatliche Übermacht?
Die Entschlossenheit des Staates scheint dazu zu führen, dass sich der Staat mehr Rechte nimmt und auch halbstaatlichen Organisationen wie den Krankenversicherungen mehr Rechte einräumt:
- Das BfArM bewertet die Sicherheit, nachdem dies die Benannten Stellen für Klasse-IIa-Produkte bereits getan haben.
- Auch soll das BfArM den Nutzen – das Gesetz spricht von „positiven Versorgungsaspekten“ – prüfen, nachdem die Benannten Stellen für Klasse-IIa-Produkte bereits den klinischen Nutzen geprüft haben.
- Das BfArM soll künftig über erforderliche ärztliche Leistungen entscheiden. Wäre diese Aufgabe nicht besser bei den ärztlichen Vertretern aufgehoben?
- „Die Kassenärztlichen Bundesvereinigungen können Anbieter im Einvernehmen mit dem Bundesamt für Sicherheit in der Informationstechnik zertifizieren“. Wohlgemerkt die Kassenärztlichen Bundesvereinbarungen, nicht die DaKKs.
- Die Vertrauensstellen und das Forschungsdatenzentrum sind öffentliche Stellen des Bundes, die ohne (!) Zustimmung des Bundesrates durch die Regierung bestimmt werden. Sie unterliegen der Rechtsaufsicht des Bundes. Der Bund kontrolliert sich also selbst?!
Eine Machtkonzentration hat den Vorteil, Entscheidungen schnell herbeiführen und effizient handeln zu können. Sie birgt aber auch die Gefahr des Missbrauchs. Vor allem darf der Datenschutz nicht (wie bisher) als Killerargument missbraucht werden, um jeden Fortschritt im Keim zu ersticken.
Doch wie würde es in Deutschland kommentiert, wenn Russland oder China von sämtlichen Bürgern besonders schützenswerte Daten wie Diagnosen, Behandlungen, Vitalstatus und Medikamente sowie Wohnort, Geschlecht, abrechenbare Leistungen, Versichertenstatus usw. systematisch in einer Datenbank erfassten?
d) Weitere Kritik
Natürlich gibt es weitere Kritik. So werden die den Krankenhäusern entstehenden Kosten von initial 400 Millionen Euro zum Anschluss an die Telematikinfrastruktur bemängelt. Die Klagen zielen oft in die Richtung, dass der Staat neue Pflichten auflege, aber nicht für die Kosten aufkomme.
Ebenfalls wird bemängelt, dass das DVG nur Medizinprodukte berücksichtigt, die unter die MDR fallen, aber nicht unter die IVDR.
e) Fazit
Jede Initiative, die die Digitalisierung in Deutschland vorantreiben will, ist zu begrüßen.
Es bleiben jedoch wesentliche Fragen offen:
- Weshalb beschränkt man das Digitale-Versorgung-Gesetz auf Produkte der Klassen I und IIa, wenn die MDR dazu führt, dass digitale Anwendungen eher in höhere Klassen fallen? Geht es um die Verbesserung des Gesundheitswesens oder eher um eine sichtbare Förderung der Digitalisierung?
- Wie lässt sich eine wirksame Kontrolle des Datenschutzes etablieren? Dass bei der größten und sensibelsten aller Datensammlungen der Bund den Bund kontrolliert, stimmt nachdenklich.
- Wie kann man vermeiden, dass die Hersteller den Nutzen, die Leistungsfähigkeit und die Sicherheit nicht redundant (bei der Benannten Stelle und dem BfArM) nachweisen müssen?
- Kann das BfArM die erforderlichen Kompetenzen und Kapazitäten in ausreichender Menge, Güte und Geschwindigkeit aufbauen?
- Wie unterscheiden sich die Anforderungen an den Nachweis des Nutzens von den Anforderungen an den Nachweis der „positiven Versorgungsaspekte“?
- Wird es den Medizinprodukteherstellern in ausreichender Anzahl gelingen, diese Nachweise auch zu führen?
- Wird das Gesundheitssystem wirklich von diesen Produkten profitieren oder sind die Medical Apps nur ein Modetrend, der bald das Interesse der Versicherten verliert?
- Werden die Vergütungssätze einerseits so hoch sein, dass sich für Medizinprodukthersteller die Entwicklung von Innovationen lohnt, und anderseits so niedrig, dass sie die Kassen nicht überfordern? Letztlich bezahlen die Versicherten und Bürger die Rechnung.
- Welche Medizinproduktehersteller werden langfristig profitieren? Sind es wirklich die innovativen Startups? Oder werden vorwiegend große Konzerne diese neuen Vergütungsformen nutzen?
Wir werden es hoffentlich bald erfahren. Das Digitale-Versorgung-Gesetz ist abgesehen von der Datenschutzthematik „good enought to try“. Und die Version 2.0 des DVG kommt gewiss bald.
Mit Dank an Sonia Seubert für wichtige Ergänzungen und fürs Gegenlesen.
Änderungshistorie
- 2023-01-27: Artikel aktualisiert, Verweise auf andere Artikel ergänzt
- 2022-08: Die Ausführungen zur Digitale-Versorgungsanwendungen-Verordnung haben wir gelöscht und dafür einen neuen Artikel zur DiGAV ergänzt.




Es bleibt zu befürchten, dass es nur wenige Gesundheitsapps zum Patienten schaffen werden.
Die Preisgestaltung für Gesundheitsapps würde unter den folgenden Annahmen ergeben:
1) Kosten für den Appstore (30%) werden nicht ersetzt
2) zusätzlich Vergütungsbeitrag (angenommen in Höhe der Kosten des Appstores (30%))
Damit würde sich der Preis der Gesundheitsapp um 75% erhöhen, wenn die App weiterhin den gleichen Nettoumsatz erbringen und über den Appstore vertrieben werden würde.
Alternativ stellt die Krankenkasse eine eigene Appstore Infrastruktur zur Verfügung und erhebt die gleichen Kosten iHv. 30%. Dann bliebe der Preis gleich.
Diskussion!
Interessant Diskussion. Ich befürchte aber, dass es kaum realistisch ist, dass Apothekenverband/Krankenkassen etc einen eigenen Appstore betreiben. Es wären zumindest nicht die ersten die probieren einen eigenen Store zu betreiben und viele sind dabei gescheitert. Hier müssen wir in Europa einfach akzeptieren, dass der Zug abgefahren ist…
Ich sehe hingegen eine nationale IHE/eHealth Infrastruktur welche den Datenschutz gewährleistet als sinnvoll welche Schnittstelle zur Verfügung stellt welche auch einen schnelle Einstieg für Entwickler ermöglicht. Hier wäre das Geld sinnvoller investiert.
Was die Kosten betrifft: Ehrlich gesagt wäre das verkraftbar (also AppStore und Vergütungsbeitrag) für Entwickler/Betreiber als auch für Krankenkassen.
Danke für die Diskussion.
Obwohl ganz überwiegend vieles sinnvoll und erfreulich konkret geregelt ist, drohen ein paar wenig beachtete Detailanforderungen der DiGAV das DVG zum Rohrkrepierer werden zu lassen:
Anwendungen zu Telemedizin oder Live-Datenübertragung erfordern eine stabile Internetverbindung. Ist die nicht gegeben, kann man die Anwendung einfach nicht für den vorgesehenen Zweck (an dem Ort/Zeitpunkt) nutzen. Dennoch wird eine eingeschränkte Nutzbarkeit der Anwendung ohne Internet gefordert. Eine rein webbasierte Anwendung (die im Full-Screen Modus auf Endgeräten durch „normale“ Patienten nicht von einer native App unterschieden werden kann) scheidet damit aus. Google und Apple freuen sich über den damit verbundenen unnötigen Aufschlag zur Ausgabe einer native-App über ihren jeweiligen Store, Hauptsache eine – in den genannten Beispielen wenig sinnvolle – Nutzbarkeit ohne Internet kann dargestellt kann.
Zwang zur zwei-Faktor-Authentifizierung, mindestens erstmalig. Wer von den meist ü65 Patienten, die einfach die bei weitem größte Gruppe der Patienten darstellen, hat heute den Microsoft oder Google Authenticator, eine RFID Smartcard und OpenID, die Pin zu seinem Personalausweis oder einen FIDO2-Token? Solange die Versichertenkarte nicht per RFID (auch bei den Privaten!) verfügbar ist, ist das eine massive „Einstiegshürde“, so sinnvoll sie technisch auch sein mag.
Vielen Dank für den sehr informativen Artikel!
„Hingegen war es zu erwarten, dass der Datenschutz eine große Rolle spielte. Die Pannen zweier App-Hersteller haben das Vertrauen massiv beeinträchtigt. Zumindest dienen diese Pannen als Anlass für neue und teilweise absurde Anforderungen. Die beiden Firmen haben damit allen Herstellern sehr geschadet.“
Da fragt man sich doch zu Recht als Nutzer, ob die „Regulierung“ und Qualitätskontrolle in der Tat ausreichend war bisher!?
Danke Vivy und danke Ada Health!
Sehr geehrter Herr Prof. Johner,
liebes Team,
in diesem Blogbeitrag führen Sie als Beispiel FÜR eine DiGA unter Punkt 3 c) „Ärztliche Video-Sprechstunde für Patienten“ auf. Ich wurde kurz stutzig, weil gerade die reinen Kommunikationsplattform nach der MDD/ dem MPG bislang nicht als Medizinprodukte einzustufen waren und m.E. auch fortan nicht nach der MDR eingestuft werden.
In dem neuen DiGA-Leitfaden des BfArM wird ebenso beschrieben, dass keine DiGA vorliegt, wenn die Hauptfunktion der Anwendung lediglich in der Digitalisierung des Kommunikationsweges liegt (S. 15).
Könnten Sie bei Gelegenheit kurz ausführen, wann nach Ihrer Auffassung ein Medizinprodukt und damit eine potentielle DiGA für eine telemedizinische Anwendungen vorliegt?
Vielen Dank und liebe Grüße aus Hamburg,
RA Friedrich Gottberg
Sehr geehrter Herr Gottberg,
Sie haben absolut Recht, dass eine reine Kommunikationsplattform kein Medizinprodukt und damit keine DiGA ist. Das ergibt sich auch aus MDCG 2019-11.
Wenn eine App aber explizit als Videosprechstunde dienen würde, z.B. um darüber zu diagnostizieren, wäre das etwas anderes.
Der entsprechende Aufzählungspunkt war missverständlich. Dank Ihrer Hilfe konnte ich das gleich präzisieren.
Vielen Dank dafür!
Herzliche Grüße, Christian Johner
Wieder ein toller Beitrag – vielen Dank. Wie ist es mit Software, die nur der Arzt verwendet? Zum Beispiel Tools zur Diagnose? Sind diese vom DVG ausgeschlossen, weil der Patient kein Anwender ist?
Wenn die Patienten keinen Zugang zu der Anwendung haben, sind es keine digitalen Gesundheitsanwendungen. Das Gesetz sagt:
Allerdings regelt das DVG auch „Förderung der Entwicklung digitaler Innovationen durch Krankenkassen“. Diese Innovationen müssen nicht zwingend direkt vom Patienten genutzt werden.
D.h. die Antwort auf Ihre Frage hängt davon ab, von welchen Produkten Sie sprechen.
viele Grüße, Christian Johner
Sehr geehrter Herr Prof. Johner,
liebes Team,
Sie erwähnen auch in Ihrem Beitrag die Frage, ob das BfArM die genügenden Kapazitäten, um die DiGA-Anträge bearbeiten zu können, hat. Kann man irgendwo eine Statistik nachsehen, wo gezeigt wird, wie viele Anträge tatsächlich zurückliegen aufgrund von fehlender Kapazitäten. Wie regelt das BfArM momentan das Einhergehen von übermäßigen Anträgen für die Zulassung einer DiGA.
Für die Zertifizierung durch Benannte Stellen nach MDR ist es ja bekannt, dass hier die Anzahl an Kapazitäten gering ist. Kann man zudem hier auch eine Verbindung zwischen Benannte Stellen und BfArM ziehen? Bspw. Dadurch, dass die Benannten Stellen hinten nach stehen mit der CE-Zertifizierung, verzögert sich ebenso die Antragsstellung beim BfArM.
Vielen Dank für Ihre Antwort auf die Fragen und beste Grüße
Katarina
Sehr geehrte Katarina,
danke für Ihre Frage!
Mir sind keine Angabe bekannt, ob es beim BfArM derzeit einen Engpass gibt. Ich weiß aber, dass das BfArM die Anträge nicht rein sequenziell bearbeitet. Es ist also nicht so, dass ein neues Verfahren erst angegangen wird, wenn ein anderes abgeschlossen wurde. Sehr oft hängt es auch an den Herstellern, noch zusätzliche Informationen nachzureichen.
Eine Verbindung zwischen BfArM und Benannten Stellen kann man nicht ziehen. Das eine ist eine Behörde, das andere sind privatwirtschaftlich arbeitende Unternehmen. Wenn jedoch ein Produkt bei der Benannten Stelle nicht in der gewünschten Zeit durchkommt, dann ist damit auch die Listung beim BfArM blockiert.
Geben Sie Bescheid, wenn Sie bei Ihrer Benannten Stelle nicht weiterkommen sollten. Manchmal kann ich mit Ansprechpartnern weiterhelfen.
Herzliche Grüße!
„Wie unterscheiden sich die Anforderungen an den Nachweis des Nutzens von den Anforderungen an den Nachweis der „positiven Versorgungsaspekte“?“
– Können Sie mir bitte diesen Aspekt erklären.
Guten Tag, liebe Mia,
Positive Versorgungseffekte können in zwei große Gruppen eingeteilt werden:
den medizinischen Nutzen
die patientenrelevanten Struktur- und Verfahrensverbesserungen.
Der mediznische Nutzen muss auch bereits im Rahmen der Klinischen Bewertung für das Medizinprodukt nachgewiesen werden. Für medizinische Software niedriger Risikoklassen (I und IIa) erlaubt die MDR in begründeten Fällen auch eine Leistungsbewertung. Also den Verzicht auf klinische Daten. Näher geregelt ist das im MDCG Dokument 2020-1.
Für die Aufnahme in das DiGA Verzeichnis reicht die Leistungsbewertung jedoch nicht aus. Hier muss der Nachweis mit klinischen Daten erbracht werden.
Wenn Sie als den medizinischen Nutzen des Medizinprodukts gemeint haben, dann besteht der Unterschied in der Möglichkeit der Leistungsbewertung für mediznische Software niedriger Risikoklassen. Wenn Sie den medizinischen Nutzen der DiGA gemeint haben, dann gibt es keinen Unterschied, weil der medizinische Nutzen ja ein positiver Versorgungseffekt. Das Ganze Thema ist sehr komplex, ich hoffe dass ich den Kern Ihrer Frage getroffen habe.
Mit besten Grüßen
Astrid Schulze