Staaten wie Deutschland, Österreich, die Schweiz und die USA geben über zehn Prozent ihres Bruttosozialprodukts für ihr Gesundheitswesen aus. Allerdings unterscheiden sich die Systeme sehr stark in ihrer Effizienz und Effektivität. Das liegt sowohl an der Gesetzgebung als auch an einem unterschiedlichen Digitalisierungsgrad.
Inhalt
Sie finden auf dieser Seite Fachartikel zu den folgenden Themen:
- Gesundheitswesen
- Health-IT
- Regulatorischer Kontext
1. Fachartikel zum Gesundheitswesen
Sie finden in dieser Kategorie Fachartikel zu folgenden Themen:
- Akteure im Gesundheitswesen
- Markttrends und gesundheitspolitische und allgemeine medizinische Themen
2. Fachartikel zur Health-IT
3. Fachartikel zum regulatorischen Kontext
a) Produktentwicklung
Falls Sie vor der Aufgabe stehen, ein Produkt für den Gesundheitsmarkt zu entwickeln, dann beachten Sie diese Informationen:
b) Anwendung und Betrieb von Medizinprodukten
Für die Gesundheitseinrichtungen sind diese Fachartikel relevant:
Die C5-Testate sind für Leistungserbringer und ggf. für Medizinproduktehersteller relevant. Denn das Anfang 2024 in Kraft getretene Digital-Gesetz (DigiG) definiert die Anforderungen an Cloud-Dienste im Gesundheitswesen neu. Dieser Artikel erklärt die wichtigsten Aspekte der C5-Zertifizierung bzw. C5-Testate für Medizinproduktehersteller und Leistungserbringer wie etwa Krankenhäuser.
Details
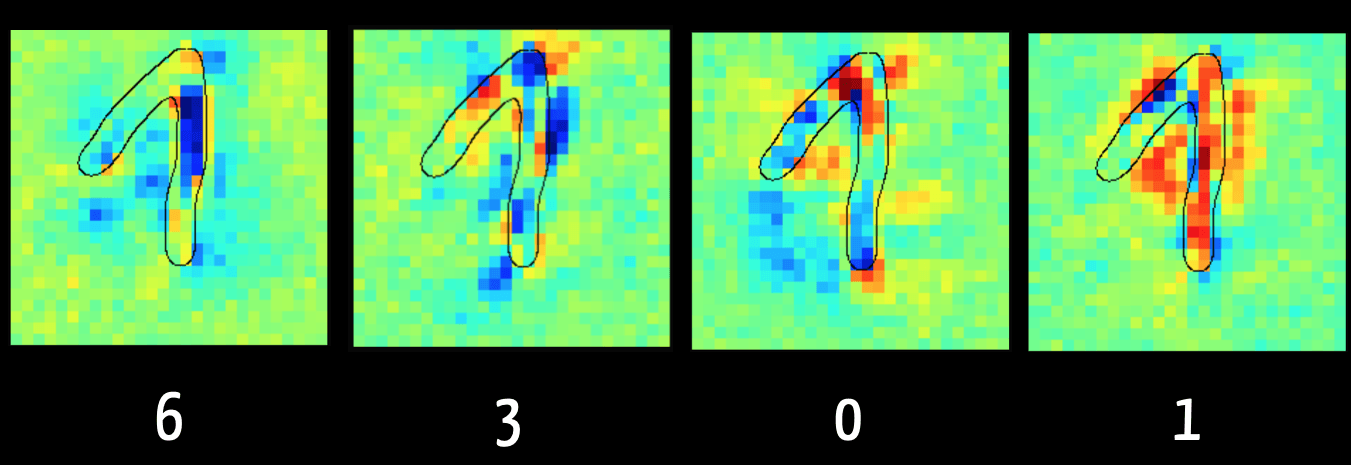
Immer mehr Medizinprodukte nutzen künstliche Intelligenz, um Krankheitsbilder präziser zu diagnostizieren und Patienten wirksamer zu behandeln.
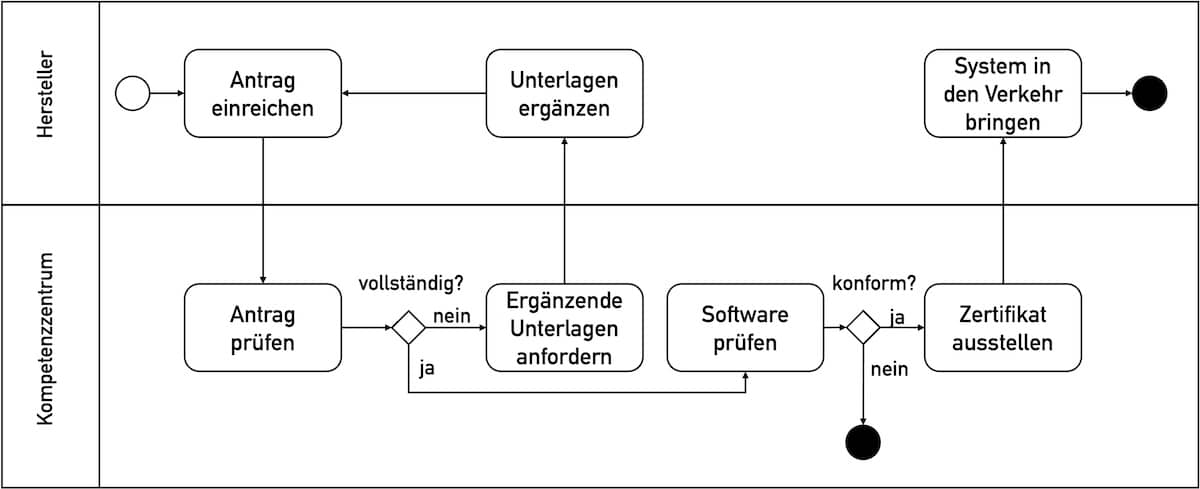
Am 14.09.2024 ist die neue Fassung der Gesundheits-Interoperabilitäts-Governance-Verordnung (oder IOP-Governance-Verordnung, kurz GIGV) in Kraft getreten. Einen Referentenentwurf, welcher die Erwägungsgründe enthält, hatte das Bundesgesundheitsministerium am 24. April des Jahres veröffentlicht. Damit ist die GIGV in der Fassung vom Oktober 2021 überholt. In diesem Artikel erfahren Sie, was die Verordnung fordert und ob Sie davon betroffen…
Details
So stellen Sie sicher, dass Sie Ihre Inhouse-IVD (auch Laboratory Developed Tests, LDT genannt) auch unter der nun gültigen IVDR noch anbieten können. Sie haben drei Möglichkeiten, um Rechtsstreitigkeiten zu vermeiden. Inhouse-IVD zählen zu den in-vitro-diagnostischen Tests. Gelten für diese Art von Produkten auch regulatorische Anforderungen wie die IVDR? Dieser Artikel verschafft nicht nur medizinischen…
Details
PDMS steht für Patientendatenmanagementsystem. Diese klinischen Informationssysteme finden sich typischerweise in Krankenhäusern, v. a. in den Abteilungen, die Patienten intensivmedizinisch behandeln. Durch die Förderungen des Krankenhaus-Zukunftsgesetzes (KHZG) erleben die PMDS einen neuen Boom. Dieser Artikel
Details
Unternehmen müssen die digitale Transformation schnell und erfolgreich bewältigen. Das gilt auch für Medizinproduktehersteller. Denn ihre Zukunft hängt davon ab. Bei dieser Transformation begehen viele Unternehmen folgenreiche Fehler (s. 4. Abschnitt). Daher gibt dieser Fachartikel insbesondere Führungskräften einen schnellen Überblick über die Möglichkeiten der digitalen Transformation. Sie erhalten sieben Tipps, damit diese zum Erfolg wird.…
Details
Die Digitale Gesundheitsanwendungen-Verordnung (DiGAV) ist für die Hersteller von digitalen Gesundheitsanwendungen die wichtigste gesetzliche Vorgabe. Die DiGAV bestimmt die Voraussetzungen für eine Erstattung von digitalen Gesundheitsanwendungen (DiGA) durch die Krankenkassen. Erfahren Sie, welche Anforderungen die Verordnung an die Hersteller stellt. So können Sie entscheiden, ob ein Antrag erfolgversprechend ist und ob die Kosten dafür im…
Details
Die Telematikinfrastruktur (TI) ist eine Plattform bzw. ein Netzwerk, über das in Deutschland Gesundheitsdaten sicher ausgetauscht werden und auf der Gesundheitsanwendungen wie die elektronische Patientenakte und das e-Rezept betrieben werden sollen. Dieser Beitrag hilft Herstellern medizinischer Software zu verstehen, wann sie welche gesetzlichen und technischen Anforderungen im Kontext dieser Telematikinfrastruktur erfüllen müssen.
Details
Medizinprodukte- und IVD-Hersteller verwenden zunehmend Cloud-Dienste: Erfahren Sie, welche Möglichkeiten Hersteller haben, um Cloud-Dienste wie Medical Clouds zu nutzen und dennoch die regulatorischen Anforderungen an z. B. den Datenschutz zu erfüllen.
Details
Gesetze fordern das Risikomanagement im Krankenhaus, vor allem, um die Patientensicherheit zu verbessern. Dennoch tun sich viele Krankenhäuser damit schwer. Dieser Artikel stellt die wichtigsten regulatorischen Anforderungen vor und gibt Tipps zur Umsetzung.
Details