Medizinprodukteberater spielen eine zentrale Rolle, um die Sicherheit von Medizinprodukten zu gewährleisten. Die Position ist dem Pharmaberater (§ 75 AMG) nachgebildet.
Die EU-Verordnungen MDR und IVDR kennen dieses Konzept nicht. Doch der Medizinprodukteberater ist im nationalen Recht verankert. Deutschland und Österreich fordern die Rolle des Medizinprodukteberaters im nationalen Recht (Medizinprodukterecht-Durchführungsgesetz (MPDG) in Deutschland und Medizinproduktegesetz (Ö-MPG) in Österreich). Sie gehören damit zu den wenigen Staaten, die einen Medizinprodukteberater verlangen.
Hersteller sollten nicht nur die Änderung durch das MPDG kennen, sondern alle regulatorischen Anforderungen, die mit der Rolle des Medizinprodukteberaters in Verbindung stehen. Denn ein Verstoß kann teuer werden: Das MPDG hat die Bußgelder auf bis zu 30.000 EUR erhöht.
1. Wer zählt als Medizinprodukteberater?
a) Definitionen
Medizinprodukteberater sind Personen, die laut MPDG berufsmäßig Fachkreise fachlich informieren oder in die sachgerechte Handhabung der Medizinprodukte einweisen.
Das MPDG definieren auch den Begriff Fachkreis:
„Angehörige der Heilberufe, Angehörige des Heilgewerbes oder Angehörige von Einrichtungen, die der Gesundheit dienen, sowie sonstige Personen, die Medizinprodukte herstellen, prüfen, in der Ausübung ihres Berufs in den Verkehr bringen, implantieren, in Betrieb nehmen, betreiben oder anwenden;“
Quelle: §3 (2) MPDG
Typische Vertreter der Fachkreise sind:
- Ärztinnen und Ärzte
- Pflegekräfte
- Medizinisch-technische Assistentinnen und Assistenten
- Mitarbeitende in der Medizintechnik, dem Labor und ggf. in der Krankenhaus-IT
- Servicetechniker:innen
Patienten zählen nicht zu dieser Liste.
b) Typische Rollen und Berufe
Medizinprodukteberater sind somit typischerweise Personen im Außendienst oder Anwendungsberater, die sich manchmal auch als „Application Engineer“ bezeichnen.
So zeigen Medizinprodukteberater den Fachkräften, wie man ein Medizinprodukt auf eine Behandlung vorbereitet und danach wieder reinigt. Medizinprodukteberater sind dabei mitunter im OP zugegen und unterweisen die Fachkreise z. B. beim Verwenden von Herz-Lungen-Maschinen oder beim Implantieren von Herzschrittmachern.
Wenn Personen im Innendienst oder im Callcenter ebenfalls beraten oder einweisen, fallen sie auch unter diese Definition.
|
Innendiensttätigkeit, die nicht zur Rolle des MPB zählt |
Innendiensttätigkeit, die zur Rolle des MPB zählt |
| Ein Kunde ruft beim Innendienst oder im Callcenter an und erfragt eine Produktspezifikation, die der Mitarbeiter vom Datenblatt ablesen kann. Ein Beispiel dafür wäre die Frage, mit wie vielen Umdrehungen sich der Zahnarztbohrer dreht. |
Ein Kunde ruft beim Innendienst oder im Callcenter an und fragt, wie man das Produkt anwendet oder ob es sich für eine bestimmte Indikation eignet. Bei Beispiel dafür wäre die Frage, ob man den Bohrer auch für die Fixierung eines bestimmten Implantats verwenden kann. |
2. Was macht ein Medizinprodukteberater?
Medizinprodukteberater informieren die Fachkreise, also die Anwender von Medizinprodukten oder weisen sie in die Verwendung der Medizinprodukte ein. Gleichzeitig sind Medizinprodukteberater verpflichtet, Probleme, Risiken und Nebenwirkungen mit diesen Produkten an den Hersteller zurückzumelden.
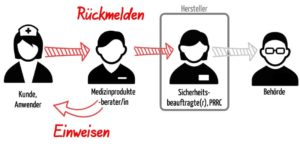
a) Einweisen
Ob eine Einweisung in ein Medizinprodukt notwendig ist, entscheidet meist der Hersteller. Allerdings sind diese Einweisungen für bestimmte Medizinprodukte verpflichtend. Die Medizinprodukte-Betreiberverordnung sagt:
(1) Der Betreiber darf ein in der Anlage 1 aufgeführtes Produkt nur betreiben lassen und benutzen lassen, wenn zuvor der Hersteller oder eine dazu befugte Person, die im Einvernehmen mit dem Hersteller handelt,
§ 11 Medizinprodukte-Betreiberverordnung
1. dieses Produkt am Betriebsort einer Funktionsprüfung unterzogen hat und
2. eine von dem Betreiber beauftragte Person anhand der Gebrauchsanweisung sowie beigefügter sicherheitsbezogener Informationen und Instandhaltungshinweise in die sachgerechte Handhabung, Benutzung und den Betrieb des Produktes, miteinander verbundener Produkte sowie der mit den Produkten verbundenen Gegenstände eingewiesen hat.
Eine Einweisung nach Satz 1 Nummer 2 ist in den Fällen des § 4 Absatz 3 Satz 3 Nummer 2 nicht erforderlich.
Anlage 1 der MPBetreibV listet kritische Medizinprodukte wie Kernspingeräte, Defibrillatoren, Perfusoren oder Elektrochirurgiemesser. Man bezeichnet diese Medizinprodukte auch als einweisungspflichtig.
Für diese Produkte verlangt der Gesetzgeber nicht nur, dass ein Repräsentant des Betreibers (z.B. des Krankenhauses) eingewiesen wird, sondern dass alle Anwender des Produkts eingewiesen werden – typischerweise vom Medizinprodukteberater.
Diese Einweisung findet häufig direkt am Produkt statt, wie oben bereits am Beispiel der Dialysemaschine und der Implantate angedeutet.
Die MPBetreibV verlangt in § 11 explizit: „(3) […] und die Einweisung der vom Betreiber beauftragten Person nach Absatz 1 Nr. 2 sind zu belegen.“
b) Schulen
Regelmäßig wird die Einweisung durch eine Schulung begleitet. Diese Schulungen sollten die folgenden Themen adressieren:
|
Thema |
Beispiel Dialysemaschine |
|
Medizinische Grundlagen |
Niere, Hormonsystem |
|
Therapiemöglichkeiten |
Dialyseverfahren, Transplantation |
|
Produkttyp und spezielles Produkt |
Hämodialysemaschine, Zubehör, Gebrauchsanweisung, Symbole, ggf. sicherheits- und messtechnische Kontrollen |
|
Anwendung |
Vorbereitung, Einstellung, Reinigung, Umgang mit Fehlern |
|
Meldepflichten | Kontaktdaten des Herstellers, des Medizinprodukteberaters und des BfArMs, Meldefristen und Formen |
c) Rückmelden
Medizinprodukteberater unterliegen zudem der Pflicht, Probleme zurück an den Hersteller zu melden.
„Der Medizinprodukteberater hat Mitteilungen von Angehörigen der Fachkreise über Nebenwirkungen, wechselseitige Beeinflussungen, Fehlfunktionen, technische Mängel, Gegenanzeigen, Verfälschungen oder sonstige Risiken bei Medizinprodukten schriftlich aufzuzeichnen und unverzüglich […] schriftlich oder elektronisch zu übermitteln.“
MPDG §83 (4)
Das Gesetz listet mehrere Typen an „Problemen“ auf:
| Problem |
Beispiel |
|
Nebenwirkung |
Allergische Reaktion eines Patienten beim Kontakt mit dem Medizinprodukt |
|
Wechselseitige Beeinflussung |
Mobiltelefon stört die Anzeige eines Medizinprodukts |
|
Fehlfunktion |
Mechanisches Verklemmen, Abbrechen einer Komponente, System zeigt Daten von falschem Patienten an |
|
Technischer Mangel |
Schutzfolie löst sich ab |
|
Gegenanzeigen |
Metallisches Implantat macht im Kernspin Probleme |
Die Gesetze legen somit fest:
- Was zu melden ist: siehe Tab. 3
- An wen zu melden ist: an den Hersteller (Sicherheitsbeauftragter bzw. Verantwortliche Person) bzw. den Importeur.
- In welcher Frist zu melden ist: unverzüglich, d.h. i.d.R. am gleichen Tag
- In welcher Form zu melden ist: Diese Anforderungen beschreiben die MDR bzw. die IVDR sowie das MPDG und die Verordnung über die Meldung von mutmaßlichen schwerwiegenden Vorkommnissen bei Medizinprodukten sowie zum Informationsaustausch der zuständigen Behörden (Medizinprodukte-Anwendermelde- und Informationsverordnung – MPAMIV).
Lassen Sie sich als Medizinprodukteberater immer den Eingang Ihrer Meldung quittieren!
Die Medizinprodukteberater tragen somit maßgeblich zur Post-Market-Surveillance der Hersteller bei (s. Abb. 2).
3. Welche Sachkenntnis muss ein Medizinprodukteberater besitzen?
Das MPDG fordert, dass der Medizinprodukteberater die erforderliche Sachkenntnis besitzt. In jedem Fall müssen die Medizinprodukteberater in Funktionsweise und Handhabung der Medizinprodukte, in die sie einweisen, geschult worden sein. Zudem benötigen sie entweder eine einschlägige Ausbildung oder müssen entsprechende Fähigkeiten durch eine i.d.R. mindestens einjährige Tätigkeit erworben haben.
#Die Ausbildung zum Medizinprodukteberater muss zumindest teilweise produktspezifisch erfolgen und Kenntnisse müssen kontinuierlich aktualisiert werden. Eine pauschale Ausbildung zum Medizinprodukteberater kann es somit nicht geben. Die Grundlagen, insbesondere die rechtlichen, lassen sich hingegen produktübergreifend vermitteln, z. B. mit unserem Kurs „Die Rolle Medizinprodukteberater:in“ in der Johner Academy oder dem Seminar „Medizinprodukteberater MPDG“.
4. Regulatorische Anforderungen
a) Anforderungen MPDG
Das Medizinprodukterecht-Durchführungsgesetz (MPDG) hält an der Forderung nach einem Medizinprodukteberater fest und hat im Vergleich zum Vorgänger, dem Medizinproduktegesetz (MPG), den entsprechenden Artikel nur geringfügig geändert.
Die folgende Gegenüberstellung hebt die Änderungen hervor.
|
| MPG § 31 | MPDG § 83 |
|
Forderung nach Sachkenntnis |
(1) Wer berufsmäßig Fachkreise fachlich informiert oder in die sachgerechte Handhabung der Medizinprodukte einweist (Medizinprodukteberater), darf diese Tätigkeit nur ausüben, wenn er die für die jeweiligen Medizinprodukte erforderliche Sachkenntnis und Erfahrung für die Information und, soweit erforderlich, für die Einweisung in die Handhabung der jeweiligen Medizinprodukte besitzt. Dies gilt auch für die fernmündliche Information. |
1) Wer berufsmäßig Fachkreise fachlich informiert oder in die sachgerechte Handhabung der Medizinprodukte einweist (Medizinprodukteberater), darf diese Tätigkeit nur ausüben, wenn er die für die jeweiligen Medizinprodukte erforderliche Sachkenntnis und Erfahrung für die Information und, soweit erforderlich, für die Einweisung in die Handhabung der jeweiligen Medizinprodukte besitzt. Dies gilt auch für die fernmündliche Information |
|
Definition von Sachkenntnis |
(2) Die Sachkenntnis besitzt, wer 1. eine Ausbildung in einem naturwissenschaftlichen, medizinischen oder technischen Beruf erfolgreich abgeschlossen hat und auf die jeweiligen Medizinprodukte bezogen geschult worden ist oder 2. durch eine mindestens einjährige Tätigkeit, die in begründeten Fällen auch kürzer sein kann, Erfahrungen in der Information über die jeweiligen Medizinprodukte und, soweit erforderlich, in der Einweisung in deren Handhabung erworben hat. |
(2) Die Sachkenntnis besitzt, wer 1. eine Ausbildung in einem naturwissenschaftlichen, medizinischen, technischen oder IT-kaufmännischen Beruf erfolgreich abgeschlossen hat und auf die jeweiligen Medizinprodukte bezogen geschult worden ist oder 2. durch eine mindestens einjährige Tätigkeit, die in begründeten Fällen auch kürzer sein kann, Erfahrungen in der Information über die jeweiligen Medizinprodukte und, soweit erforderlich, in der Einweisung in deren Handhabung erworben hat. |
|
Nachweis der Sachkenntnis |
(3) Der Medizinprodukteberater hat der zuständigen Behörde auf Verlangen seine Sachkenntnis nachzuweisen. Er hält sich auf dem neuesten Erkenntnisstand über die jeweiligen Medizinprodukte, um sachkundig beraten zu können. Der Auftraggeber hat für eine regelmäßige Schulung des Medizinprodukteberaters zu sorgen. |
(3) Der Medizinprodukteberater hat der zuständigen Behörde auf Verlangen seine Sachkenntnis nachzuweisen. Er hält sich auf dem neuesten Erkenntnisstand über die jeweiligen Medizinprodukte, um sachkundig beraten zu können. Der Auftraggeber hat für eine regelmäßige Schulung des Medizinprodukteberaters zu sorgen. |
| Pflichten zur Rückmeldung | (4) Der Medizinprodukteberater hat Mitteilungen von Angehörigen der Fachkreise über Nebenwirkungen, wechselseitige Beeinflussungen, Fehlfunktionen, technische Mängel, Gegenanzeigen, Verfälschungen oder sonstige Risiken bei Medizinprodukten aufzuzeichnen und unverzüglich dem Verantwortlichen nach § 5 Satz 1 und 2 oder dessen Sicherheitsbeauftragten für Medizinprodukte schriftlich oder elektronisch zu übermitteln. |
(4) Der Medizinprodukteberater hat Mitteilungen von Angehörigen der Fachkreise über Nebenwirkungen, wechselseitige Beeinflussungen, Fehlfunktionen, technische Mängel, Gegenanzeigen oder sonstige Risiken bei Medizinprodukten aufzuzeichnen und unverzüglich dem Hersteller, seinem Bevollmächtigten oder deren für die Einhaltung der Regelungsvorschriften verantwortlichen Person schriftlich oder elektronisch zu übermitteln. Werden Medizinprodukte unter der Verantwortung des Importeurs in Verkehr gebracht, sind die Informationen nach Satz 1 diesem schriftlich oder elektronisch zu übermitteln. |
b) Anforderungen der MDR
Sowohl MDR als auch IVDR kennen das Konzept der Medizinprodukteberater nicht. Beide EU-Verordnungen stellen allerdings umfangreiche Anforderungen an die Post-Market-Surveillance.
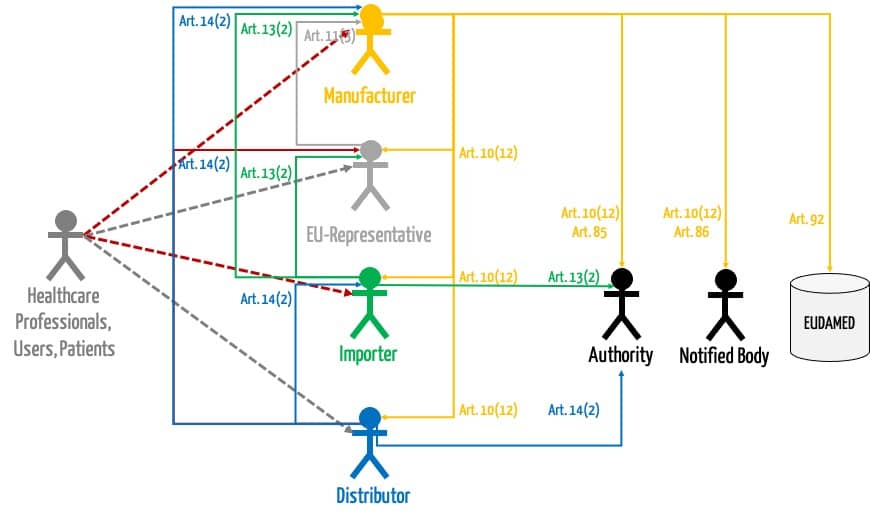
Lesen Sie hier mehr dazu, was Sie beachten müssen, um eine MDR-konforme Post-Market Surveillance zu etablieren.
c) ISO 13485
Auch die ISO 13485 verlangt von den Herstellern nicht, Medizinprodukteberater zu qualifizieren und zu nutzen. Sie verlangt allerdings, dass die Hersteller, die für sie geltenden regulatorischen Anforderungen bestimmen (Abschnitt 4.1.4). Das MPDG zählt dazu.
Außerdem fordert die ISO 13485, personelle Ressourcen bereitzustellen und deren Kompetenzen sicherzustellen (Abschnitt 6.2).
Zudem verlangt die Norm, ein Verfahren für den Rückmeldeprozess (Abschnitt 8.2.1) zu etablieren.Die Hersteller müssen ausgelagerte Prozesse überwachen (Abschnitt 4.1.5). Eine geforderte Einweisung durch einen Dritten, z. B. einen Händler, wäre so ein ausgelagerter Prozess.
d) Österreichisches Recht
Ähnlich zum Medizinprodukteberater in Artikel 83 im deutschen MPDG, kennt das Medizinproduktegesetz 2021 in Österreich ähnliche Anforderungen in §48. Im Gegensatz zum alten Ö-MPG sind die Anforderungen z.B. an Sachkenntnis, Schulungen, Pflichten etc. der Medizinprodukteberater wesentlich unkonkreter geworden. Hier ist das MPDG konkreter.
5. FAQ zu Medizinprodukteberatern
a) Welche Anforderungen gibt es an Personen, die Medizinprodukteberater ausbilden?
Die Gesetze stellen keine Anforderungen an die Qualifikation der Ausbilder. Es ist nicht einmal festgelegt, wie die Schulung der Medizinprodukteberater zu erfolgen hat.
Das Johner Institut empfiehlt:
- Regulatorische Kenntnisse z. B. mit Online-Training vermitteln und die Wirksamkeit des Trainings überprüfen. Der Auditgarant ist eine Möglichkeit dafür.
- Das Konzept und die Unterlagen, mit denen der Medizinprodukteberater die Fachkreise schult, sollte vom Produktmanager, vom Risikomanager, von der verantwortlichen Person und vom Qualitätsmanagement geprüft sein.
- Eine dokumentierte Probeschulung in diesem Kollegenkreis mit dokumentiertem Feedback hilft, mögliche Rückfragen von Behörden zu beantworten.
- Medizinprodukteberater, die längere Zeit nicht mehr eingewiesen und geschult haben, sollten eine Auffrischungsschulung erhalten.
- Die Abteilung Regulatory Affairs sollte bestimmen, ob bei Gesetzesänderungen die Medizinprodukteberater neu geschult werden müssen.
- Bei Änderungen an Medizinprodukten sowie bei neuen Medizinprodukten müssen die (neuen) Medizinprodukteberater erneut geschult werden. Das sollte im Freigabeprozess der Produkte verankert sein.
b) Was mache ich als Hersteller, wenn die Medizinprodukteberater bei einem Händler angestellt sind?
Das MPDG unterscheidet nicht, ob Personen, die von Berufswegen schulen und einführen, bei einem Hersteller, einem Händler oder einem anderen Unternehmen angestellt oder freiberuflich tätig sind. Sie müssen die Vorgaben in jedem Fall befolgen.
Als Hersteller sind Sie verpflichtet,
- ein funktionierendes Post-Market-Surveillance- bzw. Rückmeldesystem zu etablieren und aufrechtzuerhalten sowie
- Risiken, die durch falsche oder unzureichende Einweisung entstehen, zu minimieren.
Daher werden Sie als Hersteller auch unabhängig von den Anforderungen, die Medizin-produkteberater erfüllen müssen, vertraglich sicherstellen, dass nur geschulte Personen die Fachkreise einweisen und Ihnen alle Probleme zuverlässig und unverzüglich zurückmelden.
c) Das Gesetz regelt, was Medizinprodukteberater tun müssen. Sagt es auch, was sie NICHT tun dürfen?
Weder Ö-MPG noch MPDG führen aus, was die Medizinprodukteberater nicht tun dürfen. Allerdings ergibt sich aus anderen Gesetzen, dass Medizinprodukteberater an einer Untersuchung oder Behandlung nur mit Einwilligung der Patienten teilnehmen und natürlich nicht selbst Aufgaben übernehmen dürfen.
Medizinprodukteberater dürfen keine Patienten berühren oder sich gar an chirurgischen Eingriffen beteiligen.
6. Zusammenfassung
Bisher haben die Behörden und Benannten Stellen nur sehr zurückhaltend überprüft, ob die Personen, die das Gesetz als Medizinprodukteberater definiert, die regulatorischen Anforderungen einhalten. Das könnte sich mit den strengeren Anforderungen an die Post-Market Surveillance künftig ändern. Die Bußgelder bei Verstoß gegen den § 83 hat das MPDG bereits auf bis zu 30.000 EUR erhöht (s. MPDG § 94(2) in Verbindung mit (4)).
Das Johner Institut bietet öffentliche Seminare und Inhouse-Schulungen für Medizinprodukteberater an.
Versionshistorie:
- 2022-04-07: Allgemeine Überarbeitung und Update.
- 2023-11-10: Anpassung Kapitel 4 an das neue österreichische MPG.




Danke für diesen Artikel.
Leider erwähnen Sie nichts zum Zertifikat eines MPB, welches immer häufiger von Kunden verlangt wird um die Qualifikation eines MPB nachzuweisen.
Sehr geehrte Frau Brandau,
eine „offizielle Pflicht“ die Kompetenz mit einem Zertifikat zu dokumentieren, existiert nicht. Davon abgesehen bestätigen die meisten Zertifikate nur die Anwesenheit.
Dass Kunden ein Zertifikat verlangen, wissen wir, weshalb wir bei unseren Schulungen welche ausstellen, obwohl das regulatorisch nicht gefordert ist.
Danke für die Möglichkeit, diesen Gedanken zu ergänzen.
Viele G, Christian Johner
In nahezu jedem Paragraphen des Medizinproduktedurchführungsgesetzes wird Bezug auf die MDR genommen und somit begründet, warum etwas in einem speziellen deutschen Gesetz geregelt werden darf. Das geschieht beim Medizinprodukteberater nicht. Die MDR berechtigt die einzelnen Länder aus meiner Sicht nicht, so etwas zu regeln. Es behindert aus meiner Sicht einen freien Warenverkehr in Europa, wenn beispielsweise ein französischer Hersteller für den Vertrieb in Deutschland einen Medizinprodukteberater braucht. Was ist Ihre Meinung dazu Herr Johner?
Sehr geehrter Herr Herker,
das ist ein sehr wichtiger Gedanke, den Sie ergänzen! Danke dafür!
In der Tat kann man es als kritisch einschätzen, wenn die Länder zusätzliche Anforderungen erheben. In gewissen Grenzen erlaubt die MDR dies jedoch.
Generell bin ich der Meinung, dass sich die Nationalstaaten der EU nicht so unterscheiden, dass es unterschiedliche Regelungen geben sollte. Denn sonst werden diese zu Wettbewerbsschranken, wie Sie sagen. Es ist auch nicht nachvollziehbar, weshalb man in einem Land einen MPB braucht, um die Sicherheit der Produkte zu gewährleisten, in einem anderen nicht.
Zumindest in Sachen Produktregistrierung wird die Sache jetzt einfacher…
Danke für Ihre wichtigen Gedanken!
Viele Grüße, Christian Johner
Moin Herr Johner,
wer darf denn die Beratung in diesem Beispiel durchführen:
Medizinprodukte-Abgabeverordnung §3 Abs2: Die Abgabestelle muss bei Bedarf einen fachliche Beratung gewährleisten für Medizinprodukte, die
2. zur Anwendung durch Laien angeboten werden und nicht der Klassei nach den Klassifizierungsregeln des Anhangs IX der Richtlinie 93/42/EWG ……… anghören….
Dann ist auch noch Absatz 3. über die fachliche Qualifikation von Interesse. Demnach muss das ein MP-Berater machen.
Wir haben das so gelöst, dass auf dem Karton eine spezielle Telefonnummer für diese Fälle steht. Hier hat der potentielle Käufer die Möglichkeit von einem MP-Berater seine Fragen beantwortet zu bekommen.
Viele Grüße
Wolfgang Krecker
Sehr geehrter Herr Krecker,
danke für Ihre Frage. Ich hoffe, dass ich diese richtig verstehe. Falls nicht, dann haken Sie gerne nach.
Das MPG regelt über den §31 mit den Medizinprodukteberater die Einweisung an die Angehörigen der Fachkreise. Wenn hingegen die Produkte an Endanwender (Laien) abgegeben werden, dann muss „bei Bedarf“ der Abgebende (Apotheke) eine Beratung gewährleisten. Das regelt die MPAV. Eine Ausnahme gilt für die Niedrig-Risiko-Produkte der Klasse I.
Damit ergänzen sich das MPG und die MPAV.
Ob ein Versand den Anforderungen der MPAV genügt, kann ich nicht beurteilen.
Beste Grüße, Christian Johner
Sehr geehrter Herr Johner,
wie ist es denn, wenn der Abgebende keine Apotheke, sondern der Hersteller ist, wie zum Beispiel im Rahmen einer DiGA. Im Gesetzestext steht ja auch: „ […] sowie sonstige Personen, die Medizinprodukte […] anwenden; “, dies würde doch bei einer DiGA auch die Patienten betreffen oder verstehe ich das falsch?
Danke für eine kurze Rückmeldung
Beste Grüße
Julia
Sehr geehrte Julia,
ich bin unsicher, ob ich Ihre Frage richtig verstehe. Falls nicht, haken Sie bitte nach.
Das MPDG stellt im §83 MPDG die Anforderungen an Medizinprodukteberater. Das sind Personen, die Fachkreise berufsmäßig informieren. Den Begriff Fachkreis definiert sie im §3 MPDG. Daraus folgt, dass Personen, die Patienten informieren, nicht unter den §83 fallen.
Wie gesagt, wenn ich die Frage nicht verstanden haben sollte, bitte nachfragen.
Viele Grüße
Christian Johner
PS: Die Definition des Begriffs „Fachkreis“ beginnt mit
D.h. Patienten sind damit ausgeschlossen, auch wenn der Nebensatz von „anwenden“ spricht. D.h. Hersteller, die (nur) direkt an Patienten abgeben unterliegen nicht der Pflicht nach einem Medizinprodukteberater. Das gilt auch für DIGA-Hersteller.
Leider ist schon der zweite Satz dieses sonst tollen neuen Artikels falsch: „Doch nur das deutsche Medizinprodukterecht (MPG, MPDG) fordert die Rolle des Medizinprodukteberaters.“ Das MPG ist in den Mitgliedsländern ganz unterschiedlich geregelt: die deutsche Version ist sehr kurz, die österreichische Version viel ausführlicher: sie fordert in §79 viele Details zu Sachkenntnis, Schulungen, Pflichten etc. der Medizinprodukteberater.
Siehe https://www.jusline.at/gesetz/mpg/gesamt
Mit freundlichen Grüßen
Gerhard Silberbauer
Ganz wichtiger Hinweis, lieber Herr Silberbauer!
Das nehme ich gleich im Text mit auf.
Vielen herzlichen Dank für Ihre Unterstützung!
Beste Grüße, Christian Johner
Sehr geehrter Herr Johner,
warum das österreichische MPG ausführlicher sein sollte als das deutsche (wie Herr Silberbauer anmerkte), erschließt sich mir nicht! Das deutsche MPG stellt sogar höhere Anforderungen, weil es im zweiten Absatz explizite Mindesterfordernisse für die Sachkenntnis nennt. Das österreichische MPG verlangt lediglich „die erforderliche medizinische und medizintechnische Sachkenntnis“ ohne dabei konkret zu werden. Laut Absatz (5) könnte zwar der Gesundheitsminister per Verordnung nähere Anforderungen an die Sachkenntnis der Medizinprodukteberater festlegen, das ist aber bisher nicht geschehen. Laut Stichwortsuche im „RIS“ kommt der Medizinprodukteberater nur in drei Gesetzesmaterien vor: Im MPG §79, in der Medizinproduktebetreiberverordnung (MPBV) und in der Mechatronik Ausbildungsordnung. In der MPBV werden MedizinprodukteberaterInnen im Zusammenhang mit Einweisung genannt und angehende Mechatroniker haben diese Funktion unter anderem auch im Berufsbild.
Theoretisch kann ich in Österreich auch den Portier oder die Telefonistin zum Medizinprodukteberater schulen und muss dann eventuell nur erklären können, warum ihr Erste-Hilfe Kurs bereits ausreichende medizinische Sachkenntnis bedeutet…
Viele Grüße
Gottfried Griesmayr
Danke für Ihre Gedanken, Her Griesmayr!
Die Frage, welche Regularien strenger oder ausführlicher sind, lässt sich sicher unterschiedliche beantworten. Da möchte ich mir gar kein Urteil anmaßen.
Ich finde es aber wichtig, dass Sie die Frage stellen — und damit auch Firmen, die in beiden Märkten agieren — und dass der Artikel ergänzt wurde um den Hinweis auf das Österreichische MPG.
Danke für Ihre Anmerkungen. So werden die Darstellungen umfassender und für die Leser hilfreicher.
Beste Grüße, Christian Johner
Sehr geehrter Herr Prof. Dr. Johner,
zunächst vielen Dank für die immer sehr Informativen Artikel.
In diesem Artikel zum Medizinprodukteberater fehlt jedoch m.E. unter 2.a Einweisen noch ein Hinweis auf die „einfache“ Einweisung nach § 4 (3) MPBetreibV. Auch hier ist in der Regel zumindest bei einer Ersteinweisung der Medizinprodukteberater die Person der Wahl, auch wenn dies nicht explizit in der Verordnung festgelegt ist.
Mit freundlichen Grüßen
Philippe Kaiser
Sehr geehrter Herr Prof. Dr. Johner,
vielen Dank für die Ausführungen.
Ich bin Schulungsleiter im Bereich Reha-Technologie.
Unter 5 c sagen Sie, dass aufgrund „anderer Gesetze“ Medizinprodukteberater Patient:Innen nicht berühren dürfen.
Könnten Sie dazu bitte entsprechende Quellen nennen?
Bei der Erstellung von Produkt-/Anwenderschulungsunterlagen wie auch in deren Durchführung halte ich dieses für einen wichtigen Punkt, bei dem sich Schulungsbeauftragte, also Medizinprodukteberater, absichern sollten. Das heißt, dass Schulungsteilnehmer schon in der Anwenderschulung die Verantwortung für ihre Patient:>Innen übernehmen und schriftlich bestätigen sollten, wenn bereits in der Anwenderschulung an wirklichen Patient:iInnen geübt wird.
Für einen Hinweis auf entsprechende Quellen wäre ich Ihnen sehr dankbar.
Mit freundlichem Dank
Eibo Schwitters
Sehr geehrter Herr Schwitters,
ich habe inzwischen Antwort aus meinem Team und einem Arzt bekommen.
Die Aussage muss ich in dieser Ausprägung relativieren. Sie bezog sich auf die Therapie mit Medizinprodukten, die Ärzten vorbehalten sind bzw. eine medizinische Ausbildung voraussetzt. Hintergrund war ein Fall, bei dem ein MPB bei der OP eines Implantats mitwirkte, ohne überhaupt eine medizinische Ausbildung zu haben. Der Punkt war die Anwendung des Produkts am Menschen, nicht primär die Frage, ob der Patient dabei berührt wird.
In Ihrem Fall geht es um Geräte, die in ähnlicher Form auch im Freizeitbereich eingesetzt werden. Hier sehe ich keine Probleme, zumal sie in Ihrem bestimmungsgemäßen Gebrauch keine Personen ausschließen, die Sie im Kontext der Schulungen einsetzen. Hier ist es eher eine Frage des Umgangs von Mensch zu Mensch, aber nichts, was medizinrechtlich oder medizinprodukterechtlich zu regeln wäre.
Danke für die wichtige Nachfrage!
Beste Grüße, Christian Johner
Beste Grüße, Christian Johner
Hallo Herr Prof. Johner,
mich würde interessieren ob ein Usability Engineer, der ggf. im Rahmen eines Usability Tests / summativen Evaluation den Nutzer am Produkt schult auch eine Fortbildung zum Medizinproduktberater benötigt?
Sehr geehrte Frau Weise,
danke für Ihre spannende Frage!
Ein Usability-Engineer führt i.d.R. keine Tätigkeiten durch, die zu denen eines Medizinprodukteberaters zählen. Daher wäre meine kurze Antwort „nein“.
In der Hoffnung trotz der kurzen Antwort geholfen zu haben und mit vielen Grüßen
Christian Johner
Sehr geehrter Herr Prof. Johner,
herzlichen Dank für Ihre schnelle und informative Auskunft!
Mit den besten Grüßen
Annekathrin Weise
Vielen Dank für die wie immer interessanten und hilfreichen Informationen. Ich bin sicher, dass der Gesetzgeber auch Anforderungen an die Endkundenberatung stellt. Können Sie mir sagen, wo diese definiert sind? Herzlichen Dank!
Sehr geehrter Herr Siedentop,
danke für Ihre wertschätzende Rückmeldung! Darüber freue ich mich!
Ich bin noch nicht ganz sicher, ob ich Ihre Frage richtig verstehe. Die einzigen gesetzlichen Vorschriften sind die des MPDGs und damit die an die Medizinprodukteberater. Die beschränken sich aber auf die „Fachkreise“, welche aber durchaus Endkunden sein können. Die Beratung dieser Gruppe fällt unter den Anwendungsbereich.
Die Beratung von Patienten würde hingegen nicht darunterfallen. Wenn die Artikel in Apotheken verkauft werden, kommen ggf. andere rechtliche Anforderungen zum Tragen.
Falls ich Ihre Frage missverstanden haben sollte, dann haken Sie gerne nach.
Viele Grüße
Christian Johner
Sehr geehrter Herr Professor Johner,
vielen Dank für die unmittelbare Rückmeldung. Es geht mir tatsächlich um die Beratung von Patienten, von mir missverständlich als Endkunden beschrieben, wie sie zum Beispiel von Wettberbern im Rahmen von online-Beratungen umgesetzt werden. Als Hersteller von Medizinprodukten der Klasse I sind wir gefragt worden, ob wir Patienten direkt beraten dürfen bzw. welche Anforderungen an eine solche Beratung gestellt werden. Dies weiß ich nicht und suche eine Quelle oder Auskunft, die mir weiterhilft. Letztlich haben auch Medizinprodukteberater im Rahmen ihrer Tätigkeit immer wieder Patientenkontakt beim Kunden, in unserem Fall im Sanitätshaus. Auch hier suche ich eine sichere Quelle, die mir Möglichkeiten und Grenzen aufzeigt, eben weil das MPDG nur von „Fachkreisen“ spricht.
Noch einmal vielen Dank
Tjark Siedentop
Sehr geehrte Damen und Herren
muss der Medizinprodukteberater in Deutschland ansässig sein, oder kann er in einem anderen Land ansässig sein, z.B. Österreich?
Freundliche Grüße
Daniel
Sehr geehrter Daniel,
der Gesetzestext lässt sich nicht darüber aus. Das MPDG, aus dem diese Forderung stammt, unterscheidet nicht, wo die Person ansässig ist. Jede Person, die in Deutschland die im §83 genannten Tätigkeiten durchführt, muss die dort genannten Anforderungen erfüllen.
Mit den allerbesten Grüßen
Christian Johner
Der Artikel ist nicht meht up to date da es den §79 im Ö-MPG schon seit einiger Zeit nicht mehr gibt. Das Ö-MPG ist nunmehr noch unkonkreter als das MPDG, was die Sachkunde des MPB angeht.
Danke für Ihren wichtigen Hinweis, lieber Dr. Breß!
Wir werden den Artikel überarbeiten.
Viele Grüße
Christian Johner
Sehr geehrter Herr Prof. Dr. Johner,
ich musste sogar Ende der 2010er Jahre deutschen Kollegen (bin seit 2006 in der MP-Branche in Österreich tätig) noch über die „österreichischen“ Medizinprodukteberater aufklären.
Als ich den Titel des Artikels gelesen habe, musste ich also schmunzeln.
Laut meines wissens wurde dieser Begriff in AT schon in der 1996er Fassung des MPG’s etabliert und ausformuliert, in der deutschen Gesetzgebung aber erst in der 2021er Version (?).
Also, diesmal „kein deutsches Konzept“, oder? 🙂
Danke für den Hinweis! Ich werden den Artikel nächste Woche anpassen. Ehre wem Ehre gebührt .
Danke, dass Sie den Artikel so sorgfältig studiert haben!
Vielen Dank für die schnelle Rückmeldung!
Ich muss selber eine Nachforschung derzeit machen und hatte endlich die Zeit mich zu vertiefen!
Sehr geehrter Herr Prof. Dr. Johner,
vielen Dank für den ausführlichen Bericht zum MPB.
Im MPDG heißt es “ Wer berufsmäßig Fachkreise fachlich informiert oder [….] einweist“. In der Begriffsbestimmung wird „informieren“ leider nicht definiert.
Ein/e Mitarbeiter/in des Herstellers informiert auf Ausstellungen ebenfalls die Fachkreise. Wäre diese Person dann ebenfalls MPB? §16 hilft zur Klärung auch nicht weiter, da es sich nur auf Produkte bezieht.
Wie interpretieren Sie hier “informieren”?
In Ihrem Kapitel 2 schreiben Sie informieren „und“ einweisen! Verwirrend.
Könnten Sie bitte Ihre Beispiele im Kapitel 1b erweitern bzw. Kapitel 2 ergänzen?
Vielen Dank
Sehr geehrter Herr Brunner,
Sie haben Recht, das MPDG definiert den Begriff „informieren“ nicht. Daher haben wir Beispiele eingefügt.
Den Begriff „informieren“ würde ich verstehen als eine Geben von Informationen, die dazu dienen, ein Produkt passend zu einer Indikation auszuwählen oder ein Produkt passend für eine gegebene Indikation oder bestimmte Patienten anzuwenden. Dabei sind die Grenzen zum Einweisen und Schulen fließend.
Viele Grüße
Christian Johner
Hallo Herr Prof. Dr. Johner,
ich habe eine Frage zu der Definition von Sachkenntnis, unsere Aufsichtbehörde prüft derzeit die einzelnen Unternehmen und ist der Meinung, das wir drei Kollegen nun auf einen Medizinprodukteberater-Lehrgang entsenden müssen. Angeblich reichen die vorhandenen Ausbildungen nicht für die Sachkenntnis aus, welche da Notfallsanitäter, Elektroinstallateur und Arzt sind, bereits seit Jahren in der Branche tätig (Schulung und Verkauf). Auf die jeweiligen Produkte ist die Herstellereinweisung natürlich vorhanden und wird regelmässig erneuert. Vielleicht können Sie uns da etwas Licht ins Dunkel bringen. Vielen Dank.
Sehr geehrter Herr Bachmann,
es gibt keine Pflicht zu einem Medizinprodukteberater-Lehrgang. Die Kompetenzanforderungen bestimmt der § 83 MPDG. Demnach gilt:
Diese Voraussetzungen scheinen mir im gegebenen Fall vorzuliegen. Die Pflicht zur Schulung (3) kann auch ohne Lehrgang erfüllt werden.
Beste Grüße, Christian Johner