1. Definitionen
Zur medizinischen Software zählt alle Software, die für das Gesundheitswesen eingesetzt wird, insbesondere Software für Medizinprodukte bzw. Medizingeräte (Embedded Software) und Software, die selbst ein Medizinprodukt ist (Standalone-Software).
Die IEC/CD1 82304-1 (Health Software – Part 1: General requirements for product safety) unterscheidet folgende Begriffe:
- HEALTH SOFTWARE
Software intended to be used specifically for maintaining or improving health of individual persons, or the delivery of care
- MEDICAL SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device or intended to be a SOFTWARE MEDICAL DEVICE
- SOFTWARE MEDICAL DEVICE
Software intended to be a medical device in its own right
- MEDICAL DEVICE SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device
Damit wird klar, dass medizinische Software ein Medizinprodukt sein kann, aber nicht muss.
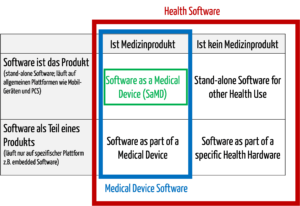
Abb. 1: Medizinische Software umfasst auch Medical Device Software und Software as a Medical Device (zum Vergrößern klicken).
2. Regulatorische Anforderungen
a) Medizinische Software – ein Medizinprodukt?
Es stellt sich oft die Frage, wann medizinische Software für die Medizintechnik der Definition des Begriffs Medizinprodukt entspricht. Eine weiterführende Diskussion dazu finden Sie im Artikel zur Klassifizierung von Software als Medizinprodukt sowie im Artikel zur Qualifizierung und Klassifizierung von IVD-Software.
b) Verordnungen, Gesetze, Normen
Software, die ein Medizinprodukt oder ein Teil dessen ist, muss die regulatorischen Anforderungen erfüllen:
- In Europa sind Medizinprodukteverordnungen (MDR, IVDR) relevant. Diese enthalten jedoch nur relativ allgemeine Vorschriften für Software, die dieser Fachartikel vorstellt.
- Die IEC 62304 definiert die Lebenszyklusprozesse für Software von Medizinprodukten.
- Die IEC 82304-1 ist bei jeder „Health Software“ anwendbar. Die IEC 82304-1 fordert auch Konformität mit den Anforderungen der IEC 62304.
- Es gibt zudem MDCG-Leitlinien z.B. die MDCG 2019-11 und die MDCG 2023-4.
- Die FDA stellt in ihren Guidance-Dokumenten spezifische Anforderungen, explizit auch an medizinische Software. Zudem beantwortete sie viele Fragen speziell zu Software as a Medical Device in diesem FAQ.
3. Unterstützung für Medizinproduktehersteller
Nutzen Sie die Unterstützung des Johner Instituts:
- Haben Sie Fragen zur Entwicklung und Zulassung von Medizinprodukte, die Software enthalten oder Software sind? Dann nutzen Sie das kostenfreie Micro-Consulting.
- Im Kompaktseminar Medizinische Software erwerben Sie die vorgeschriebenen Kompetenzen. Sie lernen die gesetzlichen Anforderungen an die Entwicklung von Software für die Medizintechnik kennen und erfüllen.
- Die Videotrainings des Auditgarant helfen Ihnen, Schritt für Schritt eine schlanke und IEC-62304-konforme „Software-Akte“ zu erstellen. Zusätzlich nimmt Ihnen ein vollständiger Satz an Templates viel Arbeit ab.
- Nutzen Sie auch die Unterstützung unserer Expertinnen und Experten. Sie helfen Ihnen, Ihre Software kurz, präzise und gesetzeskonform zu dokumentieren, und bereiten Sie auf Audits und „Tech File Reviews“ vor.
- Lassen Sie die IT-Sicherheit Ihrer Software durch Penetration Tests überprüfen.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.
Dass Gesetze und Normen die IT-Security auch bei „Legacy Devices“ einfordern, ist verständlich. Die Art, wie diese Anforderungen formuliert werden, führt allerdings oft zu Verwirrung. Beispielsweise konnten sich Gesetzgeber und Normenkomitees nicht auf gemeinsame Definitionen einigen. So geht es einmal um die IT-Sicherheit bei Legacy Devices, einmal um die IT-Sicherheit von Altprodukten bzw. von Bestandsprodukten…
Details
Die MDCG hat im Oktober 2023 eine Leitlinie MDCG 2023-4 veröffentlicht mit dem Titel „Medical Device Software (MDSW) – Hardware combinations – Guidance on MDSW intended to work in combination with hardware or hardware components”.
Sowohl die FDA als auch die IEC 62304 kennen durch Dritte entwickelte Software. Sie sprechen von Off-the-Shelf Software (OTS) bzw. von Software of Unknown Provenance (SOUP). Worin unterscheiden sich OTS und SOUP? Welche Gemeinsamkeiten haben beide? Welche gesetzlichen Anforderungen müssen sie erfüllen? Dieser Artikel gibt Antworten.
Details
Für Hersteller ist die Antwort auf die Frage relevant, ob und wann beim Einsatz künstlicher Intelligenz in Medizinprodukten klinische Studien notwendig sind. Denn davon hängen die Dauer und die Kosten ab, um diese Produkte in den Markt zu bringen. Die gute Nachricht vorweg: Es gibt Fälle, in denen die Hersteller auf klinische Studien bei Produkten…
Details
Der Begriff „Medizinprodukte-PC“ ist nicht eindeutig definiert. Allerdings verstehen unter einem Medizinprodukte-PC die meisten Abhängig von den Konstellationen müssen die Hersteller unterschiedliche regulatorische Anforderungen erfüllen. Diese werden im vorliegenden Artikel vorgestellt.
Details
Die IEC 80001-1 trägt den langen Titel „Anwendung des Risikomanagements für IT-Netzwerke, die Medizinprodukte beinhalten – Teil 1: Aufgaben, Verantwortlichkeiten und Aktivitäten“. Was die Norm verlangt und weshalb sich auch die Hersteller damit beschäftigten sollen, verrät dieser Artikel.
Details
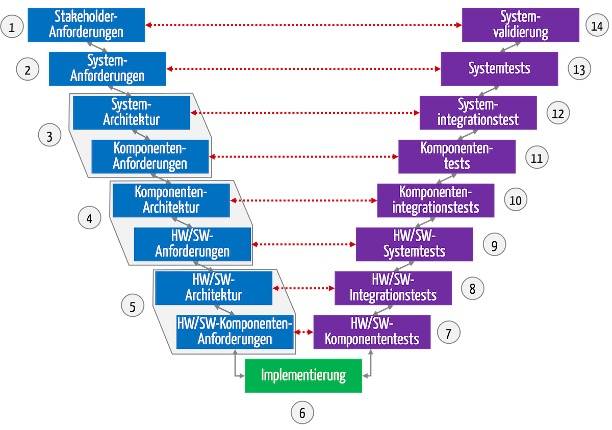
Das V-Modell ist ein Entwicklungsprozessmodell, das ursprünglich bei staatlichen Projekten (u. a. Rüstung) zur Anwendung kam. Bis heute ist es bei Projekten im regulierten Umfeld (z. B. Medizintechnik, Banken) in vielen Köpfen und Normen verankert. Das führt zu Konflikten in Teams, die agile Entwicklungsprozesse bevorzugen. Dieser Artikel hilft, diesen Widerspruch aufzulösen. Sie erfahren, wie Sie…
Details
Viele Medizinproduktehersteller erstellen eine „Software-FMEA„. Doch es gibt kein einheitliches Verständnis dessen, was eine Software-FMEA ist. Dieser Beitrag verschafft Klarheit und gibt Tipps, um die häufigsten Fehler zu vermeiden.
Details
Gesetze und Normen formulieren Anforderungen, wie Medizinproduktehersteller den Entwicklungsprozess festlegen und dokumentieren müssen. Diese Anforderungen prüfen Benannte Stellen bei Audits. Dieser Artikel zum Entwicklungsprozess gibt Ihnen Tipps zu dessen Gestaltung und zum Abgleich mit anderen Prozessen wie dem Risikomanagementprozess.
Details
Die Hersteller medizinischer Software müssen die gesetzlichen Anforderungen an die Software-Komponenten erfüllen, um ihre Produkte „zulassen“ zu dürfen. Dieser Artikel stellt diese Anforderungen vor und gibt 7 Tipps, wie diese schnell und einfach zu erfüllen sind.
Details