1. Definitionen
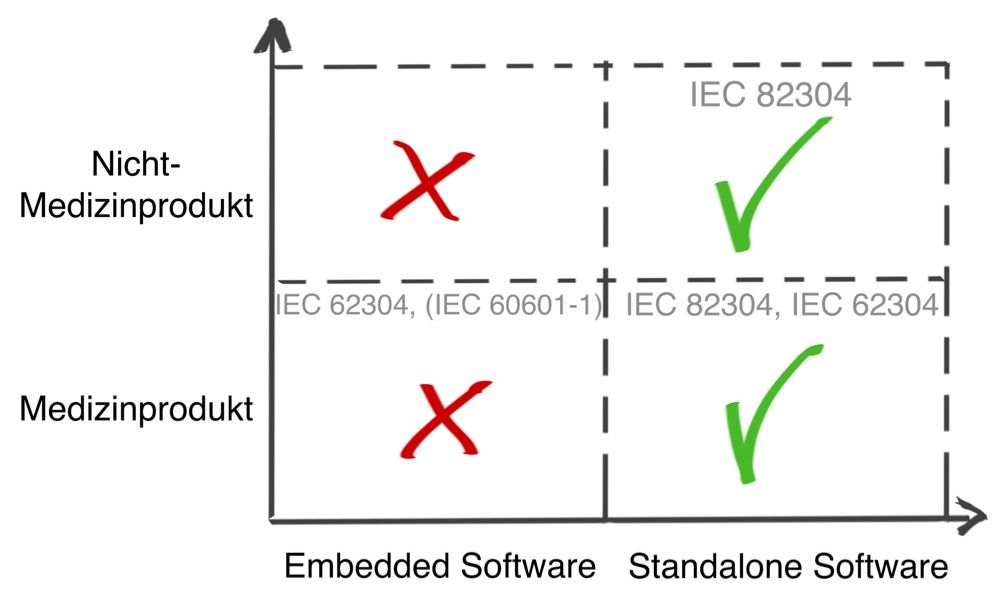
Zur medizinischen Software zählt alle Software, die für das Gesundheitswesen eingesetzt wird, insbesondere Software für Medizinprodukte bzw. Medizingeräte (Embedded Software) und Software, die selbst ein Medizinprodukt ist (Standalone-Software).
Die IEC/CD1 82304-1 (Health Software – Part 1: General requirements for product safety) unterscheidet folgende Begriffe:
- HEALTH SOFTWARE
Software intended to be used specifically for maintaining or improving health of individual persons, or the delivery of care
- MEDICAL SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device or intended to be a SOFTWARE MEDICAL DEVICE
- SOFTWARE MEDICAL DEVICE
Software intended to be a medical device in its own right
- MEDICAL DEVICE SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device
Damit wird klar, dass medizinische Software ein Medizinprodukt sein kann, aber nicht muss.
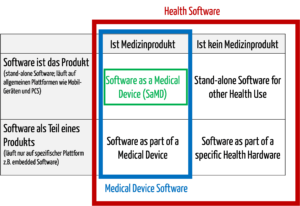
Abb. 1: Medizinische Software umfasst auch Medical Device Software und Software as a Medical Device (zum Vergrößern klicken).
Digital Health bzw. E-Health meint mehr als nur die Produkte, hier stehen die medizinischen Anwendungen und Geschäftsmodelle im Fokus.
2. Regulatorische Anforderungen
a) Medizinische Software – ein Medizinprodukt?
Es stellt sich oft die Frage, wann medizinische Software für die Medizintechnik der Definition des Begriffs Medizinprodukt entspricht. Eine weiterführende Diskussion dazu finden Sie im Artikel zur Klassifizierung von Software als Medizinprodukt sowie im Artikel zur Qualifizierung und Klassifizierung von IVD-Software.
b) Verordnungen, Gesetze, Normen
Software, die ein Medizinprodukt oder ein Teil dessen ist, muss die regulatorischen Anforderungen erfüllen:
- In Europa sind Medizinprodukteverordnungen (MDR, IVDR) relevant. Diese enthalten jedoch nur relativ allgemeine Vorschriften für Software, die dieser Fachartikel vorstellt.
- Die IEC 62304 definiert die Lebenszyklusprozesse für Software von Medizinprodukten.
- Die IEC 82304-1 ist bei jeder „Health Software“ anwendbar. Die IEC 82304-1 fordert auch Konformität mit den Anforderungen der IEC 62304.
- Es gibt zudem MDCG-Leitlinien z.B. die MDCG 2019-11 und die MDCG 2023-4.
- Die FDA stellt in ihren Guidance-Dokumenten spezifische Anforderungen, explizit auch an medizinische Software. Zudem beantwortete sie viele Fragen speziell zu Software as a Medical Device in diesem FAQ.
3. Unterstützung für Medizinproduktehersteller
Nutzen Sie die Unterstützung des Johner Instituts:
- Haben Sie Fragen zur Entwicklung und Zulassung von Medizinprodukte, die Software enthalten oder Software sind? Dann nutzen Sie das kostenfreie Micro-Consulting.
- Im Kompaktseminar Medizinische Software erwerben Sie die vorgeschriebenen Kompetenzen. Sie lernen die gesetzlichen Anforderungen an die Entwicklung von Software für die Medizintechnik kennen und erfüllen.
- Die Videotrainings des Auditgarant helfen Ihnen, Schritt für Schritt eine schlanke und IEC-62304-konforme „Software-Akte“ zu erstellen. Zusätzlich nimmt Ihnen ein vollständiger Satz an Templates viel Arbeit ab.
- Nutzen Sie auch die Unterstützung unserer Expertinnen und Experten. Sie helfen Ihnen, Ihre Software kurz, präzise und gesetzeskonform zu dokumentieren, und bereiten Sie auf Audits und „Tech File Reviews“ vor.
- Lassen Sie die IT-Sicherheit Ihrer Software durch Penetration Tests überprüfen.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.
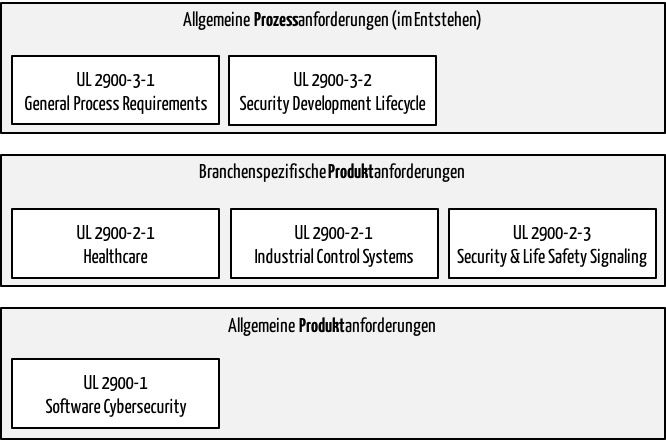
Der UL 2900-2-1 nennt sich „Particular Requirements for Network Connectable Components of Healthcare and Wellness Systems“. Er zählt zur UL-2900-Familie, der Normenfamilie zur IT-Security. Lesen Sie in diesem Artikel, welche Schwächen der Standard hat und unter welchen Umständen er Ihnen dennoch nützlich sein kann.
Details
Die IEC 62304 hat das Konzept der Sicherheitsklassifizierung eingeführt, damit Medizinproduktehersteller den Aufwand für die Software-Dokumentation an den Grad möglicher Schäden anpassen können, die durch einen Softwarefehler verursacht würden. Dieser Artikel hilft Ihnen, die Sicherheitsklassen zu bestimmen und IEC 62304 konform zu dokumentieren. Update: Keine Konformitätsvermutung mehr bei Sicherheitsklasse A? Mehr…
Details
Dieser Artikel beschreibt die Anforderungen der In-vitro Diagnostic Regulation IVDR an die Entwicklung und Dokumentation der Software. Die Anforderungen betreffen sowohl Software, die Teil eines IVDs ist (embedded Software), als auch Software, die selbst ein IVD darstellt (standalone Software). Ebenso finden Sie in diesem Beitrag einen Vergleich der Anforderungen der MDR und der IVDR an die Software.
Details
Legacy Software definiert die IEC 62304 in deren neuen Ammendment I als Software (Teil eines Medizinprodukts oder eigenständige Software), die zum damaligen Zeitpunkt legal in Verkehr gebracht wurde, aber heutigen Anforderungen (insbesondere der IEC 62304) nicht mehr genügt. Update: Abgrenzung von Legacy Software, SOUP und OTS
Details
Die IEC 62304 fordert in Kapitel 5.8 eine Software-Freigabe, auf Englisch „Software Release“. Besonders bei Herstellern von Standalone-Software beobachte ich häufig ein Missverständnis des Begriffs Software-Freigabe. Das kann regulatorisch zum Problem werden.
Die IEC 62304 definiert eine Anomalie als jeglichen Zustand, der abweicht von dem, was auf Grund von Anforderungsspezifikationen, Entwicklungsdokumenten, Normen usw. oder von Wahrnehmungen oder Erfahrungen zu erwarten ist. Anomalien können sich unter anderem beim Review, bei der Prüfung, der Analyse, der Kompilierung oder bei der Benutzung von Medizinprodukte-Software oder zugehöriger Dokumentation finden. Lesen Sie…
Details
Beim Internet der Dinge (engl. „Internet of Things“ kurz IoT) geht es um die digitale Vernetzung von physischen Objekten („things“) über das Internet (bzw. Internet-Technologien) mit dem Ziel, Prozesse zu automatisieren und zu optimieren. Von den Chancen, die das Internet der Dinge (IoT) ermöglicht, möchte auch das Gesundheitswesen bzw. die Medizin profitieren. Dabei sind dort…
Details
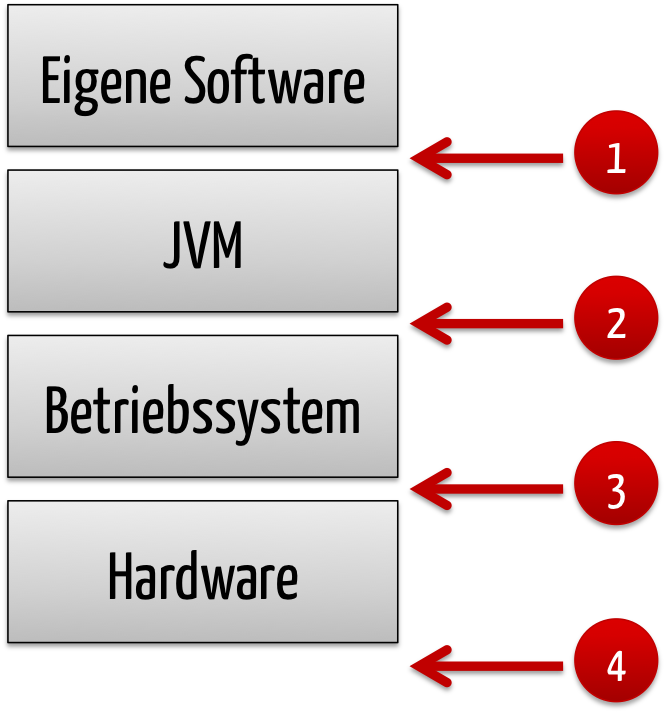
Java Virtual Machines (JVM) sind Software-Programme, die Hardware und Betriebssysteme abstrahieren, indem sie Programmen eine virtuelle Betriebssystem- und Hardware-unabhängige Schicht zur Verfügung stellen. „Write once, run everywhere“ war einst der Slogan. Eine JVM ist somit eine Software. Aber ist eine Java Virtual Machine auch eine SOUP? Antworten finden Sie in diesem Beitrag.
Details
Die Baumusterprüfung zählt zu den Konformitätsbewertungsverfahren, die die Medizinprodukterichtlinie MDD (93/42/EWG) kennt. Auch die MDR hält an der Baumusterprüfung als einem der Konformitätsbewertungsverfahren fest. Doch ist die Baumusterprüfung auch für Software geeignet?
Die IEC 82304 liegt inzwischen vor. Ein guter Anlass, sich diese Norm zu „Health-Software-Products“ näher anzusehen.