1. Definitionen
Zur medizinischen Software zählt alle Software, die für das Gesundheitswesen eingesetzt wird, insbesondere Software für Medizinprodukte bzw. Medizingeräte (Embedded Software) und Software, die selbst ein Medizinprodukt ist (Standalone-Software).
Die IEC/CD1 82304-1 (Health Software – Part 1: General requirements for product safety) unterscheidet folgende Begriffe:
- HEALTH SOFTWARE
Software intended to be used specifically for maintaining or improving health of individual persons, or the delivery of care
- MEDICAL SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device or intended to be a SOFTWARE MEDICAL DEVICE
- SOFTWARE MEDICAL DEVICE
Software intended to be a medical device in its own right
- MEDICAL DEVICE SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device
Damit wird klar, dass medizinische Software ein Medizinprodukt sein kann, aber nicht muss.
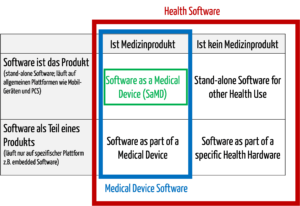
Abb. 1: Medizinische Software umfasst auch Medical Device Software und Software as a Medical Device (zum Vergrößern klicken).
2. Regulatorische Anforderungen
a) Medizinische Software – ein Medizinprodukt?
Es stellt sich oft die Frage, wann medizinische Software für die Medizintechnik der Definition des Begriffs Medizinprodukt entspricht. Eine weiterführende Diskussion dazu finden Sie im Artikel zur Klassifizierung von Software als Medizinprodukt sowie im Artikel zur Qualifizierung und Klassifizierung von IVD-Software.
b) Verordnungen, Gesetze, Normen
Software, die ein Medizinprodukt oder ein Teil dessen ist, muss die regulatorischen Anforderungen erfüllen:
- In Europa sind Medizinprodukteverordnungen (MDR, IVDR) relevant. Diese enthalten jedoch nur relativ allgemeine Vorschriften für Software, die dieser Fachartikel vorstellt.
- Die IEC 62304 definiert die Lebenszyklusprozesse für Software von Medizinprodukten.
- Die IEC 82304-1 ist bei jeder „Health Software“ anwendbar. Die IEC 82304-1 fordert auch Konformität mit den Anforderungen der IEC 62304.
- Es gibt zudem MDCG-Leitlinien z.B. die MDCG 2019-11 und die MDCG 2023-4.
- Die FDA stellt in ihren Guidance-Dokumenten spezifische Anforderungen, explizit auch an medizinische Software. Zudem beantwortete sie viele Fragen speziell zu Software as a Medical Device in diesem FAQ.
3. Unterstützung für Medizinproduktehersteller
Nutzen Sie die Unterstützung des Johner Instituts:
- Haben Sie Fragen zur Entwicklung und Zulassung von Medizinprodukte, die Software enthalten oder Software sind? Dann nutzen Sie das kostenfreie Micro-Consulting.
- Im Kompaktseminar Medizinische Software erwerben Sie die vorgeschriebenen Kompetenzen. Sie lernen die gesetzlichen Anforderungen an die Entwicklung von Software für die Medizintechnik kennen und erfüllen.
- Die Videotrainings des Auditgarant helfen Ihnen, Schritt für Schritt eine schlanke und IEC-62304-konforme „Software-Akte“ zu erstellen. Zusätzlich nimmt Ihnen ein vollständiger Satz an Templates viel Arbeit ab.
- Nutzen Sie auch die Unterstützung unserer Expertinnen und Experten. Sie helfen Ihnen, Ihre Software kurz, präzise und gesetzeskonform zu dokumentieren, und bereiten Sie auf Audits und „Tech File Reviews“ vor.
- Lassen Sie die IT-Sicherheit Ihrer Software durch Penetration Tests überprüfen.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.
FHIR ist inzwischen der Standard für den Datenaustausch im Gesundheitswesen. Moderne klinische Informationssysteme, viele Medizinprodukte und selbst Health-Apps kommen an FHIR nicht vorbei. FHIR steht für „Fast Healthcare Interoperability Resources“ und wird wie das englische „fire“ ausgesprochen. Dieser von HL7 ins Leben gerufene Standard soll alle „Use Cases“ abdecken: vom Abfragen von Versicherungsstammdaten über den…
Details
Die ISO/IEC TR 29119-6 soll dabei helfen, auch bei agilen Software-Projekten die Anforderungen der Normenfamilie ISO 29119 (also der anderen Familienmitglieder) zu erfüllen. Diesen Anspruch lässt sie bereits im Titel erkennen: „Guidelines for the use of ISO/IEC/IEEE 29119 (all parts) in agile projects“. Ob die Norm diesem Anspruch auch gerecht wird und ob Sie überhaupt…
Details
Ende 2020 veröffentlichte die ISO den Technical Report ISO/IEC TR 29119-11. Er trägt den Titel „Guidelines on the testing of AI-based systems“. Viele Firmen möchten wissen, wie sie ihre Produkte, die auf Verfahren der künstlichen Intelligenz (KI) basieren, nach dem Stand der Technik testen sollen. Daher hat sich die ISO/IEC TR 29119-11 auf den Weg…
Details
Der VDE hat mit der VDE-AR-E 2842-61 eine ganze Familie an normativen Vorgaben für vertrauenswürdige autonom kognitive Systeme wie z.B. KI-Systeme erarbeitet. Obwohl diese „Anwendungsregeln“ nicht spezifisch für eine Domäne wie z.B. Medizinprodukte sind, stellen sie dennoch eine Fundgrube für viele Medizinproduktehersteller dar. Dieser Artikel zeigt Ihnen, was KI-Systeme sind, welche Hersteller welche Teile dieser…
Details
Das Bundesdatenschutzgesetz fordert die Anonymisierung und Pseudonymisierung von personenbezogenen Daten. Was sich hinter den beiden Begriffen verbirgt und wie Sie die gesetzlichen Anforderungen erfüllen, erläutert dieser Artikel. Update: HIPAA Forderungen berücksichtigt
Details
Dass der Datenschutz bei medizinische Daten besonders wichtig ist, machen Gesetze wie das Bundesdatenschutzgesetz und das Strafgesetzbuch unmissverständlich klar. Lesen Sie in diesem Artikel, weshalb medizinische Daten eines besonderen Schutzes bedürfen, was die Besonderheiten des medizinischen Datenschutzes sind und welche Datenschutzgesetze zu beachten sind.
Details
Am 19. Februar 2020 hat die EU ein White Paper „On Artificial Intelligence – A European approach to excellence and trust” veröffentlicht. Dieser Beitrag verschafft einen schnellen Überblick über das 27-seitige Dokument und beleuchtet die Konsequenzen für Medizinproduktehersteller. Damit haben Hersteller die Möglichkeit, sich auf neue Anforderungen vorzubereiten oder sogar noch selbst oder über Interessenvertreter…
Details
Immer mehr Hersteller setzen Machine Learning Libraries wie scikit-learn, TensorFlow und Keras in ihren Produkten ein. Damit beschleunigen sie ihre Forschungs- und Entwicklungsvorhaben. Allerdings ist nicht allen Herstellern klar, welche regulatorischen Anforderungen sie bei Machine Learning Libraries nachweisen müssen und wie sie das am besten tun. Das führt dazu, dass sie unnötige Aufwände treiben oder…
Details
Medical Startups entstehen häufig in einem universitären bzw. klinischen Umfeld. Die Gründer verfügen oft über eine ausgezeichnete Produktidee, aber nur begrenzte finanzielle Mittel. Doch die Finanzen sind nur eine der Hürden, an denen fast alle Medical Startups scheitern.
Details
Wie Sie einen Software Change regulatorisch konform durchführen, erläutert die FDA in einem Guidance-Dokument. Sie beschreibt darin, wann Sie eine erneute 510(k) Einreichung (Premarket Notification) benötigen und wann Sie die Änderungen „nur“ dokumentieren müssen.
Details


