1. Definitionen
Zur medizinischen Software zählt alle Software, die für das Gesundheitswesen eingesetzt wird, insbesondere Software für Medizinprodukte bzw. Medizingeräte (Embedded Software) und Software, die selbst ein Medizinprodukt ist (Standalone-Software).
Die IEC/CD1 82304-1 (Health Software – Part 1: General requirements for product safety) unterscheidet folgende Begriffe:
- HEALTH SOFTWARE
Software intended to be used specifically for maintaining or improving health of individual persons, or the delivery of care
- MEDICAL SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device or intended to be a SOFTWARE MEDICAL DEVICE
- SOFTWARE MEDICAL DEVICE
Software intended to be a medical device in its own right
- MEDICAL DEVICE SOFTWARE
Software intended to be used specifically for incorporation into a physical medical device
Damit wird klar, dass medizinische Software ein Medizinprodukt sein kann, aber nicht muss.
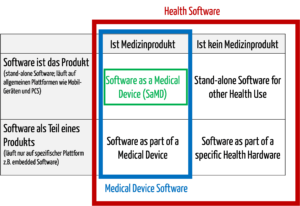
Abb. 1: Medizinische Software umfasst auch Medical Device Software und Software as a Medical Device (zum Vergrößern klicken).
2. Regulatorische Anforderungen
a) Medizinische Software – ein Medizinprodukt?
Es stellt sich oft die Frage, wann medizinische Software der Definition des Begriffs Medizinprodukt entspricht. Eine weiterführende Diskussion dazu finden Sie im Artikel zur Klassifizierung von Software als Medizinprodukt sowie im Artikel zur Qualifizierung und Klassifizierung von IVD-Software.
b) Verordnungen, Gesetze, Normen
Software, die ein Medizinprodukt oder ein Teil dessen ist, muss die regulatorischen Anforderungen erfüllen:
- In Europa sind Medizinprodukteverordnungen (MDR, IVDR) relevant. Diese enthalten jedoch nur relativ allgemeine Vorschriften für Software, die dieser Fachartikel vorstellt.
- Die IEC 62304 definiert die Lebenszyklusprozesse für Software von Medizinprodukten.
- Die IEC 82304-1 ist bei jeder „Health Software“ anwendbar. Die IEC 82304-1 fordert auch Konformität mit den Anforderungen der IEC 62304.
- Es gibt zudem MDCG-Leitlinien z.B. die MDCG 2019-11 und die MDCG 2023-4.
- Die FDA stellt in ihren Guidance-Dokumenten spezifische Anforderungen, explizit auch an medizinische Software. Zudem beantwortete sie viele Fragen speziell zu Software as a Medical Device in diesem FAQ.
3. Unterstützung für Medizinproduktehersteller
Nutzen Sie die Unterstützung des Johner Instituts:
- Haben Sie Fragen zur Entwicklung und Zulassung von Medizinprodukte, die Software enthalten oder Software sind? Dann nutzen Sie das kostenfreie Micro-Consulting.
- Im Kompaktseminar Medizinische Software erwerben Sie die vorgeschriebenen Kompetenzen. Sie lernen die gesetzlichen Anforderungen an die Software-Entwicklung kennen und erfüllen.
- Die Videotrainings des Auditgarant helfen Ihnen, Schritt für Schritt eine schlanke und IEC-62304-konforme „Software-Akte“ zu erstellen. Zusätzlich nimmt Ihnen ein vollständiger Satz an Templates viel Arbeit ab.
- Nutzen Sie auch die Unterstützung unserer Expertinnen und Experten. Sie helfen Ihnen, Ihre Software kurz, präzise und gesetzeskonform zu dokumentieren, und bereiten Sie auf Audits und „Tech File Reviews“ vor.
- Lassen Sie die IT-Sicherheit Ihrer Software durch Penetration Tests überprüfen.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.
Die ISO 27001 und die Informationssicherheitsmanagementsysteme (ISMS) werden bei ISO-13485-Audits immer häufiger zum Thema. Die Regularien geben dazu Anlass. Dazu zählt u.a. die Digitale-Gesundheitsanwendungen-Verordnung (DiGAV), die die ISO 27001 in den Fokus vieler Medizinproduktehersteller gerückt hat. Hersteller müssen die regulatorischen Anforderungen erfüllen, um Ärger mit Behörden und Benannten Stellen zu vermeiden und um Patienten nicht…
Weiterlesen
Dass der Datenschutz bei medizinische Daten besonders wichtig ist, machen Gesetze wie das Bundesdatenschutzgesetz und das Strafgesetzbuch unmissverständlich klar. Lesen Sie in diesem Artikel, weshalb medizinische Daten eines besonderen Schutzes bedürfen, was die Besonderheiten des medizinischen Datenschutzes sind und welche Datenschutzgesetze zu beachten sind. Inhaltsübersicht Wer Interesse an Ihren Daten hat » Besonderheiten des Datenschutzes im…
Weiterlesen
Am 19. Februar 2020 hat die EU ein White Paper „On Artificial Intelligence – A European approach to excellence and trust” veröffentlicht. Dieser Beitrag verschafft einen schnellen Überblick über das 27-seitige Dokument und beleuchtet die Konsequenzen für Medizinproduktehersteller. Damit haben Hersteller die Möglichkeit, sich auf neue Anforderungen vorzubereiten oder sogar noch selbst oder über Interessenvertreter…
Weiterlesen
Immer mehr Hersteller setzen Machine Learning Libraries wie scikit-learn, TensorFlow und Keras in ihren Produkten ein. Damit beschleunigen sie ihre Forschungs- und Entwicklungsvorhaben. Allerdings ist nicht allen Herstellern klar, welche regulatorischen Anforderungen sie bei Machine Learning Libraries nachweisen müssen und wie sie das am besten tun. Das führt dazu, dass sie unnötige Aufwände treiben oder…
Weiterlesen
Medical Startups entstehen häufig in einem universitären bzw. klinischen Umfeld. Die Gründer verfügen oft über eine ausgezeichnete Produktidee, aber nur begrenzte finanzielle Mittel. Doch die Finanzen sind nur eine der Hürden, an denen fast alle Medical Startups scheitern.
Weiterlesen
Wie Sie einen Software Change regulatorisch konform durchführen, erläutert die FDA in einem Guidance-Dokument. Inhaltsübersicht 1. Was ein Software Change ist » 2. Wann Sie neu einreichen müssen » 3. Change Requests » 4. Was Sie sonst beachten sollten » Sie beschreibt darin, wann Sie eine erneute 510(k) Einreichung (Premarket Notification) benötigen und wann Sie…
Weiterlesen
Das, was viele unter Zubehör verstehen, unterscheidet sich von der Definition des Begriffs im Medizinproduktegesetz. Dieser Artikel gibt Ihnen eine Übersicht über die Begriffsdefinition, die regulatorischen Anforderungen und typische Fragestellungen.
Weiterlesen
Elektronische Unterschriften und digitale Signaturen dürfen als gleichwertig zu handgeschriebenen Unterschriften („wet ink“) betrachtet werden. Welche Voraussetzungen dafür erfüllt sein müssen, hängt vom Grad der zu erreichenden Verbindlichkeit und damit vom Dokument ab, das unterschrieben werden soll. Inhaltsübersicht 1. Notwendigkeit einer Unterschrift » 2. Notwendigkeit von elektronischen Unterschriften » 3. Regulatorische Anforderungen » 4. Typen…
Weiterlesen
Die Parametrisierung von Software – man spricht in dem Kontext auch von Parametrierung, Customizing oder Konfiguration – führt regelmäßig zu Diskussionen z.B. über die Verantwortlichkeit und über die Abgrenzung zur Eigenherstellung. Dieser Artikel gibt Herstellern und deren Kunden wichtige Hinweise, auf was sie bei der Parametrisierung achten sollten und wie sie die üblichen Fallen vermeiden…
Weiterlesen
Krankenhaus-Informationssysteme als Systeme und Behandlungseinheiten unter Berücksichtigung der EuGH-Entscheidung vom 07.12.2017 (C-329/16) Software-Systeme in Krankenhäusern beinhalten neben der Funktion der reinen Datenspeicherung, Archivierung oder Suchfunktion auch Funktionalitäten, die zur Behandlung oder Therapiebestimmung dienen und daher als Medizinprodukt zu qualifizieren sind. Diese Software-Systeme werden oft zusammen als ein Krankenhaus-Informationssystem (KIS) betrieben.
Weiterlesen

