Die Risikomanagementakte ist ein Teil der Technischen Dokumentation, der dem Nachweis dient, dass ein Medizinprodukt die gesetzlichen Anforderungen an das Risikomanagement erfüllt.
Inhalt
Diese Seite fasst die wichtigsten Informationen zur Risikomanagementakte zusammen und verlinkt auf weiterführende Fachartikel.
- Regulatorische Anforderungen
- Inhalt der Risikomanagementakte
- Unterstützung beim Erstellen und Prüfen der Akte
1. Regulatorische Anforderungen
Die ISO 14971 verlangt eine Risikomanagementakte
Die ISO 14971, die Norm zum Risikomanagement bei Medizinprodukten, fordert in Kapitel 4.5, dass
„der Hersteller eine Risikomanagementakte anlegen und aufrechterhalten muss“.
Da die Norm unter der MDR und IVDR harmonisiert ist, repräsentiert sie den Stand der Technik und ist somit verbindlich.
Sie definiert den Begriff …
Die Norm definiert diesen Begriff wie folgt:
Definition: Risikomanagementakte
Satz von Aufzeichnungen und sonstigen Dokumenten, die beim Risikomanagement entstehen
Quelle: ISO 14971, 3.25
Welche Aufzeichnungen und Dokumente das sind, ergibt sich aus der Norm. Der zweite Abschnitt dieses Artikels fasst diese Inhalte zusammen.
… besteht aber nicht auf einer physischen Akte
Die Norm spricht nur von einem „Satz an Dokumenten und Aufzeichnungen“. Wie der Hersteller die Inhalte auf diese Aufzeichnungen und Dokumente verteilt und wie er Verzeichnisse erstellt, bleibt ihm überlassen.
Allerdings folgt aus den Forderungen der MDR, Anhang II (analog IVDR) nach einer „organisierten, leicht durchsuchbaren und eindeutigen Form“ der technischen Dokumentation:
- Die Akte muss elektronisch vorliegen (sonst lässt sie sich nicht leicht durchsuchen).
- Die Akte benötigt zumindest einen zentralen Einstiegspunkt, von dem aus sich leicht zu allen Inhalten navigieren lässt.
Hersteller können diese Inhalte sowohl in Dokumenten als auch in Werkzeugen verwalten. Die Benannten Stellen bestehen aber darauf, einen versionierten Snapshot bei sich ablegen zu können.
2. Inhalt und Form der Risikomanagementakte
Um den Anforderungen der ISO 14971 zu genügen, muss die Risikomanagementakte folgende Inhalte umfassen:
| Inhalt (inkl. Link) |
Beschreibung |
Dokumentation |
| Zweckbestimmung |
Zweckbestimmung und bestimmungsgemäßer Gebrauch einschließlich Charakterisierung der Nutzer, Nutzungsumgebung und Patienten |
Meist ist das ein eigenständiges Dokument. |
| Risikoakzeptanz |
Die Hersteller unterscheiden meist zwischen einer unternehmensweiten Risikopolitik und produktspezifischen Kriterien für die Risikoakzeptanz |
Die Risikopolitik ist entweder ein eigenständiges Dokument oder der Hersteller fasst sie mit den Risikoakzeptanzkriterien zusammen. Letztere drücken die Hersteller fast immer in Form einer Risikoakzeptanzmatrix aus.
Regelmäßig ist diese ein Bestandteil des Risikomanagementplans. |
| Risikomanagementplan |
Die Planung aller Aktivitäten und Rollen im Risikomanagement inklusive Personen, Zeitpunkte, Methoden und ggf. Werkzeuge |
Der Risikomanagementplan ist oft ein eigenständiges Dokument. Er kann angepasst werden und liegt dann in mehreren Versionen vor. |
| Risikoanalyse |
Beschreibung der einzelnen Gefährdungen mit Ursachen und Risiken, d. h. Kombinationen und Schweregrade möglicher Schäden |
Die Risikoanalyse umfasst fast immer eine Tabelle („Risikotabelle“) mit den Spalten ID, Ursache, Gefährdung bzw. Gefährdungssituation oder/und Schaden, Wahrscheinlichkeit, Schweregrad, Risiko.
Kommentare oder weitere Erläuterungen notieren die Hersteller in der Tabelle oder in einem eigenständigen Dokument. |
| Risikobeherrschung |
Beschreibung der Maßnahmen und Nachweise, dass diese Maßnahmen implementiert wurden und wirksam sind |
Diese Maßnahmen lassen sich in der „Risikotabelle“ dokumentieren. Dazu fügen Hersteller weitere Spalten ein für die Maßnahmen und für Verweise auf die Verifizierungen, z. B. Tests.
Auch hier notieren die Hersteller Kommentare oder weitere Erläuterungen in der Tabelle oder einem eigenständigen Dokument. |
| Risikomanagementbericht |
Zusammenfassende Bewertung des Nutzen-Risiko-Verhältnisses und Ergebnisse der Überprüfung, ob der Plan eingehalten wurde |
Dieser Bericht liegt fast immer als eigenständiges Dokument vor. |
3. Unterstützung
Haben Sie noch Fragen zur Risikomanagementakte oder zum Risikomanagement im Allgemeinen? Antworten erhalten Sie in unserem kostenlosen Micro-Consulting.
Im Seminar „Risikomanagement & ISO 14971“ lernen Sie die gesetzlichen Anforderungen an das Risikomanagement kennen und erfüllen.
Der Auditgarant zeigt Ihnen anhand von Videotrainings, wie Sie Schritt für Schritt eine schlanke und ISO-14971-konforme Risikomanagementakte erstellen. Zusätzlich nimmt er Ihnen mit einem vollständigen Satz an Templates für eine Risikomanagementakte viel Arbeit ab.
Nutzen Sie auch das Wissen der Expertinnen und Experten des Johner Instituts. Das Risikomanagement-Team hilft Ihnen, Ihre Akten zu schreiben oder zu prüfen und bereitet Sie auf Audits und Reviews vor.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ gelingt und Ihre Produkte schnell in den Markt kommen.
MDR und IVDR fordern von den Medizinprodukteherstellern entweder einen Post-market Surveillance Report („Bericht über die Überwachung nach dem Inverkehrbringen“) oder einen Periodic Safety Update Report („Regelmäßig aktualisierter Bericht über die Sicherheit“). Den Periodic Safety Update Report kürzt man meist als „PSUR“ ab, den Post-market Surveillance Report als „PMS-Report“.
Details
Die dritte Ausgabe der ISO 14971 steht seit Dezember 2019 bereit. Die neue Version der ISO 14971 wurde als ISO 14971:2019 publiziert. Sie ist eine evolutionäre Weiterentwicklung der ISO 14971:2007 und bricht nicht mit den bisherigen Konzepten. Hersteller sollten sich mit den neuen und geänderten Anforderungen dieser Norm vertraut machen. Noch im Dezember…
Details
Unter Software-Risikomanagement verstehen Hersteller von Medizinprodukten entweder das Risikomanagement, das sie für die Standalone-Software betreiben müssen, oder den Teil des Risikomanagements, den eine embedded Software nach sich zieht. Regelmäßig werden Hersteller den regulatorischen Anforderungen an das Software-Risikomanagement nicht gerecht. Dieser Beitrag gibt Tipps für ein schlankes Software-Risikomanagement, mit dem Sie unnötige Aufwände vermeiden und Konformität…
Details
Das Common Vulnerability Scoring System CVSS dient in der IT Security nicht nur der Klassifizierung des Schweregrads von Software-Schwachstellen. Dieses CVSS-Framework wird auch genutzt, um diese Schwachstellen zu charakterisieren und einheitlich zu einzuschätzen. Lernen Sie dieses Common Vulnerability Scoring System CVSS verstehen und damit die Meldungen der NIST. Diese Meldungen sollten Sie als Hersteller (z.B.…
Details
Der Begriff „kritische Bauteile“ wird häufig im Kontext der IEC 60601-1 verwendet. Beispielsweise sei eine „Liste kritischer Bauteile“ zu erstellen. Auch wenn die Norm den Begriff „kritisches Bauteil“ weder verwendet noch definiert, gibt es Gründe, eine solche Liste an Bauteilen zu führen. Inhaltsübersicht Begriff und Beispiele » Regulatorische Anforderungen » Wann ist eine Komponente kritisch?…
Details
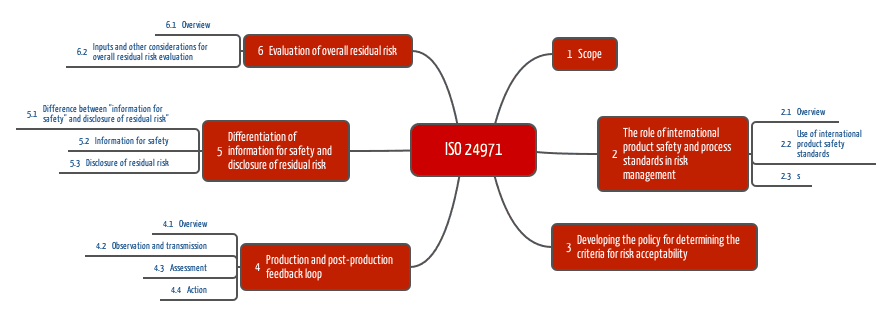
Die ISO 24971 ist die Norm, die meine Auditoren-Kollegen oft zücken, wenn es mit Medizinprodukte-Hersteller Diskussionen über die Auslegung der ISO 14971 gibt. Sie kennen die ISO 24971 nicht? Sie möchten diese Norm nicht kaufen? Kein Problem, ich habe diese Technical Report für Sie gelesen und zusammengefasst.
Details
Die Risikoanalyse bei Software unterscheidet sich: Software selbst kann keine Schäden verursachen. Dies geschieht immer via Hardware oder Menschen. Doch das heißt nicht, dass es keiner Risikoanalyse bei Software bedarf. Im Gegenteil!
Die Fault Tree Analysis, auf deutsch Fehlerbaumanalyse, ist ein Verfahren, um zu bekannten Wirkungen (bei Medizinprodukten Schäden oder Gefährdungen) unbekannte Ursachen zu suchen. Daher zählt sie bei der Risikoanalyse als Top-Down-Verfahren Fault Tree Analysis: Notation Bereits der Name Fault Tree Analysis macht klar, wie man sie grafisch repräsentiert: Als Baum. Sowohl Mindmaps als auch Ishikawa (Fischgräten-Diagramme) sind solche Baumstrukturen. Allerdings erlauben…
Details