Die FDA stellt klare Anforderungen an das Human Factors Engineering (HFE) bzw. Usability Engineering von Medizinprodukten.
- Doch für welche Produkte gelten diese Anforderungen?
- Welche regulatorischen Dokumente müssen Sie kennen?
- Und wie setzen Sie die FDA-Vorgaben an das Human Factors Engineering praktisch um?
Dieser Artikel gibt Ihnen einen vollständigen Überblick über die FDA-Anforderungen zur Gebrauchstauglichkeit und zeigt, wie Sie diese erfolgreich in Ihrer Produktentwicklung umsetzen.
1. Einführung
1.1 Wann müssen Sie die FDA-Anforderungen an Human Factors erfüllen?
Die FDA-Vorgaben zum Human Factors Engineering gelten nicht pauschal für alle Medizinprodukte. Die Anforderungen hängen von verschiedenen Faktoren ab:
1.1.1 Produktklassifizierung und Software
Grundsätzlich müssen alle Produkte die Anforderungen an die Gebrauchstauglichkeit erfüllen, d.h. es muss immer ein Usability Engineering File (UEF) bzw. Human Factors Engineering Report (HFE-Report) vorhanden sein. D.h. aber nicht, dass auch eine Human Factors Evaluation (also Studien) notwendig sind.
Die Aussage, dass das UEF für Class-I-Produkte nicht notwendig sei, ist somit nicht korrekt. Vielmehr würde im UEF mit dem niedrigen Risiko begründet, dass keine Human Factors Validation (summative Evaluation) notwendig ist.
Die FDA leitet die HFE-Anforderungen aus den Quality System Regulations (QSR) ab, insbesondere aus:
- Design Input: „Address the intended use of the device, including the needs of the user and patient“
- Design Validation: „Ensure that devices conform to defined user needs and intended uses“
1.1.2 Risiko durch Use Errors
Die FDA fordert das Human Factors Engineering explizit, wenn die Risikoanalyse zeigt, dass Anwendungsfehler zu schwerwiegenden Schäden (serious harm) führen können.
Serious Harm: Die FDA versteht darunter Tod, schwere Verletzungen oder schwerwiegende unerwünschte Ereignisse, die aus der Nutzung oder Fehlnutzung des Medizinprodukts resultieren können. („Includes both serious injury and death„)
Serious injury: An injury or illness that is life-threatening, results in permanent impairment of a body function or permanent damage to a body structure, or necessitates medical or surgical intervention to preclude permanent impairment of a body function or permanent damage to a body structure. Permanent means irreversible impairment or damage to a body structure or function, excluding trivial impairment or damage.
In diesem Fall müssen Human Factors Daten in der Premarket Submission (PMA, 510(k)) eingereicht werden.
1.1.3 Spezifische Produktkategorien
Für bestimmte Hochrisiko-Produkte ist das HFE obligatorisch. Die FDA hat eine Liste von Produkten veröffentlicht, bei denen sie Human Factors als besonders kritisch einstuft:
- Beatmungsgeräte
- Dialysegeräte
- Infusionspumpen
- Defibrillatoren
- Blutglukose-Messgeräte
- und weitere Produkte
Die vollständige Liste finden Sie im FDA Guidance Document „List of Highest Priority Devices for Human Factors Review“.
Hinweis: Dieses Dokument wird durch das neue Guidance „Content of Human Factors Information in Medical Device Submissions“ ersetzt, das noch im Draft-Status ist.
1.1.4 FDA-Ermessen
Die Behörde kann HFE-Daten auch in folgenden Situationen anfordern:
- Bei Produktänderungen
- Nach gemeldeten Problemen
- Bei bestimmten Zulassungsverfahren (insbesondere PMA)
- Bei Änderung der Nutzergruppe
Bei Unsicherheiten empfiehlt die FDA eine Presubmission (Q-Submission), um vorab zu klären, welche HFE-Aktivitäten für Ihr spezifisches Produkt erforderlich sind. Dies kann Zeit und Kosten in der späteren Zulassung sparen.
1.2 Regulatorischer Rahmen: Diese Dokumente müssen Sie kennen
Die FDA-Anforderungen an Human Factors basieren auf einem umfassenden regulatorischen Framework:
1.2.1 Verbindliche Regularien
- 21 CFR part 820.30 (Design Controls): Definiert grundlegende Anforderungen an Design Input und Design Validation
- Quality System Regulations (QSR): Übergeordnete Qualitätssystem-Anforderungen
Der 21 CFR part 820, insbesondere der part 820.30 werden im Rahmen der Umstellung auf die Quality System Management Regulations durch die ISO 13485 abgelöst.
1.2.2 Anerkannte Standards
- IEC 62366-1:2015: Internationale Norm zum Usability Engineering Process
- AAMI/ANSI HE75:2009: Human Factors Engineering – Design of Medical Devices
- ISO 14971:2007: Risikomanagement
Die neue Draft Guidance „Content of Human Factors Information in Medical Device Submissions“ verweist auf „ANSI/AAMI/ISO 14971:2019 Medical devices—Application of risk management to medical devices“. Bei der Dokumentation sollten Sie dies berücksichtigen und ggf. Unterschiede zur aktuellen Version dokumentieren.
1.2.3 FDA Guidance Documents
Die FDA hat zwei zentrale Leitdokumente zum Human Factors Engineering veröffentlicht:
1. „Applying Human Factors and Usability Engineering to Medical Devices„ (Februar 2016)
- Beschreibt den HFE-Prozess
- Definiert Methoden und Aktivitäten
- Legt Validierungsanforderungen fest
2. „Content of Human Factors Information in Medical Device Submissions„ (Dezember 2022, Draft)
- Spezifiziert einzureichende Dokumente
- Führt risikobasierte Kategorisierung ein
- Ersetzt frühere Priorisierungslisten
Das zweite Dokument ergänzt und präzisiert das erste. Es ersetzt spezifisch die Kapitel 3 (Definitions), 9 (Documentation) und Annex A (HFE/UE Report) des ersten Dokuments. Beide müssen daher zusammen betrachtet werden.
1.3 Human Factors vs. Usability Engineering: Begriffsklärung
Die FDA definiert HFE als „Application of knowledge about human behavior, abilities, limitations, and other characteristics to the design of medical devices (including software), systems and tasks to achieve adequate usability.“
Die FDA verwendet die Begriffe Human Factors Engineering und Usability Engineering weitgehend synonym:
- Human Factors Engineering (HFE): Traditioneller FDA-Begriff, betont die Sicherheitsaspekte
- Usability Engineering: International gebräuchlicher Begriff (IEC 62366-1)
In Ihrer Dokumentation können Sie beide Begriffe verwenden. Wichtig ist, dass Sie konsistent bleiben und bei der ersten Verwendung klarstellen, dass Sie die Begriffe synonym verwenden.
Kernpunkt: Bei beiden Ansätzen geht es primär um Risikominimierung durch gebrauchstaugliche Gestaltung, nicht um Marktattraktivität oder Kundenzufriedenheit.
2. Der HFE-Prozess nach FDA
Die FDA beschreibt einen systematischen Prozess für das Human Factors Engineering, der sich stark am Risikomanagement orientiert. Dieser Prozess stellt sicher, dass Nutzungsrisiken frühzeitig erkannt und minimiert werden.
2.1 Überblick über den HFE-Prozess
Der Human Factors Engineering Prozess der FDA folgt einem iterativen Ansatz, der parallel zur Produktentwicklung läuft:

Der FDA Human Factors Engineerng Prozess orientiert sich am etablierten Risikomanagement nach ISO 14971, fokussiert aber speziell auf nutzungsbedingte Risiken. Im Gegensatz zur IEC 62366-1 beschreibt die FDA weniger den Prozess selbst, sondern mehr die konkreten Aktivitäten und Methoden.
Die vier Hauptphasen des Prozesses sind:
- User Research (Nutzer, Nutzungsumgebung und User Interface)
- Risikoanalyse und Identifikation kritischer Aufgaben
- Formative Evaluation während der Entwicklung & Risikominimierung
- Validierung der Gebrauchstauglichkeit – Human Factors Validation Testing
2.2 Phase 1: User Research
Die FDA fordert, alle relevanten Merkmale der Nutzer, Nutzungskontexte und der Benutzeroberfläche systematisch zu erfassen und zu dokumentieren.
- Nutzer: Berücksichtigt werden müssen alle intendierten Nutzergruppen, wie Fachpersonal (z. B. Ärztinnen und Ärzte, Pflegekräfte), technisches Personal (z. B. Wartung, Installation, Reinigung) sowie Laiennutzer, Patient:innen und deren Angehörige. Entscheidend sind dabei Eigenschaften wie physische und sensorische Fähigkeiten, kognitive Voraussetzungen, Erfahrungsstand, Sprach- und Lesekompetenz sowie Motivation und Schulungsgrad.
- Nutzungskontexte: Die Analyse umfasst alle Einsatzorte des Produkts (z. B. Klinik, OP, häusliche Umgebung, Notfalleinsatz) und deren Bedingungen. Typische Einflussfaktoren sind Licht- und Lärmverhältnisse, räumliche Gegebenheiten, mögliche Ablenkungen oder Notfallsituationen.
- Benutzeroberfläche: Alle Elemente der Interaktion müssen betrachtet und beschrieben werden – vom physischen Gerätedesign und Bedienelementen über Displays, Alarme und Softwareoberflächen bis hin zu Gebrauchsanweisungen und Training. Entscheidend ist, dass die Bedienlogik den Erwartungen und Fähigkeiten der Nutzer entspricht und Fehler aktiv verhindert werden.
Nutzen Sie Methoden wie Interviews, Beobachtungen und Fokusgruppen, um ein realistisches Bild der Nutzer und ihrer Arbeitsumgebung zu erhalten. Nur so können nutzungsbedingte Risiken frühzeitig identifiziert und adressiert werden.
Die Berücksichtigung der Nutzer, Nutzungskontexte und Benutzeroberfläche bildet die Basis für ein gebrauchstaugliches und sicheres Medizinproduktdesign. Die Analyse der Nutzer und Nutzungsumgebungen zieht sich dabei als roter Faden durch die gesamte Risikoanalyse: Sie bildet die Grundlage zur Identifikation von kritischen Aufgaben (Critical Tasks) und muss eng mit der Risikoanalyse verknüpft werden. Nur so ist gewährleistet, dass für jede kritische Aufgabe die jeweils relevanten Nutzergruppen definiert werden können. Dies ist essenziell, um gezielt die richtigen Probanden für die spätere Human Factors Validierung auf Basis der Critical Tasks auszuwählen.
Die sorgfältige Dokumentation der User Research ist nicht nur für die spätere Risikoanalyse und Validierung unerlässlich, sondern wird von der FDA explizit in der Submission gefordert. Dabei müssen die Variabilität und potenziellen Einschränkungen aller Nutzergruppen sowie die realen Umgebungsbedingungen im gesamten Entwicklungsprozess berücksichtigt werden.
2.3 Phase 2: Risikoanalyse und Identifikation kritischer Aufgaben
2.3.1 Fokus auf sicherheitsrelevante Aufgaben
Die FDA fordert zunächst die Identifikation aller sicherheitsrelevanten Aufgaben (Tasks) am System. Dieser aufgabenorientierte Ansatz deckt sich mit dem Konzept der IEC 62366-1.
Die FDA definiert eine kritische Aufgabe als „A user task which, if performed incorrectly or not performed at all, would or could cause serious harm to the patient or user, where harm is defined to include compromised medical care„, bei der ein Anwendungsfehler zu ernsthaften Schäden führen könnte.
2.3.2 Methoden zur Risikoanalyse
Die FDA nennt konkrete Methoden zur Identifikation und Analyse von Nutzungsrisiken:
- FMEA (Failure Mode and Effects Analysis): Systematische Analyse möglicher Fehler und deren Auswirkungen
- FTA (Fault Tree Analysis): Top-Down-Analyse von unerwünschten Ereignissen
- Aufgabenanalyse (Task Analysis): Zerlegung von Arbeitsabläufen in Einzelschritte
- Experten-Review: Bewertung durch Human Factors Spezialisten
- Kontextanalyse: Untersuchung der realen Nutzungsumgebung
- Interviews und Fokusgruppen: Direkte Befragung von Anwendern
Kombinieren Sie mehrere Methoden für eine umfassende Risikoanalyse. Die FDA empfiehlt besonders die Aufgabenanalyse als Basis, ergänzt durch FMEA für die systematische Fehlerbetrachtung.
2.3.3 Zu berücksichtigende Informationsquellen
Die FDA fordert explizit, folgende Quellen in die Risikoanalyse einzubeziehen:
- Rückmeldungen von Kunden und Anwendern
- Berichte vom Service, Verkaufspersonal und Trainern
- Ergebnisse vorausgegangener HFE-Studien (auch von Vorgängerprodukten)
- Wissenschaftliche Publikationen und Fachartikel
- Behördenmeldungen (FDA MAUDE-Datenbank, BfArM-Datenbank etc.)
Die FDA MAUDE-Datenbank (Manufacturer and User Facility Device Experience) enthält Berichte über unerwünschte Ereignisse mit Medizinprodukten und ist öffentlich zugänglich. Sie ist eine wertvolle Quelle für die Identifikation bekannter Nutzungsprobleme.
2.4 Phase 3: Formative Evaluation & Risikominimierung
2.4.1 Ziele der formativen Evaluation
Die FDA fordert formative Evaluationen während der Entwicklung mit folgenden Zielen:
- Ideen für Testszenarien der späteren Validierung generieren
- Gefährliche Situationen frühzeitig identifizieren
- Input für Verbesserungen der Benutzeroberfläche sammeln
- Besseres Verständnis möglicher Anwendungsfehler entwickeln
Die explizite Forderung nach formativen Evaluationen während des Designprozesses geht über die Anforderungen der IEC 62366-1 hinaus. Die FDA erwartet, dass Sie diese Aktivitäten dokumentieren und in Ihrer Submission zusammenfassen.
2.4.2 Methoden der formativen Evaluation
Die FDA nennt zwei Hauptmethoden:
- Durchführung mit repräsentativen Nutzern (nicht nur Experten)
- Systematisches Durchgehen von Aufgaben
- Identifikation von Verständnisproblemen und Fehlerquellen
Simulated Use Testing
- Tests mit Prototypen oder Mockups
- Simulation realistischer Nutzungsszenarien
- Beobachtung und Befragung der Testpersonen
Beginnen Sie mit einfachen Papier-Prototypen oder Mockups. Die FDA erlaubt ausdrücklich Tests an nicht-finalen Versionen. So können Sie früh und kostengünstig Erkenntnisse gewinnen.
2.4.3 Risikokontrollmaßnahmen
Während der formativen Evaluation identifizierte (unvertretbare) Risiken müssen die Hersteller minimieren. Die FDA folgt der etablierten Hierarchie der Risikokontrolle:
- Inhärent sicheres Design: Eliminierung oder Reduktion von Risiken durch das Design selbst
- Schutzmaßnahmen: Alarme, Warnungen, Sicherheitsmechanismen bei Produkt oder in Produktion
- Hinweise für die Anwendung: Gebrauchsanweisung, Labels, Training
Die FDA akzeptiert Risikominimierung durch Hinweise in der Gebrauchsanweisung nur, wenn Sie deren Wirksamkeit nachweisen können. Das gleiche gilt für das „Additional Training“.
Konkrete Beispiele für Designmaßnahmen:
- Vereinfachung von Arbeitsabläufen
- Eindeutige Kennzeichnung und Beschriftung
- Fehlertolerante Gestaltung (z.B. Rückgängig-Funktionen)
- Physische Barrieren gegen Fehlbedienung
- Konsistente Benutzerführung
2.5 Phase 4: Human Factors Validation Testing
2.5.1 Anforderungen an die Validierung
Die FDA stellt konkrete Anforderungen an die Human Factors Validation:
Praktische Definition: Die summative Bewertung der Gebrauchstauglichkeit mit dem finalen Produkt unter realistischen Bedingungen. Die IEC 62366-1 nennt dies „Summative Evaluation„.
Offizielle Definition der FDA: Testing conducted at the end of the device development process to assess user interactions with a device user interface to identify use errors that would or could result in serious harm to the patient or user. Human factors validation testing is also used to assess the effectiveness of risk management measures. Human factors validation testing represents one portion of design validation.
Kernforderungen:
- Alle kritischen Aufgaben müssen validiert werden
- Test mit vorher definierten Erfolgskriterien
- Nachweis, dass keine ernsten Nutzungsprobleme auftreten
- Erhebung objektiver Daten (Beobachtung) und subjektiver Daten (Befragung)
- Überprüfung der Effektivität („For the device to be considered to be optimized with respect to use safety and effectiveness“).
2.5.2 Testbedingungen und Teilnehmer
Produkt:
- Test mit dem endgültigen Produkt
- Einschließlich finalem Labeling (Gebrauchsanweisung, Beschriftungen)
- In der finalen Konfiguration
Teilnehmer:
- Repräsentative Nutzer aus allen relevanten Nutzergruppen
- Keine Mitarbeiter des Herstellers
- Mindestens 15 Teilnehmer pro Nutzergruppe
- Nutzer müssen aus den USA stammen: (Professionelle Nutzer müssen im US-amerikanischen Gesundheitssystem arbeiten, daher muss die Evaluation meist in den USA erfolgen. Es reicht nicht, US-Bürger in Deutschland zu rekrutieren, die nicht (mehr) im US-Gesundheitssystem tätig sind. Auch bei Laien-Anwender sollte der kulturelle Hintergrund berücksichtigt werden.
Planen Sie frühzeitig die Rekrutierung von US-Nutzern ein. Das Johner Institut kann Sie bei der Rekrutierung der Probanden, bei der Organisation und Durchführung von Usability-Tests mit US-amerikanischen Anwendern unterstützen.
Testumgebung:
- Repräsentative Nutzungsumgebung
- Realistische Bedingungen (Licht, Lärm, Ablenkungen)
- Training der Teilnehmer entsprechend dem realen Szenario
2.5.3 Dokumentation der Validierung
Die Validierung muss umfassend dokumentiert werden:
- Testprotokoll mit allen Aufgaben
- Erfolgskriterien und deren Begründung
- Beobachtungsprotokolle
- Auswertung aller Nutzungsprobleme
- Bewertung von Restrisiken
- Begründung, warum verbleibende Probleme akzeptabel sind
Die FDA erwartet eine detaillierte Diskussion aller beobachteten Nutzungsprobleme, auch wenn diese nicht zu Fehlern führten. Dies hilft der Behörde, die Gründlichkeit Ihrer Evaluation zu beurteilen.
3. FDA Human Factors Submission Requirements
Die FDA hat im Dezember 2022 mit dem Draft Guidance „Content of Human Factors Information in Medical Device Submissions“ klare Vorgaben gemacht, welche Human Factors Dokumente bei der Zulassung einzureichen sind. Der Umfang hängt dabei vom Risiko des Produkts ab.
3.1 Die drei Dokumentationskategorien
Die FDA unterscheidet drei Kategorien von Human Factors Dokumentation basierend auf dem Risiko des Produkts bzw. der Produktänderung:
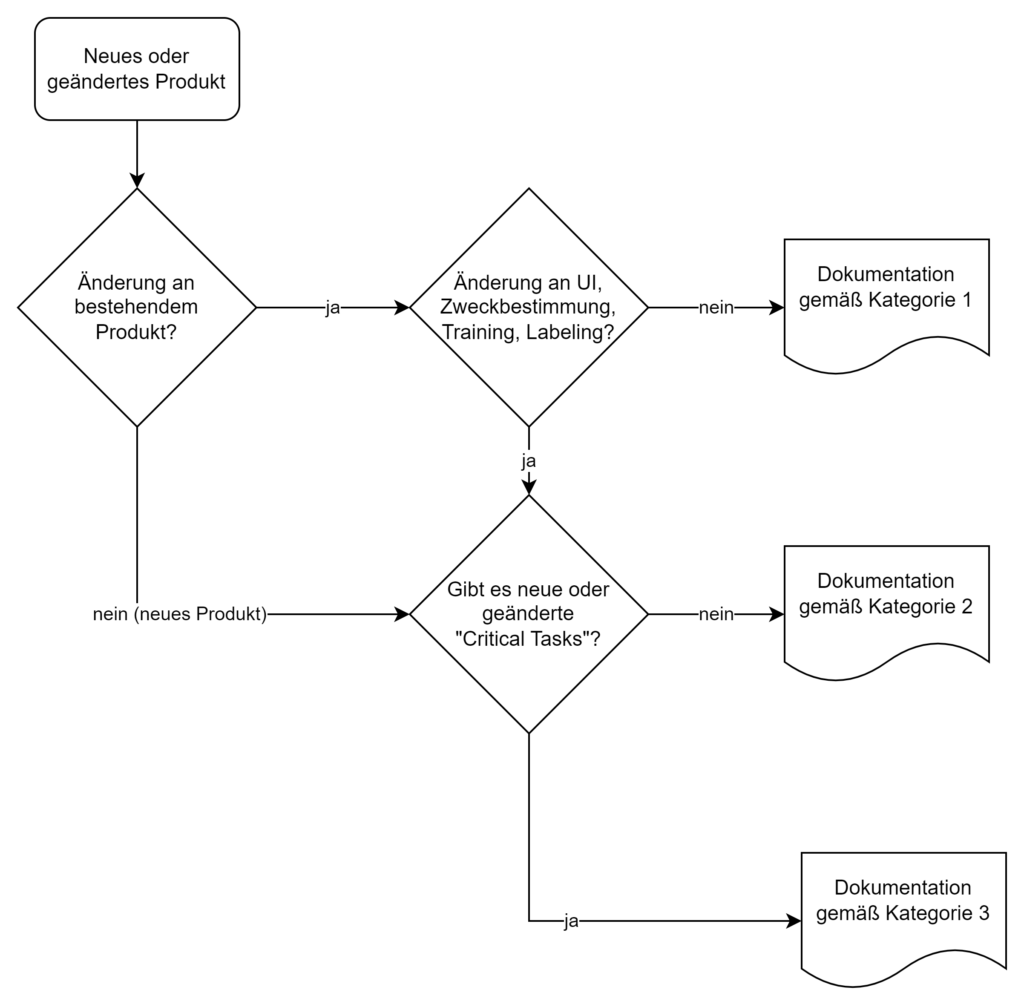
Diese Kategorisierung ersetzt die frühere „List of Highest Priority Devices for Human Factors Review“. Der neue risikobasierte Ansatz ermöglicht eine differenziertere Betrachtung und kann den Dokumentationsaufwand bei geringem Risiko reduzieren.
3.2 Umfang der einzureichenden Dokumente
3.2.1 Übersicht der Anforderungen nach Kategorie
| Dokumente | Kategorie 1 | Kategorie 2 | Kategorie 3 |
|---|---|---|---|
| HF-Zusammenfassung | ✓ | ✓ | ✓ |
| Beschreibung Zweckbestimmung | – | ✓ | ✓ |
| Beschreibung User Interface | – | ✓ | ✓ |
| Bekannte Nutzungsprobleme | – | ✓ | ✓ |
| Formative Evaluationen | – | – | ✓ |
| Risikoanalyse (HF-Fokus) | – | – | ✓ |
| Validierungsdetails | – | – | ✓ |
3.2.2 Kategorie 1: HF-Zusammenfassung
Für Kategorie 1 genügt eine kurze Zusammenfassung und ein Statement, dass es keine Änderungen am UI, der Zweckbestimmung, dem Training oder Lebeling gab, bzw. es ein Software-Bug-Fix im Backend war.
3.2.3 Kategorie 2: Moderate Dokumentation
Zusätzlich zur Zusammenfassung sind einzureichen:
Beschreibung der Zweckbestimmung:
- Intended User (Nutzergruppen und deren Charakteristika)
- Intended Use Environment (Nutzungsumgebung)
- Training-Anforderungen
Beschreibung des User Interface:
- Überblick über die Benutzerschnittstelle
- Hauptfunktionen und Bedienkonzept
- Screenshots oder Fotos der wichtigsten Screens/Bedienelemente
Zusammenfassung bekannter Nutzungsprobleme:
Diese Informationen können auch stammen aus:
- Post-Market-Daten von Vorgängerprodukten
- Literaturrecherche zu ähnlichen Produkten
- Erkenntnisse aus Kundenbeschwerden
Wichtig ist, dass die Risikoanalyse zeigt, dass die Änderungen keine kritischen Aufgaben betreffen oder neue entstehen. Dieses Statement sollte bei der Kategorisierung mit angegeben werden
3.2.4 Kategorie 3: Vollständige HF-Dokumentation
Für Hochrisikoprodukte fordert die FDA das komplette HF-Portfolio, d.h. zusätzlich zu den bereits genannten Dokumenten:
Zusammenfassung der formativen Evaluationen:
- Durchgeführte formative Tests
- Wichtigste Erkenntnisse
- Resultierende Designänderungen
Risikoanalyse mit HF-Fokus:
- Use-related Risk Analysis (URRA)
- Identifikation und Beschreibung der Critical Tasks
- Risikokontrollmaßnahmen
„Systematic use of available information to identify use related hazards and to estimate the use-related risk“.
Der Abnormal Use (absichtliche Fehlanwendung) ist out of scope ist aber ggf. Teil des vorhersehbaren Missbrauchs.
Details der HF-Validierung:
- Vollständiges Testprotokoll
- Teilnehmerdemografie
- Testergebnisse für alle kritischen Aufgaben
- Analyse und Bewertung aller Nutzungsprobleme
- Diskussion von Restrisiken
3.3 Struktur des HFE Reports
3.3.1 Empfohlener Aufbau nach FDA
Die FDA empfiehlt folgende Struktur für den Human Factors Engineering Report:
- Conclusion and high-level summary
- Aussage, dass Produkt sicher ist
- Zusammenfassung der Ergebnisse insbesondere Risiken
- Duchgeführte Aktivitäten
- Beschreibung der Nutzer, Nutzungsumgebung und Training
- Zuasammenfassung der Zweckbestimmung
- Nutzerprofile
- Nutzungsumgebung mit kritischen Faktoren
- Trainingskonzept und -materialien
- Beschreibung der Nutzungsschnittstelle
- Grafische Darstallung z.b. Fotos, Zeichnungen des Produkts
- Beschreibung der Interaktion von Benutzern mit dem Produkt (z.B. Abfolgen von Tätigkeiten)
- Begleitinformationen
- Ggf. Beschreibung der Änderungen
- Zusammenfassung bekannter Nutzungsprobleme
- Scope: Vorgängerprodukt, ähnliches Produkt
- Relevanz für das aktuelle Produkt
- Falls möglich Aussage, dass keine Nutzungsprobleme bekannt sind
- Beschreibung der Analyse z.B. formative Bewertung
- Methodenbeschreibung
- Wichtige Ergebnisse
- Folgende Designentscheidungen
- Risikoanalyse
- Mögliche Use Errors
- Gefährdungen
- Risiken und mögliche Schäden
- Beschreibung der kritischen Aufgaben
- Detaillierte Task-Beschreibungen
- Zugehörige Use Scenarios
- Änderungen am User Interface
- Details der HF-Validierung
- Studiendesign und Methodik
- Durchführung
- Ergebnisse
- Diskussion und Schlussfolgerungen
Nutzen Sie diese Struktur als Vorlage für Ihren Report. Die FDA-Reviewer erwarten diese Gliederung und können so effizient die benötigten Informationen finden.
3.3.2 Besondere Anforderungen an die Dokumentation
Klarheit über Critical Tasks: Die FDA wünscht ein eindeutiges Statement zum Vorhandensein oder Fehlen von Critical Tasks. Falls keine identifiziert wurden, muss dies klar begründet werden.
Restrisiko-Bewertung: Jedes verbleibende Nutzungsrisiko muss diskutiert und bewertet werden:
- Warum kann es nicht weiter reduziert werden?
- Warum ist es akzeptabel?
- Welche Post-Market-Maßnahmen sind geplant?
Das Johner Institut stellt eine kommentierte Version des FDA-Dokuments „Content of Human Factors Information in Medical Device Submissions“ zur Verfügung, die praktische Hinweise zur Umsetzung enthält.
Nachvollziehbarkeit: Die Dokumentation sollte so gestaltet sein, dass ein FDA-Reviewer ohne Rückfragen verstehen kann:
- Warum bestimmte Designentscheidungen getroffen wurden
- Wie Risiken identifiziert und kontrolliert wurden
- Warum das finale Design sicher und effektiv ist
Vermeiden Sie es, Informationen auf mehrere Dokumente zu verteilen. Die FDA bevorzugt einen konsolidierten HF-Report, der alle relevanten Informationen enthält. Verweise auf andere Dokumente sollten minimiert werden.
4. Praktische Umsetzung
Die erfolgreiche Umsetzung der FDA-Anforderungen erfordert einen strukturierten Prozess, der sowohl FDA- als auch IEC 62366-1-konform ist. Dieses Kapitel zeigt Ihnen, wie Sie die Anforderungen praktisch umsetzen.
4.1 Ein integrierter HFE-Prozess
4.1.1 Prozessvorschlag für FDA- und IEC-konforme Entwicklung
Der folgende Prozess erfüllt sowohl die FDA-Anforderungen als auch die der IEC 62366-1:

Dieser Prozess integriert die FDA-Phasen (User Research, Risikoanalyse, Formative Evaluation, Validierung) mit dem Usability Engineering Process der IEC 62366-1. So vermeiden Sie doppelte Arbeit und erfüllen beide Regularien gleichzeitig.
4.1.2 Schlüsselaktivitäten im Entwicklungsprozess
Frühe Entwicklungsphase:
- User Research und Kontextanalyse
- Erste Risikoanalyse (Use-Related Risk Analysis)
- Definition der Nutzergruppen und Use Environment
Konzeptphase:
- Identifikation kritischer Aufgaben
- Erste formative Evaluationen (z.B. mit Papierprototypen)
- Iterative Designverbesserungen
Detailentwicklung:
- Weitere formative Tests mit funktionsfähigen Prototypen
- Verfeinerung der Risikoanalyse
- Finalisierung der Risikokontrollmaßnahmen
Verifizierung und Validierung:
- Summative Evaluation / HF Validation Testing
- Bewertung von Restrisiken
- Finalisierung der HF-Dokumentation
Beginnen Sie die HF-Aktivitäten nicht erst kurz vor der Zulassung. Die FDA erwartet Nachweise über formative Evaluationen während der gesamten Entwicklung. Späte Änderungen sind teuer und verzögern die Markteinführung.
4.2 Integration von FDA und IEC 62366-1 Anforderungen
4.2.1 Terminologie-Mapping
Die unterschiedliche Terminologie kann verwirrend sein. Hier die wichtigsten Entsprechungen:
| FDA-Begriff | IEC 62366-1 Begriff | Erläuterung |
|---|---|---|
| Human Factors Engineering | Usability Engineering | Gesamtprozess |
| Critical Task | Hazard-Related Use Scenario | Die sicherheitskritische Aufgabe entspricht nicht ganz dem sicherheitsbezogenen Use Scneario. Vielmehr beinhaltet dieses Use Scenario den „critical task“ |
| HF Validation Testing | Summative Evaluation | Abschließende Validierung |
| Use Error | Use Error | Anwendungsfehler (Hinweis beachten) |
| Formative Evaluation | Formative Evaluation | Bewertung während Entwicklung |
Die FDA definiert Use Error als: User action or lack of action that was different from that expcted by the manufacturer and caused a result that (1) was different from the result exptected by the user and (2) was not caused solely by device failure and (3) did or could result in harm.
D.h. ohne einen möglichen Schaden ist ein Nutzungsfehler kein Use Error aus Sicht der FDA.
4.2.2 Dokumentations-Synergie
Ein cleverer Ansatz zur Dokumentation:
Ein Dokument – zwei Regularien:
- Erstellen Sie ein HF/Usability Engineering File
- Strukturieren Sie nach IEC 62366-1 Anforderungen
- Ergänzen Sie FDA-spezifische Elemente
- Erstellen Sie daraus den FDA HF Report
Die IEC 62366-1 fordert eine Usability Engineering Akte mit spezifischen Inhalten. Diese überschneiden sich zu zu großen Teilen mit den FDA-Anforderungen. Eine geschickte Strukturierung spart erheblichen Dokumentationsaufwand.
4.3 Besonderheiten und praktische Tipps
1. US-Nutzer frühzeitig einplanen:
- FDA fordert Tests mit US-amerikanischen Nutzern
- Rekrutierung kann zeitaufwändig sein
- Kulturelle Unterschiede beachten
2. Presubmission nutzen:
- Bei Unsicherheiten Q-Submission einreichen
- FDA gibt verbindliche Auskunft zu HF-Anforderungen
- Vermeidet teure Überraschungen
3. Realistische Testbedingungen:
- Nutzungsumgebung authentisch nachbilden
- Typische Störfaktoren einbeziehen
- Realistisches Training der Testnutzer
Dokumentieren Sie auch „close calls“ (i.e. Beinahefehler) und kleinere Probleme in der Validierung. Die FDA schätzt Transparenz und sieht darin einen Beleg für gründliche Tests.
4.4 Verfügbare Ressourcen und Unterstützung
4.4.1 FDA-Ressourcen
Guidance Documents:
- Applying Human Factors and Usability Engineering to Medical Devices
- Content of Human Factors Information in Medical Device Submissions
Datenbanken:
- MAUDE-Datenbank für gemeldete Nutzungsprobleme
- FDA Website mit Device-spezifischen Guidances
FDA-Kontakt:
- Q-Submission Program für Presubmissions
- Division of Human Factors im CDRH
4.4.2 Praktische Arbeitshilfen
Templates und Vorlagen: Das Johner Institut bietet verschiedene Arbeitshilfen:
- HF-Report Templates
- Protokollvorlagen für Validierungstests
- Kommentierte FDA-Dokumente
Im Auditgarant finden Sie vollständige Dokumentenvorlagen von den Use Scenarios über den Usability-Validierungs-Plan bis zum HF-Report. Diese sind bereits auf FDA-Konformität optimiert.
Fachbücher:
- „Usability als Erfolgsfaktor“ von Geis und Johner – speziell auf FDA und IEC 62366-1 ausgerichtet
- AAMI HE75 als umfassendes Nachschlagewerk
4.4.3 Externe Unterstützung
Wann externe Hilfe sinnvoll ist:
- Fehlende Erfahrung mit FDA-Submissions
- Bedarf an US-Nutzern für Tests
- Knappe interne Ressourcen
- Komplexe oder neuartige Produkte
Das Johner Institut bietet umfassende Usabillity-Services an einschließlich:
- Durchführung von Usability-Tests mit US-Nutzern
- Review der HF-Dokumentation
- Unterstützung bei Q-Submissions
- Training zu FDA Human Factors
Die Investition in professionelle Unterstützung zahlt sich oft aus. Eine verzögerte oder abgelehnte FDA-Zulassung kostet meist mehr als externe Beratung.
5. Zusammenfassung und Fazit
Die FDA-Anforderungen an Human Factors Engineering sind umfassend, aber gut strukturiert und nachvollziehbar. Mit dem richtigen Verständnis und systematischen Vorgehen lassen sich diese Anforderungen effizient erfüllen.
5.1 Die wichtigsten Erkenntnisse im Überblick
5.1.1 Regulatorische Klarheit
Die FDA hat mit ihren zwei Guidance-Dokumenten klare Vorgaben geschaffen:
- Der HFE-Prozess ist im Guidance „Applying Human Factors and Usability Engineering to Medical Devices“ definiert
- Die einzureichenden Dokumente sind im Guidance „Content of Human Factors Information in Medical Device Submissions“ spezifiziert
- Der risikobasierte Ansatz ermöglicht angemessenen Dokumentationsaufwand
5.1.2 Fokus auf Patientensicherheit
Die FDA-Philosophie ist eindeutig:
- Primäres Ziel: Minimierung von Risiken durch Anwendungsfehler
- Sekundär: Benutzerfreundlichkeit und Markterfolg
- Kernprinzip: Risikobasiertes Vorgehen bei allen Entscheidungen
Diese Priorisierung unterscheidet Medical Human Factors von kommerziellem UX-Design.
5.2 Erfolgsfaktoren für die FDA-Zulassung
5.2.1 Strategische Erfolgsfaktoren
1. Frühzeitiger Start: Human Factors Engineering ist kein „Add-on“ am Ende der Entwicklung, sondern integraler Bestandteil des Designprozesses.
2. Risikobasiertes Denken: Konzentrieren Sie Ihre Ressourcen auf die kritischen Aufgaben. Die FDA honoriert fokussierte Arbeit mehr als umfangreiche, aber oberflächliche Dokumentation.
3. Transparenz und Vollständigkeit: Dokumentieren Sie auch Probleme und deren Lösung. Die FDA schätzt einen offenen Umgang mit Herausforderungen.
Eine gut strukturierte und vollständige HF-Dokumentation kann den Review-Prozess der FDA um Wochen verkürzen. Investieren Sie in Qualität statt Quantität.
5.2.2 Operative Erfolgsfaktoren
Nutzen Sie die FDA-Ressourcen:
- Q-Submission für verbindliche Vorabklärungen
- MAUDE-Datenbank für bekannte Probleme
- Guidance-Dokumente als konkrete Anleitung
Planen Sie US-spezifische Anforderungen ein:
- US-Nutzer für Validierung
- US-Nutzungsumgebung berücksichtigen
- Kulturelle Unterschiede beachten
Dokumentieren Sie prozessbegleitend:
- Nicht erst am Ende zusammenschreiben
- Formative Evaluationen zeitnah dokumentieren
- Designentscheidungen begründet festhalten
5.3 Häufige Fehler und wie Sie sie vermeiden
5.3.1 Die Top 5 Fehler bei FDA HF-Submissions
- Zu spätes Human Factors Engineering
- Fehler: HF erst kurz vor Zulassung
- Lösung: Integration ab Projektstart
- Fehlende US-Nutzer bei Validierung
- Fehler: Tests nur mit europäischen Nutzern
- Lösung: Frühzeitige Planung der US-Tests
- Unvollständige Risikoanalyse
- Fehler: Fokus nur auf offensichtliche Risiken
- Lösung: Systematische Analyse aller Tasks
- Training als einzige Risikokontrolle
- Fehler: „Wir schulen das weg“
- Lösung: Design-basierte Maßnahmen priorisieren
- Fehlende formative Evaluationen
- Fehler: Nur finale Validierung
- Lösung: Iterative Tests während Entwicklung
Diese Fehler führen regelmäßig zu erheblichen Verzögerungen oder sogar zur Ablehnung von FDA-Submissions. Die Korrektur im Nachhinein ist immer aufwändiger als die richtige Durchführung von Anfang an.
5.4 Ausblick und Empfehlungen
Für Hersteller, die FDA-konforme Human Factors umsetzen wollen:
1. Bestandsaufnahme:
- Welche HF-Aktivitäten führen Sie bereits durch?
- Wo bestehen Lücken zu FDA-Anforderungen?
- Welche Ressourcen stehen zur Verfügung?
2. Prozessetablierung:
- HF in Entwicklungsprozess integrieren
- Verantwortlichkeiten festlegen
- Templates und Checklisten erstellen
3. Kompetenzaufbau:
- Mitarbeiter schulen
- Externe Expertise einbinden
- Von Best Practices lernen
Das Johner Institut bietet spezielle FDA Human Factors Trainings an, die alle Aspekte von der Planung über die Durchführung bis zur Dokumentation abdecken.
5.5 Abschließende Gedanken
Die FDA-Anforderungen an Human Factors Engineering mögen auf den ersten Blick komplex erscheinen. Mit dem richtigen Verständnis und systematischen Vorgehen sind sie jedoch gut handhabbar. Die Investition in professionelles Human Factors Engineering zahlt sich mehrfach aus:
- Schnellere FDA-Zulassung durch vollständige Dokumentation
- Sichere Produkte mit minimierten Anwendungsrisiken
- Zufriedene Nutzer durch durchdachte Gestaltung
- Reduzierte Haftungsrisiken durch nachgewiesene Sicherheit
Die gute Nachricht: Die Harmonisierung zwischen FDA-Guidances und IEC 62366-1 macht es heute einfacher denn je, global konforme Medizinprodukte zu entwickeln.
Sehen Sie Human Factors Engineering nicht als regulatorische Pflicht, sondern als Chance für bessere und sicherere Produkte. Die besten Medizinprodukte entstehen, wenn Sicherheit und Benutzerfreundlichkeit Hand in Hand gehen.
Fazit in einem Satz: Mit einem strukturierten Prozess, frühzeitiger Planung und fokussierter Umsetzung meistern Sie die FDA-Anforderungen an Human Factors Engineering sicher und effizient.
Das Johner Institut unterstützt Sie gerne bei der Umsetzung FDA-konformer Human Factors – von der Planung über die Durchführung von Tests mit US-Nutzern bis zur Erstellung der Zulassungsdokumentation. Kontaktieren Sie uns für eine unverbindliche Beratung.



