Wie Sie eine Benefit-Risk (Nutzen-Risiko) Abwägung durchführen sollen, verrät die FDA in einem „Guidance Document“.
| Inhaltsübersicht |
|---|
| Wie Ihnen das Dokument nützlich ist » |
| Wann Sie es beachten müssen » |
| Was das Dokument besagt » |
| Bewertung des Benefit-Risk Guidance » |
Dieses Guidance-Document zur Benefit-Risk-Abwägung ist nicht nur bei FDA-Zulassungen sehr hilfreich. Nutzen Sie es auch bei der abschließenden Nutzen-Risiko-Bewertung gemäß ISO 14971.
Wie Ihnen das „Benefit-Risk Guidance“ Dokument hilfreich ist – auch in Europa
Das Medizinprodukterecht gleicht sich in Europa und USA auch dahingehend, dass die zentralste Forderung lautet:
Das Gerät muss sicher sein. Etwaige Risiken müssen gemessen am Nutzen für den Patienten vertretbar sein.
Fast wörtlich formulieren das die Medizinprodukterichtline und der Food, Drug and Cosmetic Act (FD&C) in den USA.
Doch wie weist man nach, dass die Risiken gemessen am Nutzen vereinbar sind? Genau bei der Beantwortung dieser Frage hilft einem dieses Dokument: Es zeigt wie man eine Nutzen-Risiken-Bestimmung („benefit-risk determination“) durchführt. Damit haben Sie die Basis, um eine Risikoakzeptanzmatrix zu erstellen.
Das Dokument enthält als Leitfaden ein Template, das wir Ihnen als Word-Datei hier zum Download bereitstellen.
Sie können sich hier das Template herunterladen
Wann Sie das FDA Benefit-Risk Guidance Dokument beachten müssen
Laut FDA sollten Sie das Dokument immer dann beachten, wenn Sie eine „PMA-Zulassung“ (Pre Market Approval) oder gar einen „de novo classification request“ stellen. Das Dokument dürfte auch für 510(k)-Zulassung relevant sein.
Die FDA weitet den Scope sogar auf IDE (Investigational Device Exception) aus.
Man kann also etwas vereinfachend sagen: Immer wenn Sie ein Produkt in den USA in den Markt bringen wollen – es sei den es ist von der Zulassung befreit – sollten Sie das Benefit-Risk Guidance Document nicht nur lesen, sondern auch dessen Vorgaben erfüllen.
Was das FDA Benefit-Risk Guidance Dokument besagt
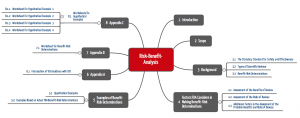
Aufbau des Dokument
Das Dokument ist in fünf Kapitel aufgeteilt.
Übersicht über die Kapitel
- Introduction: Hier sagt die FDA, wie verbindlich Sie das Dokument verstanden haben will.
- Scope: Das Dokument ist im Wesentlichen bei allen Einreichungen und Klassifizierungsanfragen zu berücksichtigen.
- Background: Die FDA betont, wie wichtig der wissenschaftliche (d.h. systematische und objektive) Nachweis ist sowohl des Nutzens als auch der Risiken. Dazu im nächsten Teilkapitel noch mehr.
- Factors: Das ist der eigentliche Inhalt. Hier legt die FDA dar, welche Faktoren bei der Nutzen-Risiko-Analyse zu beachten sind. Das übernächste Teilkapitel stellt Ihnen diese Faktoren vor.
- Examples: Konkrete (aber erfundene) Beispiele zeigen auf, wie die FDA für Produkte das Nutzen-Risiko-Verhältnis bestimmen und bewerten würde.
Wissenschaftliche Evidenz
Der Nachweis der Sicherheit und des Nutzens kann oft über klinische und nicht-klinische Daten erbracht werden.
Klinische Daten
- Klinische Studien
- Fallstudien
- Erfahrung
- Experimente and Leichen, Gewebe
Nicht-klinische Daten
- Tests z.B. Leistungsfähigkeit inkl.
- Biokompatibilität, Toxizität, Sterilität
- Mechanische Stabilität
- Elektrische Sicherheit und elektromagnetische Verträglichkeit
- Software-Tests
- Usability Validierung
- Tierversuche, Zellexperimente
- Computer-Simulationen
Allerdings geben diese Daten alleine keine ausreichende Auskunft über das Nutzen-Risiko-Verhältnis.
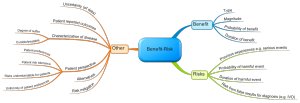
Faktoren, die Wesentliche Forderungen
Die FDA unterbreitet konkrete Vorschläge, welche Faktoren man bei der Nutzen-Risiken-Abwägung beachten sollte. Interessanterweise sind das nicht nur die Nutzen und Risiken.
Beispielsweise sollen auch Präferenzen der Patienten, die Verfügbarkeit von Alternativen oder die Zuverlässigkeit der Daten einbezogen werden.
Die FDA geht im Kapitel vier auf jeden dieser Faktoren ein. Sie begründet jeden und nennt Kriterien für dessen Bewertung. Diese finden sich dann auch im „Worksheet“, dem Template, das Sie sich hier herunterladen können.
Bewertung des Dokuments
Das Dokument zeichnet sich aus durch:
- Konkrete Anregungen, welche Faktoren bei einer Nutzen-Risiko-Analyse zu beachten sind – außer nur dem Nutzen und den Risiken
- Viele Beispiele
- Humor (Kannten Sie schon das Produkt, mit dem man alle Erinnerung abspeichern und dafür das Gehirn entfernen kann?)
- Hilfreiches Template
Weiteres FDA Guidance Document zur Benefit-Risk-Abschätzung
Die FDA hat eine weiteres „Guidance Document“ mit dem Titel „Factors to Consider Regarding Benefit- Risk in Medical Device Product Availability, Compliance, and Enforcement Decisions“ am 27.12.2016 veröffentlicht, das wir Ihnen in einem weiteren Beitrag vorstellen.