IEC 82304 – Was die Norm zu „Health Software“ fordert
Die IEC 82304 liegt inzwischen vor. Ein guter Anlass, sich diese Norm zu „Health-Software-Products“ näher anzusehen.
Zur medizinischen Software zählt alle Software, die für das Gesundheitswesen eingesetzt wird, insbesondere Software für Medizinprodukte bzw. Medizingeräte (Embedded Software) und Software, die selbst ein Medizinprodukt ist (Standalone-Software).
Die IEC/CD1 82304-1 (Health Software – Part 1: General requirements for product safety) unterscheidet folgende Begriffe:
Damit wird klar, dass medizinische Software ein Medizinprodukt sein kann, aber nicht muss.
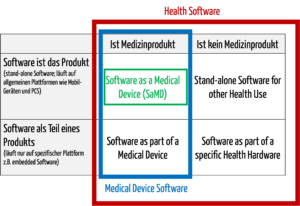
Abb. 1: Medizinische Software umfasst auch Medical Device Software und Software as a Medical Device (zum Vergrößern klicken).
Digital Health bzw. E-Health meint mehr als nur die Produkte, hier stehen die medizinischen Anwendungen und Geschäftsmodelle im Fokus.
Es stellt sich oft die Frage, wann medizinische Software für die Medizintechnik der Definition des Begriffs Medizinprodukt entspricht. Eine weiterführende Diskussion dazu finden Sie im Artikel zur Klassifizierung von Software als Medizinprodukt sowie im Artikel zur Qualifizierung und Klassifizierung von IVD-Software.
Software, die ein Medizinprodukt oder ein Teil dessen ist, muss die regulatorischen Anforderungen erfüllen:
Lesen Sie hier mehr zum Thema gesetzeskonforme Software-Entwicklung und IEC 62304. Beachten Sie auch den Podcast zum Thema medizinische Software. Beachten Sie auch den Artikel zu den klinischen Informationssystemen z.B. zu den Patientendaten-Managementsystemen (PDMS).
Nutzen Sie die Unterstützung des Johner Instituts:
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.
Die IEC 82304 liegt inzwischen vor. Ein guter Anlass, sich diese Norm zu „Health-Software-Products“ näher anzusehen.
Ein „detailliertes Design“ fordern sowohl die IEC 62304 als auch die FDA, jedoch ohne diesen Begriff präzise zu definieren. Lesen Sie hier, wie Sie die regulatorischen Anforderungen schnell und „auditsicher“ erfüllen können.
Ein Mock-Objekt hilft beim Integrationstest, Teile eines Software-Systems zu ersetzen bzw. zu simulieren, solange bis diese Teile schrittweise dem System hinzugefügt werden. Lesen Sie in diesem Artikel, wie sich Mocks von Dummies und Stubs unterscheiden und ob Sie ein Mock-Objekt auch verifizieren müssen.
DetailsUnter Code-Reviews versteht man das Prüfen des nicht kompilierten Quell-Codes durch weitere Personen beispielsweise im Rahmen von Inspektionen oder Walk-Throughs. Regulatorische Anforderungen an Code-Reviews Die IEC 62304 fordert keine expliziten Code-Reviews. Sie sieht aber Code-Reviews als eine Möglichkeit, um Software-Einheiten zu prüfen. Dabei müssen allerdings schriftliche Prüfkriterien für die Code-Reviews vorliegen, ebenso ist das Code-Review schriftlich…
DetailsDie Health Breach Notification Rule legt fest, wann Anbieter von Health Records welche Probleme mit der Datensicherheit an wen, in welcher Frist und in welcher Form melden müssen. Dieser Artikel verschafft Ihnen eine schnelle Übersicht über die Forderung der US-amerikanischen Federal Trace Commission (FTC).
Die Federal Trade Commission (FTC) ist eine US-amerikanische Behörde, deren Zielsetzung in der Wahrung des Wettbewerbsrechts und des Verbraucherschutzes liegt. Unter welchen Umständen Sie auch die Anforderungen der FTC beachten müssen und worin diese Anforderungen bestehen, lesen Sie in diesem Beitrag. Wie radikal die FTC auch bei Herstellern von Medical Apps vorgehen kann, zeigt der Fall Lumosity.
Details„Findet ein Software-Audit statt?“ lautet eine Frage, die mich über unser Micro-Consulting erreicht. „Und kann ich durch eine geeignete Wahl der Software-Sicherheitsklasse so ein Software-Audit vermeiden?“ Erst ist mir weder klar, was genau mit „Software-Audit“ gemeint, noch was die genaue Befürchtung ist. Doch dann verstehe ich und finde die Frage sehr bedeutsam für alle Medizinprodukte-Hersteller.
DetailsSoftware-Systemtest: Was versteht man genau darunter? Wann sind sie vorgeschrieben? Was sollten Software-Systemtests testen? Auf welche Fallen sollten Sie achten? Antworten gibt Ihnen dieser Beitrag.
Eine Schichtenarchitektur ist ein Architekturstil, der häufig bei Software-Systemen Anwendung findet. Vielen Herstellern sind die Nachteile eine mehrschichtigen Architektur und eines Denkens in Layern nicht bewusst.
Unter einem Hotfix verstehen die meisten Medizinprodukte-Hersteller die kurzfristige Behebung eines dringenden Software-Bugs. Bei diesen Hotfixes unterlaufen den Herstellern gravierende Fehler. Auch regulatorische. Lesen Sie hier, wie Sie die Software Ihrer Medizinprodukte durch einen Hotfix schnell und ohne Overhead aber dennoch gesetzeskonform updaten können.
Details