Medizinproduktehersteller, die ihren Sitz außerhalb der USA haben, benötigen einen U.S. Agent und einen „Official Correspondent“. Welche Anforderungen an einen U.S. Agent bzw. an einen „Official Correspondent“ gestellt werden, welche Aufgaben diese Rollen übernehmen müssen, erfahren Sie in diesem Beitrag.
1. Wann ein U.S. Agent benötigt wird
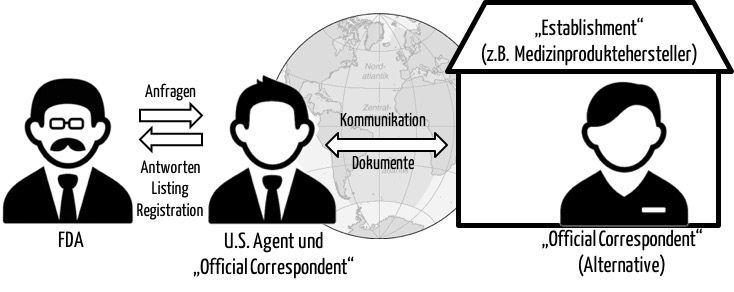
Sobald eine Firma außerhalb der USA ihren Sitz hat, aber Produkte in den USA in den Verkehr bringen will, benötigt sie einen U.S. Agent – genau einen. Die FDA spricht bei diesen Firmen von „Establishments“ und unterscheidet dabei u. a. folgende Typen:
- Medizinproduktehersteller
- Firmen, die Medizinprodukte überarbeiten
- Importeure
- Firmen, die Medizinprodukte neu verpacken oder beschriften
- Firmen, die Medizinprodukte für Dritte sterilisieren
- Hersteller, die Produkte entwickeln, aber nicht produzieren
Im Folgenden sind immer alle Typen von „Establishments“ gemeint, wenn von Hersteller gesprochen wird.
2. Aufgaben und Verantwortlichkeiten
a) U.S. Agents
Die U.S. Agents dienen als Kommunikationskanal zwischen der FDA und dem (im Ausland ansässigen) Medizinproduktehersteller. Wenn der Hersteller nicht direkt oder zeitnah reagiert, betrachtet die FDA Dokumente, die sie dem U.S. Agent übergibt, gleichzeitig auch als dem Hersteller übergeben.
Die U.S. Agents beantworten zudem Fragen, die die FDA an diese bzw. zu diesen Herstellern hat. Sie unterstützen die FDA auch dabei, Inspektionen des Herstellers durch die U.S. Behörde zu koordinieren.
Hingegen sind die U.S. Agents nicht dafür verantwortlich, Zwischenfälle der Behörde zu melden. Auch ist es nicht ihre Aufgabe, die Zulassungsunterlagen (z. B. 510(k) Premarket Notifications) einzureichen.
b) „Official Correspondents“
Ein „Official Correspondent“ ist eine Person, die vom Hersteller dazu bestimmt ist, die jährliche Registrierung des Unternehmens und das „Device Listing“ vorzunehmen und diese Informationen zu aktualisieren.
Der „Official Correspondent“ erhält – wie der Name vermuten lässt – die Korrespondenz der FDA.
3. Anforderungen an U.S. Agents und „Official Correspondents“
Der U.S. Agent muss seinen Firmensitz oder zumindest eine Dependance in den USA haben. Er benötigt eine physische Adresse, ein Postfach genügt nicht. Er muss während der üblichen Bürozeiten telefonisch erreichbar sein.
Für „Official Correspondents“ gelten diese Anforderungen nicht. Er kann direkt beim Hersteller (im US-Ausland) angesiedelt sein.
Viele Hersteller bestimmen die U.S. Agents gleichzeitig als „Official Correspondent“. Wahrscheinlich auch deshalb spricht die FDA auf manchen Webseiten davon, dass der U.S. Agent die Registrierung des Herstellers und das „Listing“ der Produkte vornimmt.
Die U.S. Agents und „Official Correspondents“ sind auf der Webseite der FDA veröffentlicht. Beide müssen sich mit Namen und Kontaktdaten registrieren. Sie sehen nachfolgend einen Auszug aus den herunterladbaren Textdateien am Beispiel von deutschen Herstellern:
U.S. Agent
REG_KEY|NAME|BUSINESS_NAME|BUS_PHONE_AREA_CODE|BUS_PHONE_NUM|BUS_PHONE_EXTN|FAX_AREA_CODE|FAX_NUM|EMAIL_ADDRESS 9057|SUSIE S CHEN|KARL STORZ ENDOSCOPY-AMERICA, INC.|424|2188201||424|2188519|[email protected] 8880|Robert Phillips|SIEMENS MEDICAL SOLUTIONS USA, INC.|302|6319702||610|4486487|[email protected]
“Official Correspondent”
REG_KEY|CONTACT_ID|FIRST_NAME|MIDDLE_INITIAL|LAST_NAME|SUBACCOUNT_COMPANY_NAME|PHONE_NUMBER 8875| 1018007|Robert|Z|Phillips|SIEMENS MEDICAL SOLUTIONS USA, INC.|x-302-2359839-x 64724| 14056482|Mike|-|Kelhart|Draeger, Inc|1-215-6602349-x
4. U.S. Agents finden und auswählen
a) Auswahlkriterien
Wenn Sie vor der Aufgabe stehen, einen U.S. Agent auswählen zu müssen, können Sie dies anhand der folgenden Kriterienliste vornehmen:
- Nachweisbare Erfahrung als U.S. Agent (und damit im Umgang mit der Behörde). Diese Erfahrung sollte spezifisch für Medizinprodukte vorhanden sein
- Verlässlichkeit
- Vertraulichkeit
- Erreichbarkeit (lässt sich stichprobenartig prüfen)
- Unabhängigkeit (s. u.)
- Ort bzw. Zeitzone (Ostküste ist etwas einfacher erreichbar)
- Kosten
b) Unabhängigkeit von U.S. Agents
Manche Hersteller wählen ihre Geschäftspartner wie z. B. Importeure oder Distributoren als U.S. Agent. Das Johner Institut rät davon ab:
- Der U.S. Agent muss unabhängig sein und nicht in einen Interessenskonflikt kommen.
- Konflikte zwischen Geschäftspartnern dürfen keinesfalls die Konformität der Firma und Ihres U.S. Agents mit den gesetzlichen Anforderungen (der FDA) beeinträchtigen.
- Der U.S. Agent muss im Zweifel vollen Zugriff auf die Dokumentation und damit vertrauliche Unterlagen haben. Diesen Zugriff wollen viele Hersteller den Geschäftspartnern gerade nicht gewähren, um ihr intellektuelles Eigentum zu schützen.
c) Finden von U.S. Agents
Eine Google-Suche nach „FDA US Agent Medical Device“ findet schnell zu Treffern. Auch die von der FDA publizierte Liste von U.S. Agents ist ein guter Startpunkt für eine Suche.
Das Johner Institut bietet ebenfalls diese Dienstleistung an und sichert den Marktzugang Ihrer Medizinprodukte in den USA.
5. Kosten für U.S. Agents
Die meisten Dienstleistungsanbieter offenbaren die Kosten nicht direkt. Falls ungewöhnlich viel Arbeit anfällt z. B. weil ein Rückruf gestartet werden muss oder die FDA eine Maßnahme anordnet, würden die Aufwände i. d. R. nach Stunden abgerechnet.
Das Johner Institut unterstützt auch im Fall solch einer „FDA Remediation“ d. h. bei der (notfallmäßigen) Umsetzung von Maßnahmen, um die Konformität wieder herzustellen.


Sehr geehrter Herr Prof. Dr. Johner,
vielen Dank für die Artikel hinisichtlich der Zulassungsanforderungen der FDA.
Ich hätte hierzu noch 1-2 Fragen:
Werden die Produkte ebenfalls über den U.S Agent verkauft oder ist dieser nur für die Kommunikation zwischen der FDA und dem Hersteller verantwortlich?
Gibt es einen Artikel für die diversen Vertriebswege in die USA? (Händler, eigene Niederlassung, etc.)
Ich meine gehört zu haben, dass der legal manufacturer in den USA sein muss und von dort die Produkte weiterverkauft. Dieser verfügt auch über alle Unterlagen wie dem DMR und DHF etc.
Über eine Antwort freue ich mich sehr.
Beste Grüße
Dainel
Guten Tag Daniel,
der U.S. Agent ist nicht für den Verkauf der Produkte zuständig und muss dabei nicht involviert werden. Ausländische Hersteller benötigen allerdings einen „Initial Importer“ („Any importer who furthers the marketing of a device from a foreign manufacturer to the person who makes final delivery or sale of the device to the ultimate consumer or user, but does not repackage, or otherwise change the container, wrapper, or labeling of the device or device package. The initial importer must have a physical address in the United States staffed by individuals responsible for ensuring the compliance of imported devices with all applicable FDA laws and regulations.“).
Der Legal Manufacturer muss nicht in den USA angesiedelt sein. Einen eigenen Artikel dazu haben wir bisher leider nicht verfügbar.
Freundliche Grüße
Luca Salvatore
Sehr geehrtes Johner Team,
habe ich es richtig, dass es in den USA keine Vorgabe gibt, den US Agent und/oder Distributor auf die Produktkennzeichnung zu vermerken (Vergleich EC-REP)?
Im Voraus vielen Dank für Ihre Antwort!
Beste Grüße,
Hugo
Guten Morgen Herr de Wit,
ganz genau. Der US Agent ist nicht gleichzusetzen mit einem EC-Rep, da der Agent keine Produkthaftung übernimmt. Der US Agent ist nicht auf der Produktkennzeichnung anzugeben. Der Distributor kann angegeben werden.
Viele Grüße
Luca Salvatore
Sehr geehrter Herr Salvatore,
vielen Dank für den Artikel über den U.S. Agent. Ich habe eine weitere Frage: unser US-Distributor ist auch gleichzeitig unser U.S. Agent. Nun aber wird eines unserer Produkte durch einen anderen Distributor verkauft. Man darf allerdings nur einen einzigen U.S. Agent ernennen. Ist nun Distributor 1 oder Distributor 2 verantwortlich für das Produkt?
Mit freundlichen Grüßen
Kim Heimhuber
Sehr geehrte Frau Heimhuber,
die Rolle Distributor ist unabhängig von der Rolle US Agent. Es reicht, einen US Agent zu benennen. Der US Agent ist zudem nicht verantwortlich/haftbar für ihr Produkt. Der US Agent dient hauptsächlich als Kommunikationskanal mit der FDA, falls der ausländische Hersteller nicht erreichbar sein sollte.
Beste Grüße
Luca Salvatore
Guten Tag Herr Salvatore,
Sie schreiben, dass Sie nicht empfehlen, einen Distributor als US Agent auszuwählen. Unter anderem führen Sie an, dass dieser vollen Zugriff auf die Dokumentation und damit auf vertrauliche Unterlagen hätte.
Ist das tatsächlich so? Ich hatte die Rolle so verstanden, dass der US Agent einzig als Kommunikationskanal fungiert – und nur dann aktiv wird, wenn wir als Hersteller nicht erreichbar sind für die FDA. Warum sollte er in diesem Fall vollen Zugriff auf die Unterlagen haben, er hat ja auch keine Produkthaftung?
Sollte die FDA vertrauliche Informationen anfordern, die über den US Agent an uns weitergeleitet werden, könnten wir diese Informationen doch auch direkt an die FDA weitergeben und die weiter Kommunikation selbst übernehmen? Zudem dachte ich der US Agent hat keine Entscheidungsmacht und darf somit auch nicht in unserem Namen selbständig antworten?
Vielen Dank für Ihre Einschätzung.
Mit freundlichen Grüßen
Tanja Kinzl
Sehr geehrte Frau Kinzl,
Vielen Dank für Ihre Frage.
Grundsätzlich haben Sie recht: Die offizielle Rolle des US Agents gemäß FDA-Vorgaben besteht in erster Linie darin, als Kommunikationskanal zwischen der FDA und dem ausländischen Hersteller zu fungieren – insbesondere dann, wenn der Hersteller für die FDA nicht direkt erreichbar ist. Der US Agent hat keine Entscheidungsbefugnis, keine Produkthaftung und darf grundsätzlich nicht ohne Rücksprache im Namen des Herstellers eigenständig handeln oder antworten.
Unsere Empfehlung, keinen Distributor als US Agent zu benennen, bezieht sich auf die praktische Umsetzung dieser Rolle. In der Praxis kann der US Agent im Rahmen von FDA-Anfragen (z. B. zu Registrierung, Inspektionen oder Rückrufen) Zugang zu bestimmten Dokumenten oder vertraulichen Informationen erhalten, um seine Kommunikationspflichten erfüllen zu können. Ein Distributor, der zugleich wirtschaftliche Interessen am Produkt vertritt, könnte diese Position potenziell als Druckmittel nutzen oder Interessenkonflikte verursachen.
Selbstverständlich können vertrauliche Informationen, die die FDA über den US Agent anfordert, auch direkt vom Hersteller an die FDA übermittelt werden – wichtig ist nur, dass die Kommunikation stets nachvollziehbar und fristgerecht erfolgt.
Kurz gesagt: Formal fungiert der US Agent als Kommunikationsschnittstelle, nicht als Vertreter mit Entscheidungsbefugnis. Dennoch kann die Auswahl einer neutralen, unabhängigen Person oder Organisation helfen, Interessenkonflikte und Risiken beim Informationsaustausch zu vermeiden.
Herzliche Grüße
Margarita Rozhdestvenskaya