Viele regulatorische Vorgaben fordern die Hersteller auf, Prozesse und Verfahren festzulegen. Solche Forderungen stellen beispielsweise die EU-Verordnungen (MDR und IVDR), Normen wie die ISO 13485, IEC 62304 und ISO 14971 sowie die FDA.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel zu Prozessen und Verfahren:
- Artikel zu Prozessen und Verfahren im Allgemeinen
- Artikel zu einzelnen Prozessen und Verfahren
- Hinweise zur Unterstützung bei Prozessen und Verfahren
1. Artikel zu Prozessen und Verfahren im Allgemeinen
a) Abgrenzung von Prozessanweisungen und Verfahrensanweisungen
Die Beschreibung von Prozessen und Verfahren unterscheidet sich in ihrem Granularitätsgrad. Prozesse beschreiben, WAS gemacht wird. Verfahrensanweisungen beschreiben, WIE etwas gemacht wird.
Aber die regulatorischen Anforderungen unterscheiden beides nicht immer präzise.
Alle Anweisungen müssen letztlich bestimmen,
- wer wann was in welcher Reihenfolge auf welche Weise macht
- und dabei welchen Input in welchen Output überführt.
b) Artikel
Die Prozesse und Verfahren sind Teil des Qualitätsmanagements. Diese Übersichtseite verschafft einen guten Einstieg in das Thema Qualitätsmanagement.
Hilfreich sind die Artikel zum Erstellen von Prozess- und Verfahrensanweisungen sowie zum risikobasierten Ansatz bei Prozessen. Das Schreiben dieser Vorgabedokumente sollte nur bei ausgewählten Prozessen die Aufgabe des QM-Beauftragten sein.
Sind die Prozesse definiert, müssen sie einer Prozessvalidierung unterworfen werden.
Hersteller sollten den Unterschied von Prozessorientierung und Prozessmanagement beachten.
2. Artikel zu einzelnen Prozessen und Verfahren
a) Entwicklung
Alle Hersteller müssen einen Entwicklungsprozess festlegen. Dazu sollten sie die Abgrenzung und das Zusammenspiel von Entwicklungsplan und Entwicklungsprozess verstehen.
Bei der Software-Entwicklung nutzen viele Hersteller agile Entwicklungsmodelle. Die Dokumentation hingegen sollte eher einem Modell folgen, das an das V-Modell erinnert.
Ein Teil der Entwicklung umfasst das Risikomanagement bzw. den Risikomanagementprozess. Dabei müssen die Hersteller auch die Risiken durch unzureichende Prozesse analysieren, etwa mit einer Prozess-FMEA (pFMEA).
b) Nachgelagerte Phase
Die Prozesse müssen den ganzen Lebenszyklus der Produkte abdecken:
3. Unterstützung
Das Johner Institut hilft Herstellern von Medizinprodukten dabei, schlanke und normenkonforme Prozesse und Verfahren festzulegen.
Damit gelingt es Ihnen, Ihre Produkte in der geplanten Zeit und mit den geplanten Kosten schnell und sicher zu entwickeln und in den Markt zu bringen.
Melden Sie sich, damit wir gemeinsam einen Plan erstellen können, wie Sie in kurzer Zeit und zu minimalen Kosten diese Prozesse und Verfahren bei sich etablieren.
Der AAMI TIR 36 ist ein Best Pratice Guide, der den Titel “Validation of software for regulated processes“ trägt. Die AAMI möchte mit diesem „Technical Information Report“ Medizinprodukteherstellern Hilfestellung dabei geben, computerisierte Systeme zu validieren. Inhaltsübersicht Wer den TIR 36 lesen sollte » Übersicht über die Anforderungen » Verbindlichkeit, Ziel, Bezugsquelle » Stärken und Schwächen…
Details
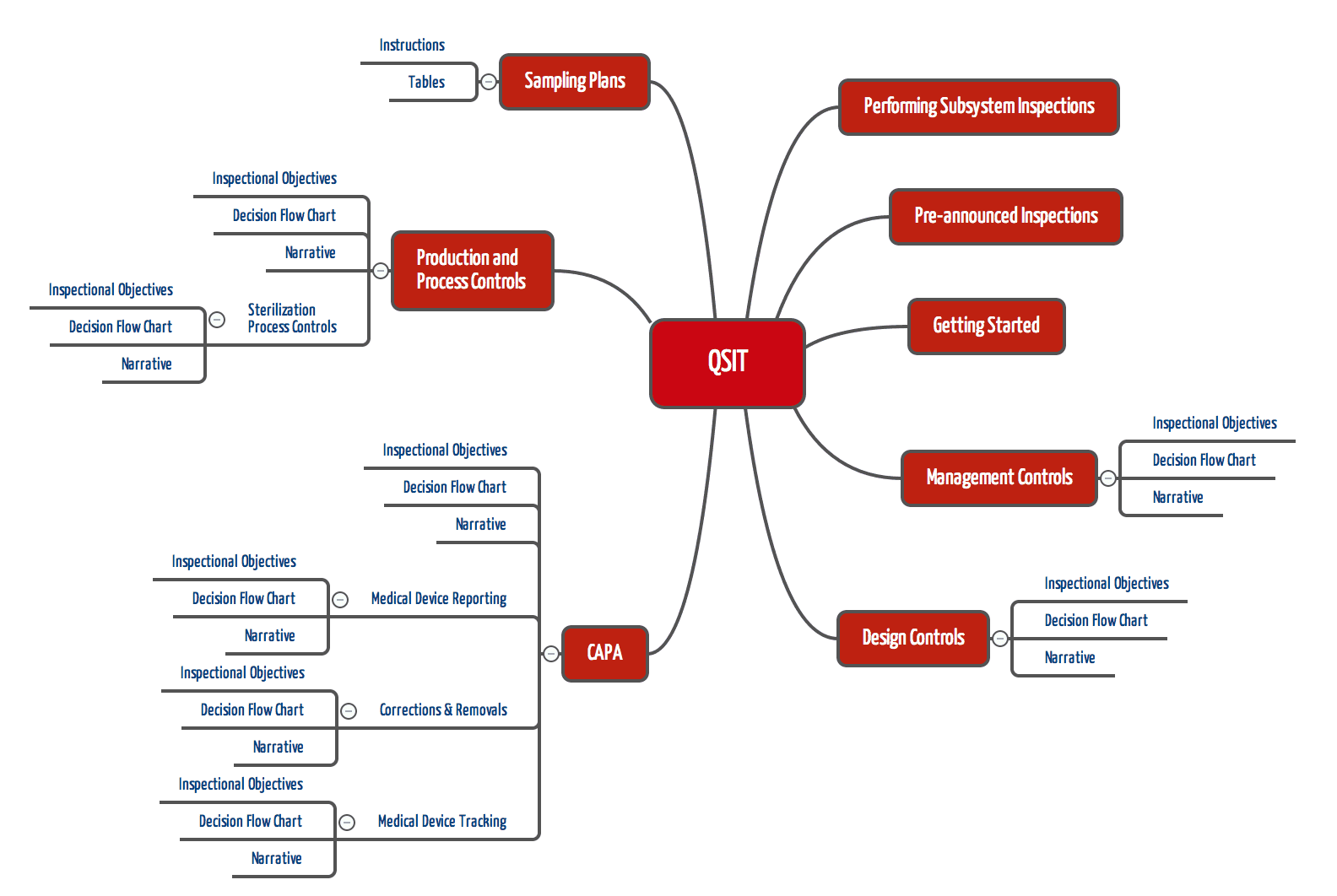
Im QSIT (Quality System Inspection Technique) weist die FDA Ihre Inspektoren an, wie diese die Konformität von Qualitätsmanagementsystemen mit den regulatorischen Forderungen des 21 CFR part 820 prüfen sollen. Für Medizinproduktehersteller dient der QSIT damit nicht nur zur Vorbereitung auf FDA Inspektionen, sondern auch als Anregung für das Vorgehen bei eigenen internen Audits.
In diesem Artikel lesen Sie, welche Anforderungen die FDA an das Human Factors Engineering HFE stellt, an welche Produkte die FDA diese Anforderungen stellt und wie Sie diese Anforderungen umsetzen.
Unter einem Hotfix verstehen die meisten Medizinprodukte-Hersteller die kurzfristige Behebung eines dringenden Software-Bugs. Bei diesen Hotfixes unterlaufen den Herstellern gravierende Fehler. Auch regulatorische. Lesen Sie hier, wie Sie die Software Ihrer Medizinprodukte durch einen Hotfix schnell und ohne Overhead aber dennoch gesetzeskonform updaten können.
Details
Häufig stellt sich beim Thema „Werkzeug Validierung“ die Frage, ob man auch Testwerkzeuge (z.B. N/JUnit) und ALM-Tools (z.B. MedPack, JIRA, Microsoft TFS) validieren bzw. verifizieren muss. Und falls die Antwort ja wäre, müsste man dann die zu dieser Validierung bzw. Verifizierung eingesetzten Werkzeuge selbst wieder prüfen? Da würde sich ja ein Teufelskreis auftun. Dieser Artikel…
Details
Die ISO 9001 und damit die ISO 13485 fordern eine Prozessorientierung. Doch was ist damit gemeint? Dass sich das QM-System an Prozessen orientieren soll? Keineswegs! Lesen Sie hier, was die Normen unter Prozessorientierung und Prozessmanagement verstehen, wie sich beide unterscheiden und wie Sie beide erreichen.
Details
Die Risikoanalyse bei Software unterscheidet sich: Software selbst kann keine Schäden verursachen. Dies geschieht immer via Hardware oder Menschen. Doch das heißt nicht, dass es keiner Risikoanalyse bei Software bedarf. Im Gegenteil!
IT-Projekte werden nicht nur im Gesundheitswesen mit einem der folgenden Ziele gestartet: Effektivität und Effizienz erhöhen z.B. von Prozessen oder Systemen Gesetzliche Anforderungen erfüllen Bestehende Systeme ablösen Innovation z.B. in neue Produkte oder Märke tätigen Gründe fürs Scheitern von IT-Projekten » Kosten für IT-Projekte richtig berechnen » Projektauftrag korrekt formulieren »
Details
Von Blackbox-Testing spricht man, wenn man Testfälle alleine aus der Spezifikation des zu testenden Objekt (Produkt, Komponente) ableitet. Beim White-box-Testing leitet man die Testfälle hingegen aus der inneren Struktur des Objekts ab z.B. aus dessen Quellcode oder dessen Software-Architektur. Leider beobachte ich, dass viele Medizinproduktehersteller weder die Testfälle spezifizieren, noch diese systematisch mit einem Blackbox-Testverfahren herleiten. Vielmehr klickt sich ein…
Details
Auf die Frage, was ein Design Review sei, bekommt man häufig unterschiedliche Antworten — abhängig davon, ob man einen Entwickler oder einen Qualitätsmanager fragt. Genau diese unterschiedlichen Sichten können im Audit zum Problem werden.