Viele regulatorische Vorgaben fordern die Hersteller auf, Prozesse und Verfahren festzulegen. Solche Forderungen stellen beispielsweise die EU-Verordnungen (MDR und IVDR), Normen wie die ISO 13485, IEC 62304 und ISO 14971 sowie die FDA.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel zu Prozessen und Verfahren:
- Artikel zu Prozessen und Verfahren im Allgemeinen
- Artikel zu einzelnen Prozessen und Verfahren
- Hinweise zur Unterstützung bei Prozessen und Verfahren
1. Artikel zu Prozessen und Verfahren im Allgemeinen
a) Abgrenzung von Prozessanweisungen und Verfahrensanweisungen
Die Beschreibung von Prozessen und Verfahren unterscheidet sich in ihrem Granularitätsgrad. Prozesse beschreiben, WAS gemacht wird. Verfahrensanweisungen beschreiben, WIE etwas gemacht wird.
Aber die regulatorischen Anforderungen unterscheiden beides nicht immer präzise.
Alle Anweisungen müssen letztlich bestimmen,
- wer wann was in welcher Reihenfolge auf welche Weise macht
- und dabei welchen Input in welchen Output überführt.
b) Artikel
Die Prozesse und Verfahren sind Teil des Qualitätsmanagements. Diese Übersichtseite verschafft einen guten Einstieg in das Thema Qualitätsmanagement.
Hilfreich ist der Artikel zum Erstellen von Prozess- und Verfahrensanweisungen. Das sollte nur bei ausgewählten Prozessen die Aufgabe des QM-Beauftragten sein.
Sind die Prozesse definiert, müssen sie einer Prozessvalidierung unterworfen werden.
Hersteller sollten den Unterschied von Prozessorientierung und Prozessmanagement beachten.
2. Artikel zu einzelnen Prozessen und Verfahren
a) Entwicklung
Alle Hersteller müssen einen Entwicklungsprozess festlegen. Dazu sollten sie die Abgrenzung und das Zusammenspiel von Entwicklungsplan und Entwicklungsprozess verstehen.
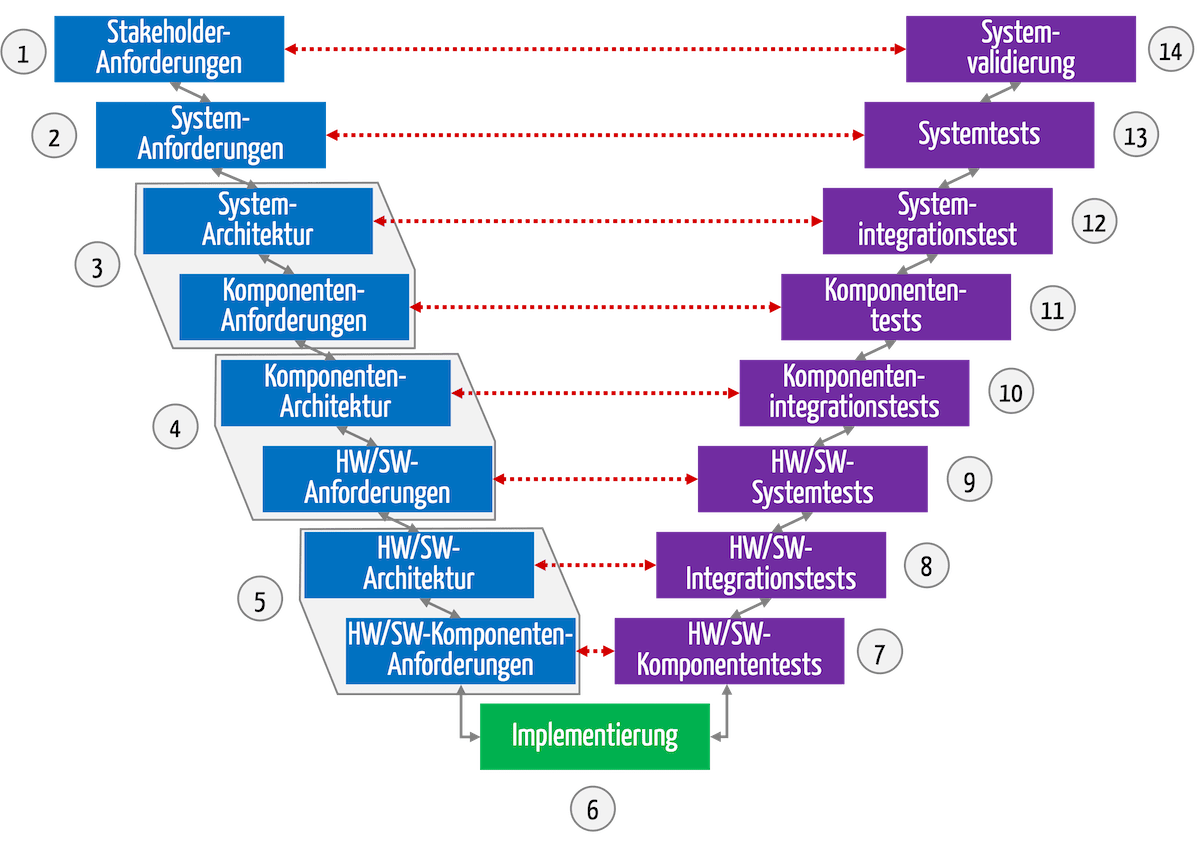
Bei der Software-Entwicklung nutzen viele Hersteller agile Entwicklungsmodelle. Die Dokumentation hingegen sollte eher einem Modell folgen, das an das V-Modell erinnert.
Ein Teil der Entwicklung umfasst das Risikomanagement bzw. den Risikomanagementprozess. Dabei müssen die Hersteller auch die Risiken durch unzureichende Prozesse analysieren, etwa mit einer Prozess-FMEA (pFMEA).
b) Nachgelagerte Phase
Die Prozesse müssen den ganzen Lebenszyklus der Produkte abdecken:
3. Unterstützung
Das Johner Institut hilft Herstellern von Medizinprodukten dabei, schlanke und normenkonforme Prozesse und Verfahren festzulegen.
Damit gelingt es Ihnen, Ihre Produkte in der geplanten Zeit und mit den geplanten Kosten schnell und sicher zu entwickeln und in den Markt zu bringen.
Melden Sie sich, damit wir gemeinsam einen Plan erstellen können, wie Sie in kurzer Zeit und zu minimalen Kosten diese Prozesse und Verfahren bei sich etablieren.
Die Digitalisierung der Produktion ist ein wesentlicher Bestandteil der digitalen Transformation von produzierenden Unternehmen. Doch nicht alle Unternehmen profitieren im gleichen Maß von Digitalisierungsmaßnahmen. Dieser Artikel beschreibt,
Weiterlesen
Lastenheft und Pflichtenheft, Systemspezifikation und Systemanforderungen Die Vorstellungen darüber, was Lastenhefte und Pflichtenhefte enthalten müssen, gehen weit auseinander – manchmal auch innerhalb einer Firma. Das liegt u. a. daran, dass die beiden Dokumente die verschiedenen Anforderungstypen nicht konsequent unterscheiden. Vielmehr unterscheiden sie sich in der Granularität und dem Detailgrad. Schon aus regulatorischer Sicht sollten Sie…
Weiterlesen
Der Risikomanagementplan ist eines der wichtigsten Dokumente der Technischen Dokumentation. Entsprechend intensiv prüfen Behörden und Benannte Stellen diesen Plan. Doch nicht nur aus regulatorischer Sicht profitieren Medizinproduktehersteller von einem präzisen Risikomanagementplan. Dieser Beitrag
Weiterlesen
Die FMEA, die Failure Mode and Effect Analysis (auf Deutsch „Fehlermöglichkeits- und -einflussanalyse“) ist ein Verfahren, um zu bekannten Ursachen unbekannte Auswirkungen zu untersuchen. Bei Medizinprodukten nutzt man die FMEA beispielsweise bei der Risikoanalyse, um die Folgen einer fehlerhaften Komponente zu analysieren, insbesondere die sich daraus ergebende Gefährdungen.
Weiterlesen
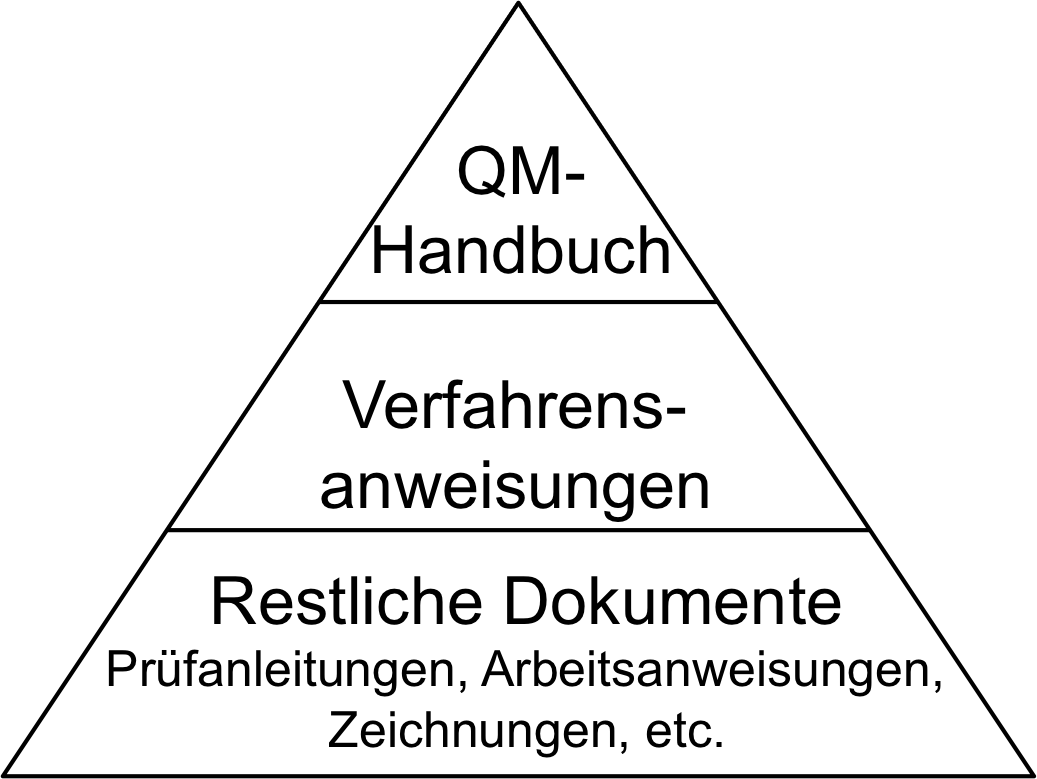
Das QM-Handbuch stellt in der Dokumentenpyramide des QM-Systems das oberste Dokument dar. Es dient als Einstiegspunkt für Mitarbeiter und Auditoren, um einen schnellen Überblick über das QM-System zu verschaffen. Erfahren Sie in diesem Beitrag, wann Sie ein QM-Handbuch benötigen, welche Ziele es verfolgt und welche Inhalte es enthalten sollte.
Weiterlesen
In einer Verfahrensanweisung (VA), auch Standard Operating Procedure (SOP) oder Prozessbeschreibung genannt, legen Firmen ihre Abläufe fest, beispielsweise wie sie Produkte entwickeln oder Dienstleistungen erbringen. Die Normen wie die ISO 9001 und die ISO 13485 fordern solche Verfahrensanweisungen. Diese Vorgaben können Firmen direkt im Qualitätsmanagementhandbuch oder in eigenständigen Dokumenten festlegen.
Weiterlesen
Der TIR45 („Guidance on the use of AGILE practices in the development of medical device software“) ist ein Technical Information Report (daher TIR) der AAMI, der Association for the Advancement of Medical Instrumentation. Der 2012 erstmalig veröffentlichte TIR45 hat sich vor allem ein Ziel gesetzt: Medizinprodukte-Herstellern eine Anleitung zu geben, wie sie Software agil und…
Weiterlesen
Die Trendanalyse ist eine gesetzliche Pflicht aller Medizinproduktehersteller, insbesondere bei der „Post-Market Surveillance“. Bei der Wahl und Anwendung geeigneter statistischer Methoden für die Trendanalyse dürfen die Hersteller nicht scheitern. Denn der Fokus von Behörden und Benannten Stellen verschiebt sich zunehmend auf die Überwachung der Post-Market-Aktivitäten. Dieser Artikel gibt eine schnelle Einführung in das komplexe Thema,…
Weiterlesen
Interne Audits sind Prüfungen des Qualitätsmanagement-Systems (QM-Systems) und seiner Prozesse durch die Organisation selbst. Daher werden sie auch 1st Party Audits genannt. Die ISO 13485 fordert interne Audits ebenso wie ihre „Schwesternorm“, die ISO 9001, und andere Normen und Regularien. Deshalb sind interne Audits auch Gegenstand der externen Audits und Voraussetzung für die QM-Zertifizierung. Dieser…
Weiterlesen
Das V-Modell ist ein Entwicklungsprozessmodell, das ursprünglich bei staatlichen Projekten (u. a. Rüstung) zur Anwendung kam. Bis heute ist es bei Projekten im regulierten Umfeld (z. B. Medizintechnik, Banken) in vielen Köpfen und Normen verankert. Das führt zu Konflikten in Teams, die agile Entwicklungsprozesse bevorzugen. Dieser Artikel hilft, diesen Widerspruch aufzulösen. Sie erfahren, wie Sie…
Weiterlesen