Viele regulatorische Vorgaben fordern die Hersteller auf, Prozesse und Verfahren festzulegen. Solche Forderungen stellen beispielsweise die EU-Verordnungen (MDR und IVDR), Normen wie die ISO 13485, IEC 62304 und ISO 14971 sowie die FDA.
Inhalt
Sie finden auf dieser Seite Verweise auf Fachartikel zu Prozessen und Verfahren:
- Artikel zu Prozessen und Verfahren im Allgemeinen
- Artikel zu einzelnen Prozessen und Verfahren
- Hinweise zur Unterstützung bei Prozessen und Verfahren
1. Artikel zu Prozessen und Verfahren im Allgemeinen
a) Abgrenzung von Prozessanweisungen und Verfahrensanweisungen
Die Beschreibung von Prozessen und Verfahren unterscheidet sich in ihrem Granularitätsgrad. Prozesse beschreiben, WAS gemacht wird. Verfahrensanweisungen beschreiben, WIE etwas gemacht wird.
Aber die regulatorischen Anforderungen unterscheiden beides nicht immer präzise.
Alle Anweisungen müssen letztlich bestimmen,
- wer wann was in welcher Reihenfolge auf welche Weise macht
- und dabei welchen Input in welchen Output überführt.
b) Artikel
Die Prozesse und Verfahren sind Teil des Qualitätsmanagements. Diese Übersichtseite verschafft einen guten Einstieg in das Thema Qualitätsmanagement.
Hilfreich sind die Artikel zum Erstellen von Prozess- und Verfahrensanweisungen sowie zum risikobasierten Ansatz bei Prozessen. Das Schreiben dieser Vorgabedokumente sollte nur bei ausgewählten Prozessen die Aufgabe des QM-Beauftragten sein.
Sind die Prozesse definiert, müssen sie einer Prozessvalidierung unterworfen werden.
Hersteller sollten den Unterschied von Prozessorientierung und Prozessmanagement beachten.
2. Artikel zu einzelnen Prozessen und Verfahren
a) Entwicklung
Alle Hersteller müssen einen Entwicklungsprozess festlegen. Dazu sollten sie die Abgrenzung und das Zusammenspiel von Entwicklungsplan und Entwicklungsprozess verstehen.
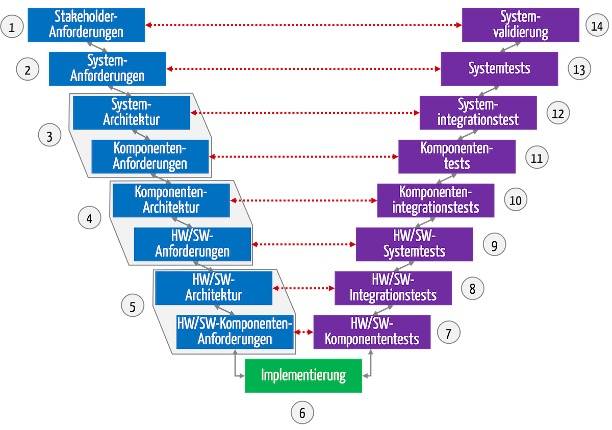
Bei der Software-Entwicklung nutzen viele Hersteller agile Entwicklungsmodelle. Die Dokumentation hingegen sollte eher einem Modell folgen, das an das V-Modell erinnert.
Ein Teil der Entwicklung umfasst das Risikomanagement bzw. den Risikomanagementprozess. Dabei müssen die Hersteller auch die Risiken durch unzureichende Prozesse analysieren, etwa mit einer Prozess-FMEA (pFMEA).
b) Nachgelagerte Phase
Die Prozesse müssen den ganzen Lebenszyklus der Produkte abdecken:
3. Unterstützung
Das Johner Institut hilft Herstellern von Medizinprodukten dabei, schlanke und normenkonforme Prozesse und Verfahren festzulegen.
Damit gelingt es Ihnen, Ihre Produkte in der geplanten Zeit und mit den geplanten Kosten schnell und sicher zu entwickeln und in den Markt zu bringen.
Melden Sie sich, damit wir gemeinsam einen Plan erstellen können, wie Sie in kurzer Zeit und zu minimalen Kosten diese Prozesse und Verfahren bei sich etablieren.
Das V-Modell ist ein Entwicklungsprozessmodell, das ursprünglich bei staatlichen Projekten (u. a. Rüstung) zur Anwendung kam. Bis heute ist es bei Projekten im regulierten Umfeld (z. B. Medizintechnik, Banken) in vielen Köpfen und Normen verankert. Das führt zu Konflikten in Teams, die agile Entwicklungsprozesse bevorzugen. Dieser Artikel hilft, diesen Widerspruch aufzulösen. Sie erfahren, wie Sie…
Details
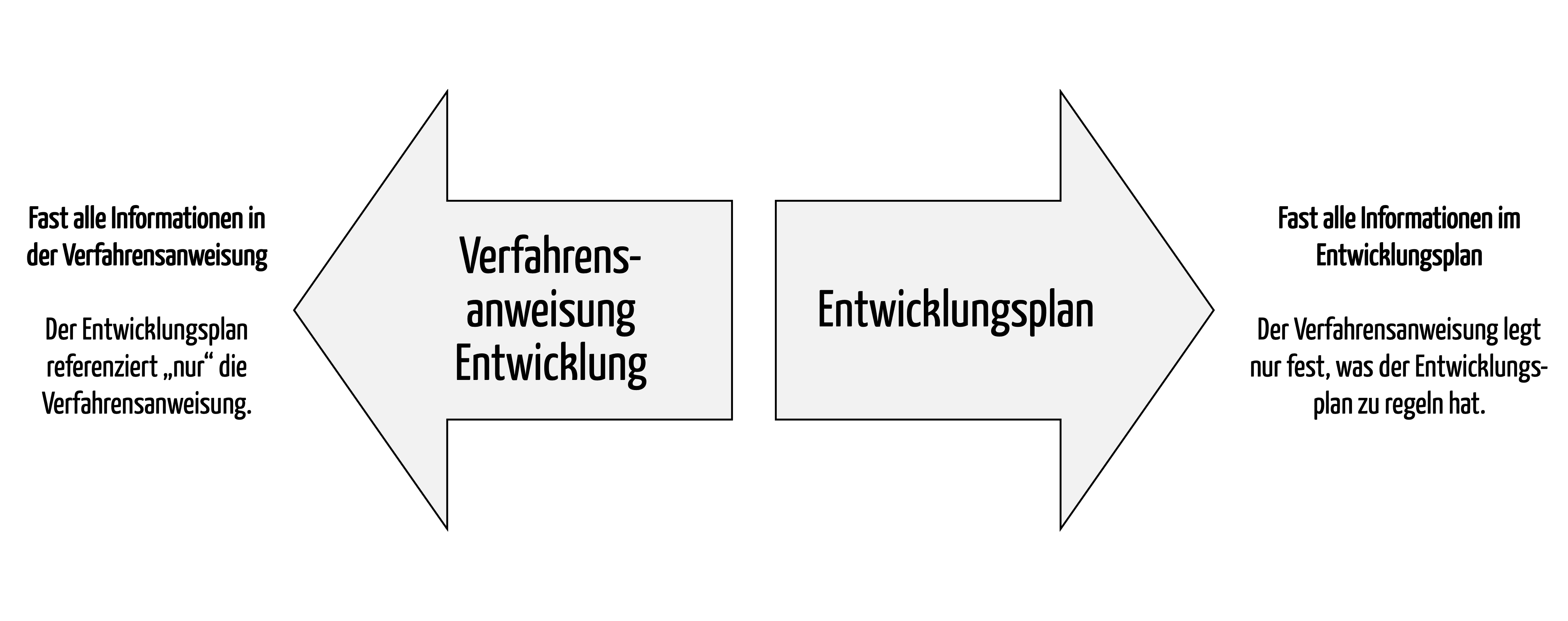
Medizinproduktehersteller sind verpflichtet, sowohl den Entwicklungsprozess zu beschreiben als auch einen Entwicklungsplan zu erstellen. Weil beide Dokumente Vorgaben dazu machen, wie Medizinprodukte zu entwickeln sind, gibt es Unsicherheit darüber, welche Information in welches Dokument gehört. Dieser Artikel löst das auf und betrachtet dabei auch die Software. Er geht ein auf den Software-Entwicklungsplan und die Beschreibung…
Details
Gesetze und Normen formulieren Anforderungen, wie Medizinproduktehersteller den Entwicklungsprozess festlegen und dokumentieren müssen. Diese Anforderungen prüfen Benannte Stellen bei Audits. Dieser Artikel zum Entwicklungsprozess gibt Ihnen Tipps zu dessen Gestaltung und zum Abgleich mit anderen Prozessen wie dem Risikomanagementprozess.
Details
Die ISO 9001 ist eine Norm, die Anforderungen an QM-Systeme stellt ähnlich wie die ISO 13485 dies tut. Die ISO 9001 ist zwar nicht für die EU-Medizinprodukteverordnungen (MDR, IVDR) harmonisiert, sie kann aber in Einzelfällen dennoch hilfreich oder sogar notwendig sein.
Die EN ISO 17664-1:2021 trägt den Titel „Aufbereitung von Produkten für die Gesundheitsfürsorge – Vom Medizinprodukt-Hersteller bereitzustellende Informationen für die Aufbereitung von Medizinprodukten“.
Sowohl die IEC 62304 als auch die FDA fordern Integrationsprüfungen, typischerweise in Form von Integrationstests.
Eine häufige Frage an uns: „Bieten Sie auch Computerized Systems Validation an?“ Einer der Gründe für das Interesse ist sicherlich: Behörden und Benannte Stellen machen das Thema CSV immer öfter zum Gegenstand von Audits. Lesen Sie hier, welche Regularien es zur „Computerized Systems Validation“ gibt und wie Sie deren Forderungen am elegantesten erfüllen.
Details
Als deutsche Fassung der EN ISO 13485:2016 + AC:2018 + A11:2021 kommt die DIN EN ISO 13485:2021 mit kleinen Änderungen zu den Vorgängerversionen DIN EN ISO 13485:2012-11 und 2016-08 und DIN EN ISO 13485 Berichtigung 1:2017-07 daher.
Ohne eine gesetzeskonforme Leistungsbewertung von In-vitro-Diagnostika (IVD) riskieren Hersteller nicht nur Probleme bei der Zulassung; sie riskieren die Sicherheit der Patienten. Daher stellen Regularien wie die IVDR hohe Anforderungen an die Leistungsbewertung (performance evaluation). Erfahren Sie, welche Anforderungen genau die IVDR an die Leistungsbewertung stellt, um die Konformität Ihres Produkts zu erreichen, und wie sich…
Details
Unter Post-Market Surveillance (Überwachung nach der Inverkehrbringung) versteht man einen proaktiven und systematischen Prozess, um aus Informationen über Medizinprodukte, die bereits in Verkehr gebracht wurden, notwendige Korrektur- und Vorbeugemaßnahmen (CAPA, corrective and preventive action) abzuleiten. Wir haben für Sie eine Checkliste zur Post-Market-Surveillance erstellt. Mit dieser Checkliste können Sie herausfinden, ob Sie die regulatorischen Anforderungen…
Details