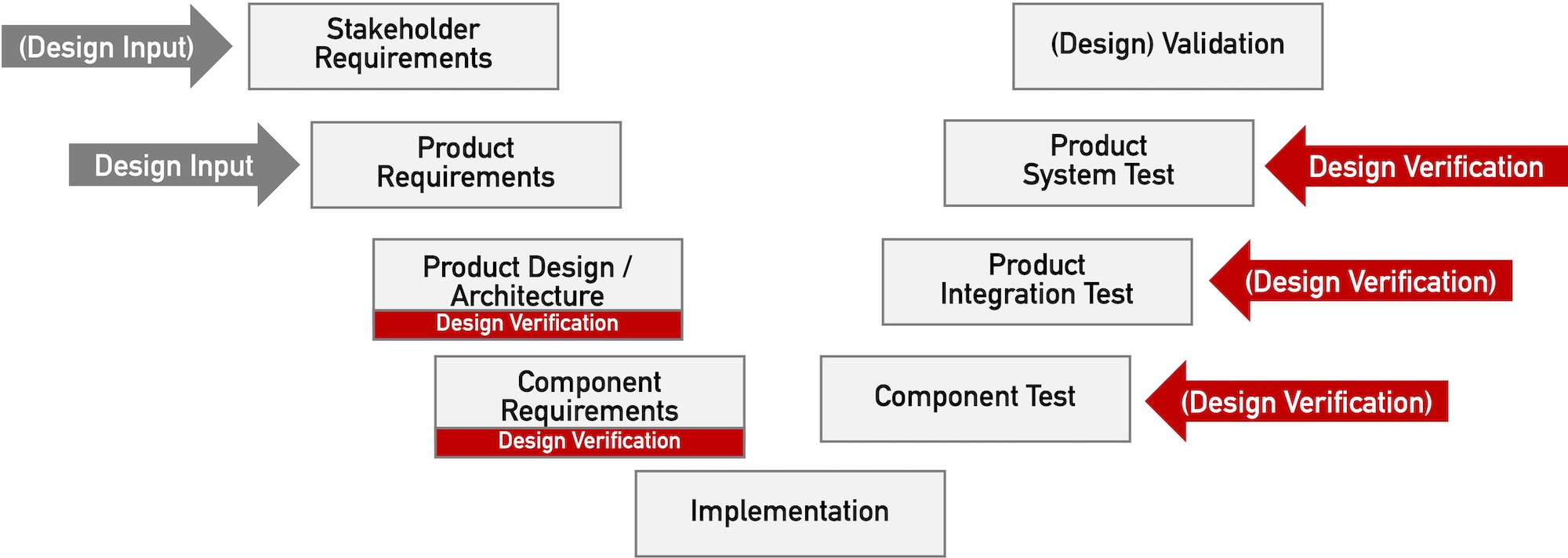
Design Verification von Medizinprodukten und Standalone-Software
Die Forderung nach „Design Verification“ erhebt keinesfalls nur die FDA. Dieser Beitrag beschreibt, was unter „Design Verification“ zu verstehen ist und welche regulatorischen Forderungen Medizinproduktehersteller erfüllen sollten.