Diese Seite wendet sich an alle Personen, die einen schnellen Einstieg in die Welt des Medizinprodukterechts und Qualitätsmanagements benötigen, beispielsweise weil sie ihre Produkte zulassen wollen.
Inhalt
Sie finden auf dieser Seite die wichtigsten Informationen:
- Der schnelle Einstieg für Einsteiger
- Themen, über die Sie Bescheid wissen müssen
- Weitere Tipps für Einsteiger
- Unterstützung
1. Der schnelle Einstieg für Einsteiger
a) Der erste Überblick
Den ganz schnellen Einstieg in das Thema „Zulassung von Medizinprodukten“ (in Europa) verschafft Ihnen der Fachartikel „in 7 Schritten zum Medizinprodukt“.
Auf dieser Seite finden Sie eine Präsentation, die Sie in wenigen Minuten durchgesehen haben, sowie eine Beschreibung der sieben Schritte im Detail.
b) Das Starter-Kit
Das kostenlose Starter-Kit enthält
- ein E-Book, das Ihnen das regulatorische Rahmenwerk erklärt,
- Checklisten, mit denen Sie die Konformität Ihrer Produkte prüfen können,
- eine Übersicht über alle relevanten Normen und Gesetze.
Sie können sich das Starter-Kit hier herunterladen.
2. Themen, über Sie Bescheid wissen müssen
a) Regulatorische Grundlagen
Beim Einstieg und der Übersicht über Normen und Gesetze hilft die Seite „Regulatory Affairs“. Falls Sie in Deutschland ansässig sind, sollten Sie die deutschen Gesetze und Verordnungen kennen. Bei einer Zulassung in den USA die Anforderungen der FDA.
Sie sollten verstehen:
b) Wichtige Aktivitäten
Auch Einsteiger sollten sich sehr früh mit diesen Aktivitäten auseinandersetzen:
3. Weitere Tipps für Einsteiger
Unter den Schlagworten Medizingeräte, standalone Software, Medical Apps, medizinische Software, DiGA und IVD finden Sie Tipps zu den einzelnen Produktkategorien.
Ein Glossar verschafft einen Überblick über viele Begriffe.
Ein weiterer Artikel erklärt Einsteigern, woran Medical Startups scheitern und wie diese das vermeiden können.
4. Unterstützung
Nicht nur als Einsteiger bekommen Sie beim Johner Institut alle Unterstützung, die Sie benötigen:
Nehmen Sie gleich Kontakt auf, um die nächsten Schritte zu klären. Damit Sie Ihre Produkte schnell und sicher in den Markt bringen.
Die meisten Hersteller nutzen harmonisierte Normen, um die Konformität ihrer Produkte mit den grundlegenden Sicherheits- und Leistungsanforderungen nachzuweisen. Das gilt beispielsweise auch für Medizinproduktehersteller.
Die korrekte und präzise Formulierung der Zweckbestimmung von Medizinprodukten und In-Vitro-Diagnostika (IVD) ist entscheidend für deren erfolgreiche Entwicklung und Zulassung. Doch bereits die Begriffsdefinitionen und die Abgrenzung von Zweckbestimmung und bestimmungsgemäßem Gebrauch erschweren die notwendige Klarheit und Präzision. Dieser Artikel verrät, wie Sie eine Zweckbestimmung formulieren, um Schwierigkeiten bei Audits und Zulassungen zu vermeiden.
Details
Wenn Sie ein Medizinprodukt auf den Markt bringen möchten, stellt sich schnell die Frage, wie Sie vorgehen sollten und welche gesetzlichen Regelungen Sie beachten müssen. Dieser Artikel gibt Ihnen Antworten und stellt Ihnen die sieben Schritte vor, mit denen Ihnen die Inverkehrbringung Ihrer Produkte schnell und gesetzeskonform gelingt.
Details
Die Medical Device Coordination Group (MDCG) hat ein Guidance Document entworfen, das beschreibt, wie Hersteller ihre Medizinprodukte der Klasse 1 MDR-konform in den Verkehr bringen sollen. Das Dokument trägt den Titel Guidance Notes for Manufacturers of Class I Medical Devices. Dieser Artikel fasst dieses Dokument zusammen und gibt Herstellern dieser Produkte Tipps.
Details
In diesem Beitrag erfahren Sie,
Wie unterscheiden sich Verifizierung und Validierung und wie sind diese Begriffe definiert? Selbst Normen und Gesetze verwenden die Begriffe falsch oder missverständlich. Dieser Artikel
Details
Das Medizinproduktegesetz (MPG) ist ein deutsches Gesetz, das die Inverkehrbringung, den Betrieb und die Überwachung von Medizinprodukten regelte. Seit dem 26.01.2021 ist das Gesetz weitgehend durch das Medizinprodukterecht-Durchführungsgesetz (MPDG) abgelöst. Dieses FAQ beantwortet die wichtigsten Fragen zum MPG und enthält die Links auf die aktuelle und frühere Versionen des Gesetzes.
Details
Diese FAQ geben Antworten auf die häufigsten Fragen, die Firmen wie Medizinproduktehersteller zu Qualitätsmanagementsystemen (QM-Systemen) und zur ISO 13485 haben.
Dieser Beitrag beschreibt, wann und weshalb Hersteller ein CE-Zeichen anbringen müssen, was man unter CE-Kennzeichnung versteht und was die Hersteller bis zu diesem Zeitpunkt unternehmen müssen.
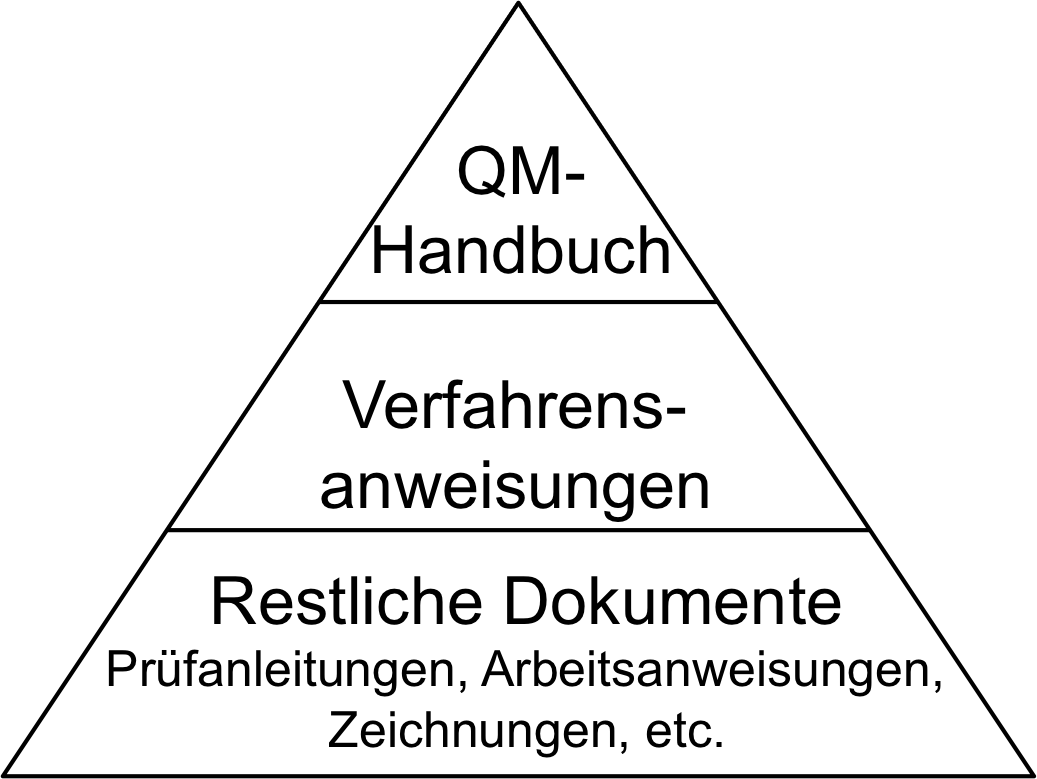
Das QM-Handbuch stellt in der Dokumentenpyramide des QM-Systems das oberste Dokument dar. Es dient als Einstiegspunkt für Mitarbeiter und Auditoren, um einen schnellen Überblick über das QM-System zu verschaffen. Erfahren Sie in diesem Beitrag, wann Sie ein QM-Handbuch benötigen, welche Ziele es verfolgt und welche Inhalte es enthalten sollte.
Details