Die internationale Zulassung von Medizinprodukten stellt für die meisten Hersteller eine Herausforderung dar. Denn die regulatorischen Vorgaben unterscheiden sich in den verschiedenen Märkten.
Sie finden auf dieser Seite Links zu weiterführenden Informationen, die für die internationale Zulassung hilfreich sind:
Informationen zu den Anforderungen der Märkte
Die regulatorischen Anforderungen an die Zulassung und Überwachung von Medizinprodukten im Markt weisen viele Gemeinsamkeiten auf. Aber sie sind nicht deckungsgleich. Die folgenden Fachartikel verschaffen einen schnellen Überblick.
Weitere Informationen
Für die internationale Zulassung sind auch diese Informationen relevant:
Unterstützung
Das Johner Institut unterstützt bei der internationalen Zulassung. Es tritt auch als Bevollmächtigter in anderen Märkten wie Großbritannien und der Schweiz auf.
Melden Sie sich, damit wir gemeinsam die nächsten Schritte klären, um Ihre Produkte schnell und sicher in allen gewünschten Märkten in den Verkehr zu bringen.
Das Premarket Approval (PMA-Verfahren) müssen v. a. Hersteller von Medizinprodukten der Klasse III durchlaufen. Es ist das aufwändigste „Zulassungsverfahren“ der FDA, dessen typische Bearbeitungszeit länger als ein Jahr beträgt. Die FDA genehmigt pro Jahr meist nur wenige Dutzend PMA-Anträge. Dieser Fachartikel stellt die Anforderungen der FDA vor und gibt Tipps, wie Hersteller diese hohe Hürde dennoch…
Details
Die DAkkS, die Deutsche Akkreditierungsstelle, ist die nationale Akkreditierungsbehörde der Bundesrepublik Deutschland.
Unter eCopy versteht die FDA die elektronische Kopie/Version von papierbasierten Einreichungen, z. B. im Rahmen einer 510(k)-Submission. Die FDA hat im Dezember 2020 eine überarbeitete Version des Guidance-Dokuments eCopy Program for Medical Device Submissions veröffentlicht. Ist das eCopy-Programm verpflichtend? Die kurze Antwort auf diese Frage lautet: „teilweise“. Die FDA verlangt gemäß Sektion 745A/(b) des „Food,…
Details
Ein ‚Request for Information‘ kann Ihnen teure Anwaltskosten (teilweise) ersparen. Fragen Sie die Behörde doch selbst! So kommen Sie zu einer qualifizierten Antwort. Wenn auch nicht kostenlos. Lesen Sie hier,
Details
Die Vereinigten Arabischen Emirate (VAE) mit ihren „Hubs“ Dubai und Abu Dhabi sind eine der am weitesten entwickelten Volkswirtschaften des Nahen Ostens. Die Emirate zählen zu den reichsten Ländern der Welt. Das Gesundheitssystem gilt als hochentwickelt, weshalb die „United Arab Emirates“ (UAE) in der Region ein beliebtes Ziel des Gesundheitstourismus sind. Auch deshalb entwickeln sich…
Details
Die NMPA Usability Guidance betrifft viele Hersteller von Medizinprodukten und IVD sowie Hersteller von Kombinationsprodukten, welche ihre Produkte in China in den Markt bringen wollen. Welche Produkte die NMPA-Anforderungen bezüglich Usability erfüllen müssen und worin diese Anforderungen bestehen, klärt dieser Artikel.
Details
Das Medical Device Single Audit Program (MDSAP) wurde ins Leben gerufen, um einen Wunsch vieler Medizinproduktehersteller zu erfüllen: Statt vieler Audits und Inspektionen durch die Behörden verschiedener Länder soll es nur noch eines geben. Die Teilnahme am MDSAP soll ausreichen, um die Wirksamkeit und Konformität von QM-Systemen (z. B. Konformität mit ISO 13485 oder 21…
Details
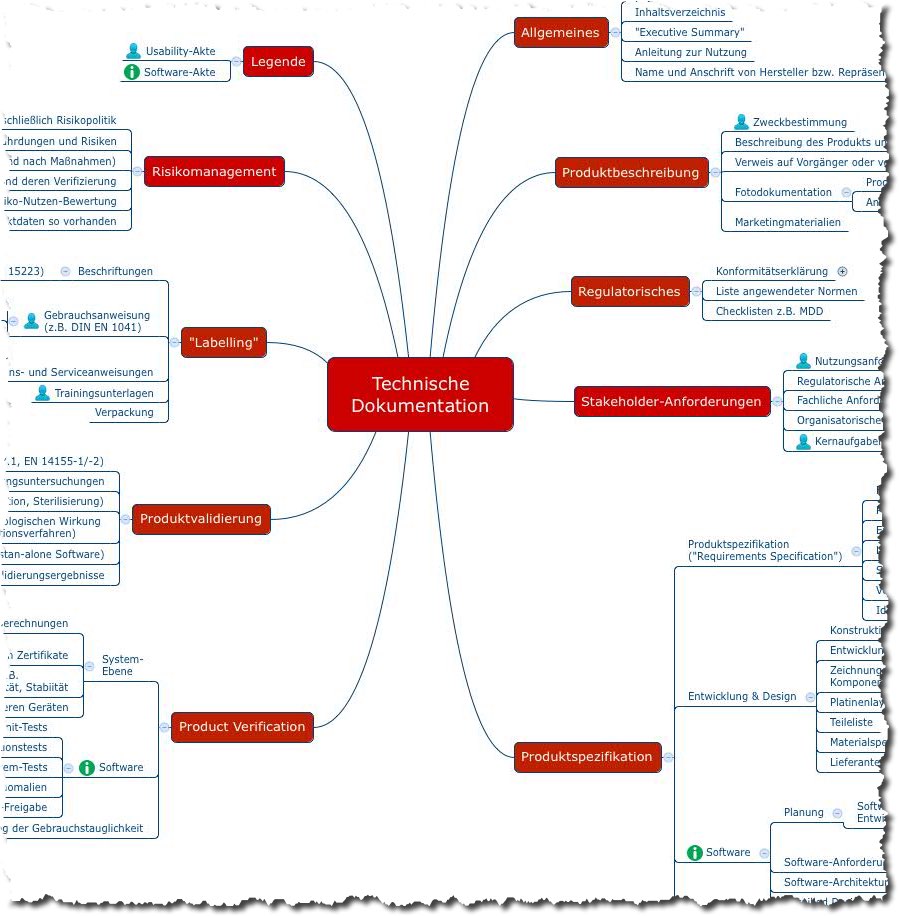
Ist die STED (Summary Technical Documentation) und deren Nachfolger ToC (Table of Contents) die Lösung für Medizinproduktehersteller, die ihre Produkte international zulassen müssen? Dieser Beitrag stellt die STED bzw. ToC und vor damit einen Vorschlag, wie Hersteller die technische Dokumentation strukturieren können.
Details
Mit dem Pre-Submission-Programm (kurz „Pre-Sub“) bietet die FDA ein formales Verfahren an, mit dem Hersteller bereits vor der eigentlichen Zulassung ihre Zulassungsstrategie sowie konkrete Fragen klären können. Ein Pre-Sub Request eignet sich unter anderem im Vorfeld von 510(k)s, De Novo Requests oder auch PMAs. Damit können auf beiden Seiten unnötige Kosten und Aufwände vermieden werden. Das Johner…
Details
Es ist nicht einfach, in Brasilien Medizinprodukte zuzulassen. Das liegt sowohl an der Anzahl und Komplexität der Regularien als auch an der Tatsache, dass Brasilien die meisten Regularien nur auf Portugiesisch veröffentlicht hat. Dieser Artikel verschafft Ihnen einen Überblick und stellt die Gemeinsamkeiten mit dem europäischen und dem US-amerikanischen System vor. So wird es Ihnen…
Details