Die internationale Zulassung von Medizinprodukten stellt für die meisten Hersteller eine Herausforderung dar. Denn die regulatorischen Vorgaben unterscheiden sich in den verschiedenen Märkten.
Sie finden auf dieser Seite Links zu weiterführenden Informationen, die für die internationale Zulassung hilfreich sind:
Informationen zu den Anforderungen der Märkte
Die regulatorischen Anforderungen an die Zulassung und Überwachung von Medizinprodukten im Markt weisen viele Gemeinsamkeiten auf. Aber sie sind nicht deckungsgleich. Die folgenden Fachartikel verschaffen einen schnellen Überblick.
Weitere Informationen
Für die internationale Zulassung sind auch diese Informationen relevant:
Unterstützung
Das Johner Institut unterstützt bei der internationalen Zulassung. Es tritt auch als Bevollmächtigter in anderen Märkten wie Großbritannien und der Schweiz auf.
Melden Sie sich, damit wir gemeinsam die nächsten Schritte klären, um Ihre Produkte schnell und sicher in allen gewünschten Märkten in den Verkehr zu bringen.
Das De-Novo-Verfahren, die FDA spricht auch vom „de novo program“ und vom „de novo submission process“, ist eines der Zulassungsverfahren für Medizinprodukte in den USA. Dieses Verfahren können Hersteller – wie der Name „de novo“ vermuten lässt – für neuartige Produkte anwenden. D.h. die Hersteller sollten einen De-Novo-Antrag für Produkte stellen, für die es kein…
Weiterlesen
Mit dem Safer Technologies Program (STeP) möchte die FDA Herstellern innovativer Medizinprodukte einen neuen Zulassungsweg bahnen. Damit verfolgt die Behörde das Ziel, dass Patienten schneller von diesen Innovationen profitieren. Lesen Sie in diesem Artikel, welche Vereinfachungen und Hilfestellungen die FDA für Sie als Hersteller vorsieht und welche Voraussetzungen Sie erfüllen müssen, damit Sie Ihre Produkte…
Weiterlesen
Die „Abbreviated 510 (k)“ ist eines der drei 510(k)-Zulassungsverfahren, die die FDA anbietet. Dieser Artikel verrät Ihnen, welche Arbeit Sie sich bei der Zulassung durch die „Abbreviation“ sparen können, welche Voraussetzungen Sie dafür erfüllen müssen und weshalb der Begriff „abbreviated“ irreführend sein kann. Inhaltsübersicht 1. Zulassungsverfahren » 2. Vereinfachungen » 3. Voraussetzungen » 4. Ablauf…
Weiterlesen
Ist die STED (Summary Technical Documentation) die Lösung für Medizinproduktehersteller, die ihre Produkte international zulassen müssen? Dieser Beitrag stellt die STED und damit einen Vorschlag vor, wie Hersteller die technische Dokumentation strukturieren können.
Mit dem Pre-Submission-Programm (kurz „Pre-Sub“) bietet die FDA ein formales Verfahren an, mit dem Hersteller bereits vor der eigentlichen Zulassung ihre Zulassungsstrategie sowie konkrete Fragen klären können. Ein Pre-Sub Request eignet sich unter anderem im Vorfeld von 510(k)s, De Novo Requests oder auch PMAs. Damit können auf beiden Seiten unnötige Kosten und Aufwände vermieden werden. Das Johner…
Weiterlesen
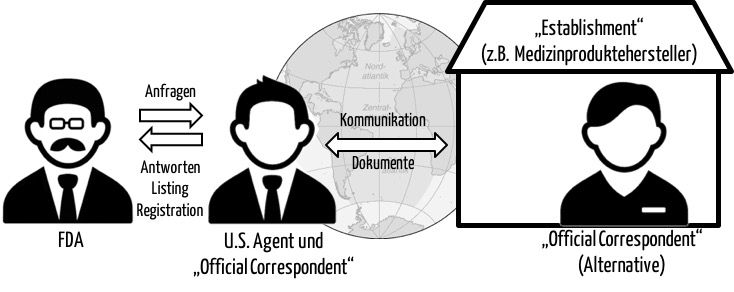
Medizinproduktehersteller, die ihren Sitz außerhalb der USA haben, benötigen einen U.S. Agent und einen „Official Correspondent“. Welche Anforderungen an einen U.S. Agent bzw. an einen „Official Correspondent“ gestellt werden, welche Aufgaben diese Rollen übernehmen müssen, erfahren Sie in diesem Beitrag.
Der russische Markt bietet mit 150 Millionen Konsumenten große Chancen für Medizinproduktehersteller, die ihre Produkte nach Russland exportieren wollen. Damit dies aber überhaupt möglich ist, müssen Medizinprodukte in Russland zugelassen werden. Der Eintritt in den russischen Markt muss gut vorbereitet werden, da zusätzlich zu sprachlichen Barrieren ein relativ komplexes und intransparentes Zulassungsverfahren für Medizinprodukte zu…
Weiterlesen
Ein CB Report ist ein Prüfbericht, der von einem akkreditierten CB Testlabor (CBTL) erstellt wird. Er kann als Grundlage für nationale Zertifizierungen und Zulassungen dienen. Test- und Prüflabore wie zahlreiche TÜVs oder der VDE bieten Prüfungen konform mit dem „CB Scheme“ an. Sie erstellen als Ergebnis solche CB Reports. Wann Medizinproduktehersteller diese CB Reports überhaupt benötigen, erfahren Sie…
Weiterlesen
Ein Request for Information kann Ihnen teure Anwaltskosten (teilweise) ersparen. Fragen Sie die Behörde doch selbst! So kommen Sie zu einer qualifizierten Antwort. Wenn auch nicht kostenlos. Lesen Sie hier, welche Fragen Ihnen die FDA beantwortet, wie Sie vorgehen müssen, um einen Request for Information zu stellen, und was die US-Behörde von Ihnen erwartet. Inhaltsübersicht…
Weiterlesen
Unter eCopy versteht die FDA die elektronische Kopie / Version von papierbasierten Einreichungen z.B. im Rahmen einer 510(k) Submission. Die FDA hat im Dezember 2015 eine überarbeitete Version des „Guidance Documents“ mit dem Titel „eCopy Program for Medical Device Submissions“ veröffentlicht. Inhaltsübersicht Ist das eCopy-Programm verpflichtend? » Welche Vorschriften gibt es? » Welche Tools bietet…
Weiterlesen