Die Medical Device Regulation (MDR) ist eine EU-Verordnung, die Hersteller einhalten müssen, die Medizinprodukte in der EU in den Verkehr bringen wollen. Sie betrifft auch Händler und Importeure dieser Produkte sowie Benannte Stellen.
Die Verordnung (EU) 2017/745 über Medizinprodukte, so der offizielle Titel der MDR, trat bereits 2017 in Kraft und gilt seit dem 26. Mai 2021.
Einstieg in die EU Medical Device Regulation schaffen
Medizinproduktehersteller
Einen ersten Überblick über die Medical Device Regulation verschafft Ihnen dieser Fachartikel zur MDR. Das darin verlinkte Video stellt Ihnen die EU-Medizinprodukteverordnung in wenigen Minuten vor. Weiterhin finden Sie dort:
- Die wichtigsten Anforderungen der MDR
- Aufbau und Struktur der Verordnung
- Weiterführende Informationen, z. B. zu den Übergangsfristen
Andere Akteure
Falls Sie kein Medizinproduktehersteller sind, sollten Sie mit diesen Seiten starten:
Unten auf dieser Schlagwortseite finden Sie alle weiteren Fachartikel zur MDR.
Unterstützung bei der Umsetzung der MDR 2017/745
a) Kostenfreie Angebote
Haben Sie noch Fragen zur MDR und zu deren Umsetzung? Antworten erhalten Sie in unserem kostenlosen Micro-Consulting.
Laden Sie sich das kostenlose Starter-Kit herunter. Es verschafft Ihnen einen Überblick über die regulatorische Landschaft und zeigt die 6 Schritte zur „Zulassung“ Ihres Medizinprodukts. Außerdem enthält es die MDR-Checkliste als PDF und im DOCX-Format!
b) Videos und E-Learning
Die Videotrainings im Auditgarant zeigen Ihnen Schritt für Schritt, wie Sie Ihre Technische Dokumentation und Ihr QM-System sowohl schlank und schnell als auch MDR-konform erstellen. Dazu stehen über 100 Templates und Musterdokumente zum Download bereit.
So schaffen Sie die Voraussetzungen, um Ihre Produkte schnell und sicher zuzulassen und in den Markt zu bringen.
c) Prüfung
Die Expertinnen und Experten des Johner Instituts helfen Ihnen beim Prüfen Ihrer Produkte:
d) Beratung
Nutzen Sie das Knowhow unserer Regulatory Affairs Experts, um Ihre
Nehmen Sie gleich Kontakt auf, damit wir gemeinsam klären können, wie Sie die regulatorischen Anforderungen der EU Medizinprodukteverordnung MDR schnell und einfach erfüllen und Ihre Produkte sicher in den Markt bringen.
Kontakt aufnehmen
Die MDR legt in den Artikeln 120 bis 123 die Übergangsbestimmungen einschließlich der Übergangsfristen fest. Allerdings sind diese Übergangsbestimmungen und Übergangsfristen sehr komplex formuliert. Daher laufen die Hersteller Gefahr, sie falsch zu verstehen und regulatorische Anforderungen nicht zu erfüllen oder unnötige Aufwände zu betreiben. Ein Ablaufdiagramm in Kapitel 2 dieses Artikels fasst die regulatorischen Anforderungen…
Details
Mit dem Label „For Research Use Only“ (RUO) erklären Hersteller, dass ihre Produkte nicht in diagnostischen Verfahren eingesetzt werden sollen. Sie vermeiden damit die aufwendige Dokumentation für In-vitro-Diagnostika (CE-IVD-Produkte). Dennoch verwenden z. B. medizinische Labore RUO-Produkte in diagnostischen Verfahren, teilweise sogar mit Wissen der Hersteller. Das kann Konsequenzen haben – nicht nur für Hersteller und…
Details
Orphan Medical Devices sind Medizinprodukte (und IVD) für kleine Patientengruppen. Die Entwicklung dieser Nischenprodukte rechnet sich für die Hersteller oft nicht. Das führt dazu, dass besonders vulnerable Gruppen wie Kinder nicht immer ausreichend medizinisch versorgt werden können. Dieser Artikel zeigt Lösungsansätze auf und ordnet die Leitlinie MDCG 2024-10 ein.
Details
Gesetzgeber ändern kontinuierlich die Regelwerke für Medizinprodukte. So ist das in Europa mit den EU-Verordnungen 2017/745 (MDR) und 2017/746 (IVDR) geschehen. Dadurch kommen Fragen zum Umgang mit Legacy Devices auf. Das sind Medizinprodukte, die Hersteller nach den alten Regelungen legal auf den Markt gebracht haben und weiterhin bringen, die aber gegebenenfalls die neuen Regelungen nicht…
Details
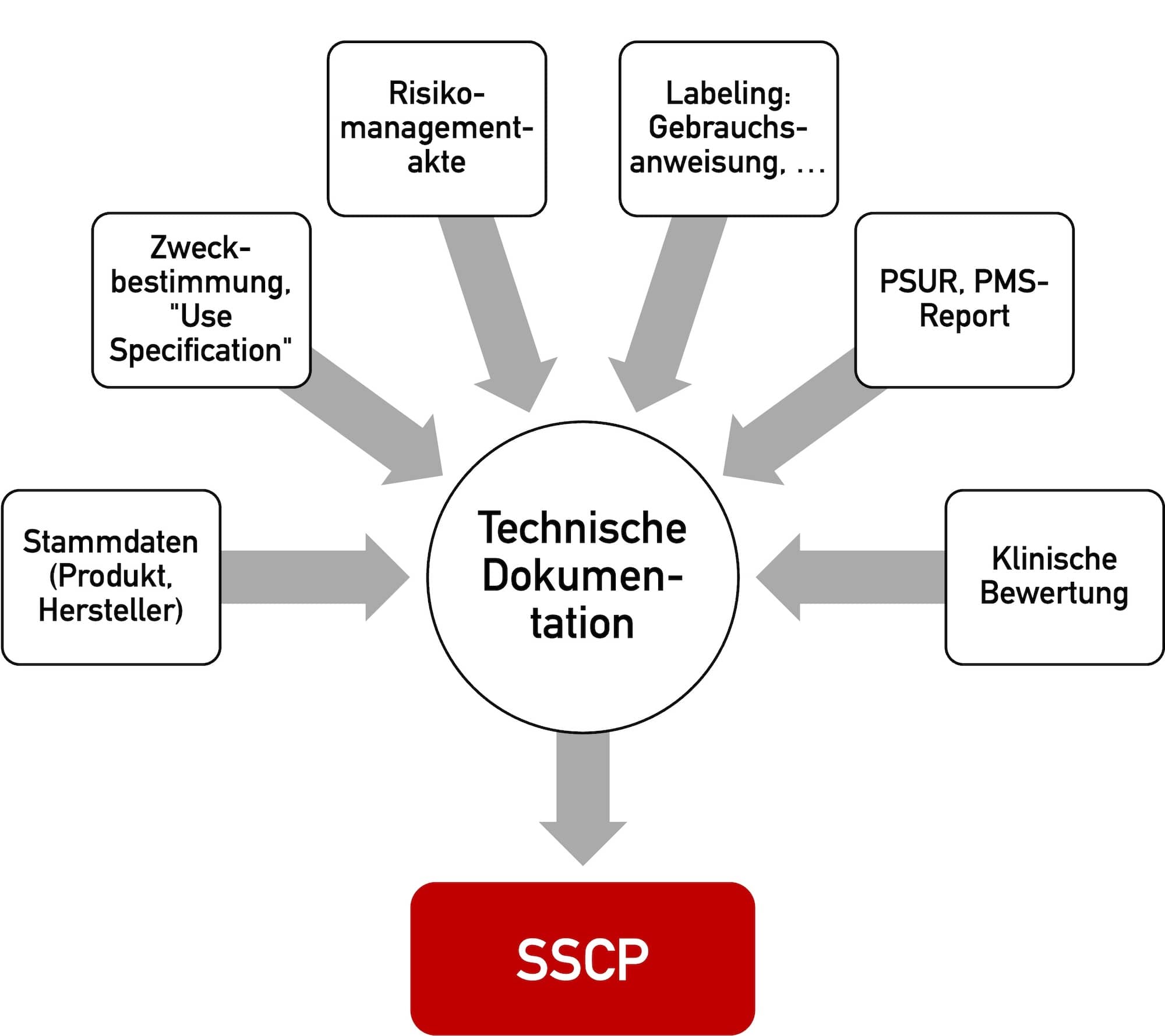
Die SSCP (“Summary of Safety and Clinical Performance”) ist nicht der einzige Bericht, den die MDR von vielen Medizinproduktehersteller einfordert. Mit dem PSUR und dem PMS-Report hat die SSCP sogar inhaltliche Überschneidungen. Die IVDR stellt mit dem SSP („Summary of Safety and Performance“) fast identische Anforderungen. Wie grenzen sich all diese Berichte voneinander ab? Wie…
Details
Mangelhaft gestaltete Gebrauchsanweisungen sind häufig Ursache für Benutzungsfehler, welche zu Schäden bei Patienten und Anwendern führen können. Zudem unterliegen Gebrauchsanweisungen für Medizinprodukte und IVD strengen regulatorischen Anforderungen. MDR, IVDR, die FDA sowie zahlreiche Normen stellen spezifische Anforderungen an Gebrauchsanweisungen. In diesem Artikel erfahren Sie, wie Sie eine Gebrauchsanweisung schreiben,
Details
Die europäische Gesetzgebung definiert Systeme und Behandlungseinheiten („systems and procedure packs“) und unterscheidet verschiedene Konstellationen. Die regulatorischen Anforderungen an die Hersteller hängen stark von diesen Konstellationen ab. Lesen Sie in diesem Artikel, was die Gesetzgeber unter Systemen und Behandlungseinheiten verstehen, was die wichtigsten gesetzlichen Anforderungen an die Hersteller sind und welche typischen Fehler Sie vermeiden…
Details
Clinical Affairs Manager nehmen beim Nachweis von Sicherheit, Leistung und Nutzen eines Medizinprodukts eine wesentliche Rolle ein. Dabei agieren sie im Spannungsfeld von Wissenschaft und Regulierung. Dieser Fachartikel beleuchtet die facettenreiche Rolle dieser Experts: Aufgaben und Herausforderungen, aber auch Verdienst- und Karrieremöglichkeiten.
Details
PDMS steht für Patientendatenmanagementsystem. Diese klinischen Informationssysteme finden sich typischerweise in Krankenhäusern, v. a. in den Abteilungen, die Patienten intensivmedizinisch behandeln. Durch die Förderungen des Krankenhaus-Zukunftsgesetzes (KHZG) erleben die PMDS einen neuen Boom. Dieser Artikel
Details
Welche fünf häufigsten Irrtümer und Fehler Medizinproduktehersteller bei der klinischen Bewertung vermeiden sollten und wie dies gelingt, zeigt dieser Artikel.