Die Medical Device Regulation (MDR) ist eine EU-Verordnung, die Hersteller einhalten müssen, die Medizinprodukte in der EU in den Verkehr bringen wollen. Sie betrifft auch Händler und Importeure dieser Produkte sowie Benannte Stellen.
Die Verordnung (EU) 2017/745 über Medizinprodukte, so der offizielle Titel der MDR, trat bereits 2017 in Kraft und gilt seit dem 26. Mai 2021.
Einstieg in die Medical Device Regulation schaffen
Medizinproduktehersteller
Einen ersten Überblick über die Medical Device Regulation verschafft Ihnen dieser Fachartikel zur MDR. Das darin verlinkte Video stellt Ihnen die EU-Medizinprodukteverordnung in wenigen Minuten vor. Weiterhin finden Sie dort:
- Die wichtigsten Anforderungen der MDR
- Aufbau und Struktur der Verordnung
- Weiterführende Informationen, z. B. zu den Übergangsfristen
Andere Akteure
Falls Sie kein Medizinproduktehersteller sind, sollten Sie mit diesen Seiten starten:
Unten auf dieser Schlagwortseite finden Sie alle weiteren Fachartikel zur MDR.
Unterstützung bei der Umsetzung der MDR
a) Kostenfreie Angebote
Haben Sie noch Fragen zur MDR und zu deren Umsetzung? Antworten erhalten Sie in unserem kostenlosen Micro-Consulting.
Laden Sie sich das kostenlose Starter-Kit herunter. Es verschafft Ihnen einen Überblick über die regulatorische Landschaft und zeigt die 6 Schritte zur „Zulassung“ Ihres Medizinprodukts. Außerdem enthält es die MDR-Checkliste als PDF und im DOCX-Format!
b) Videos und E-Learning
Die Videotrainings im Auditgarant zeigen Ihnen Schritt für Schritt, wie Sie Ihre Technische Dokumentation und Ihr QM-System sowohl schlank und schnell als auch MDR-konform erstellen. Dazu stehen über 100 Templates und Musterdokumente zum Download bereit.
So schaffen Sie die Voraussetzungen, um Ihre Produkte schnell und sicher zuzulassen und in den Markt zu bringen.
c) Prüfung
Die Expertinnen und Experten des Johner Instituts helfen Ihnen beim Prüfen Ihrer Produkte:
d) Beratung
Nutzen Sie das Knowhow unserer Regulatory Affairs Experts, um Ihre
Nehmen Sie gleich Kontakt auf, damit wir gemeinsam klären können, wie Sie die regulatorischen Anforderungen der MDR schnell und einfach erfüllen und Ihre Produkte sicher in den Markt bringen.
Kontakt aufnehmen
Die MDR verpflichtet die Hersteller von Medizinprodukten zur Post-Market Surveillance (PMS) und damit zum Sammeln von PMS-Daten. Dieser Artikel soll zur Klärung beitragen, welche regulatorischen Anforderungen Hersteller beim Sammeln dieser PMS-Daten beachten müssen. Insbesondere soll er aufzeigen, ob Hersteller eine Ethik-Kommission einbeziehen müssen, wenn die Daten bei der Routine-Anwendung der Produkte anfallen.
Die digitale Transformation Benannter Stellen wird das Medizinprodukte-Ökosystem in den nächsten Jahren spürbar umkrempeln. Dieser Artikel beschreibt
Die Medical Device Coordination Group (MDCG) – auf Deutsch Koordinierungsgruppe Medizinprodukte – ist ein von MDR und IVDR gefordertes Expertengremium. Die MDCG wird gelegentlich mit einer anderen Koordinierungsgruppe oder mit Expertengremien (Expert Panels) verwechselt. Wie sich diese Gruppen abgrenzen, erfahren Sie hier. Lesen Sie in diesem Artikel, wie Sie von den Ergebnissen der MDCG-Arbeiten betroffen…
Weiterlesen
Die Anforderungen an klinische Prüfungen zur Bewertung eines Produkts sind unter der MDR enorm gestiegen. Erfahren Sie hier das Wichtigste, was es über den regulatorischen Weg der klinischen Prüfungen im Rahmen der MDR zu wissen gibt.
Das Medizinprodukterecht-Durchführungsgesetz (MPDG) löst in Deutschland das Medizinproduktegesetz (MPG) ab. Sie finden hier die Version des MPDG vom 28.04.2020. Im Gegensatz zum MPG ist das MPDG kein eigenständiges Werk, sondern ergänzt nur die EU-Medizinprodukteverordnungen (MDR, IVDR) um nationale Vorgaben. Dieser Artikel verschafft Ihnen einen ersten Einblick und verrät, auf was Sie als Medizinproduktehersteller achten müssen,…
Weiterlesen
Mit dem UDI-System hat die EU eine Pflicht zur Identifikation und Registrierung von Medizinprodukten eingeführt, die weit über das unter der MDD noch Geforderte hinausgeht. Selbst für Standalone-Software fordert die Medical Device Regulation MDR eine UDI. Lesen Sie hier, auf was Sie sich vorbereiten müssen.
Weiterlesen
Mangelhaft gestaltete Gebrauchsanweisungen sind häufig Ursache für Benutzungsfehler, welche zu Schäden bei Patienten und Anwendern führen können. Zudem unterliegen Gebrauchsanweisungen für Medizinprodukte und IVD strengen regulatorischen Anforderungen. MDR, IVDR, die FDA sowie zahlreiche Normen stellen spezifische Anforderungen an Gebrauchsanweisungen. In diesem Artikel erfahren Sie, wie Sie eine Gebrauchsanweisung schreiben,
Weiterlesen
Unter Post-Market Surveillance (Überwachung nach der Inverkehrbringung) versteht man einen proaktiven und systematischen Prozess, um aus Informationen über Medizinprodukte, die bereits in Verkehr gebracht wurden, notwendige Korrektur- und Vorbeugemaßnahmen (CAPA, corrective and preventive action) abzuleiten. Wir haben für Sie eine Checkliste zur Post-Market-Surveillance erstellt. Mit dieser Checkliste können Sie herausfinden, ob Sie die regulatorischen Anforderungen…
Weiterlesen
Hersteller von Bestandsprodukten (legacy devices) können derzeit ihre Produkte noch auf dem Markt behalten, ohne einen Konformitätsnachweis nach der Verordnung 2017/745 über Medizinprodukte (MDR) zu erbringen. Spätestens mit Ende der Übergangsfrist müssen Hersteller jedoch die hierfür notwendigen klinischen Daten bereitstellen. Die Anforderungen an klinische Daten, die als Nachweis für die Konformität nutzbar sind, sind allerdings…
Weiterlesen
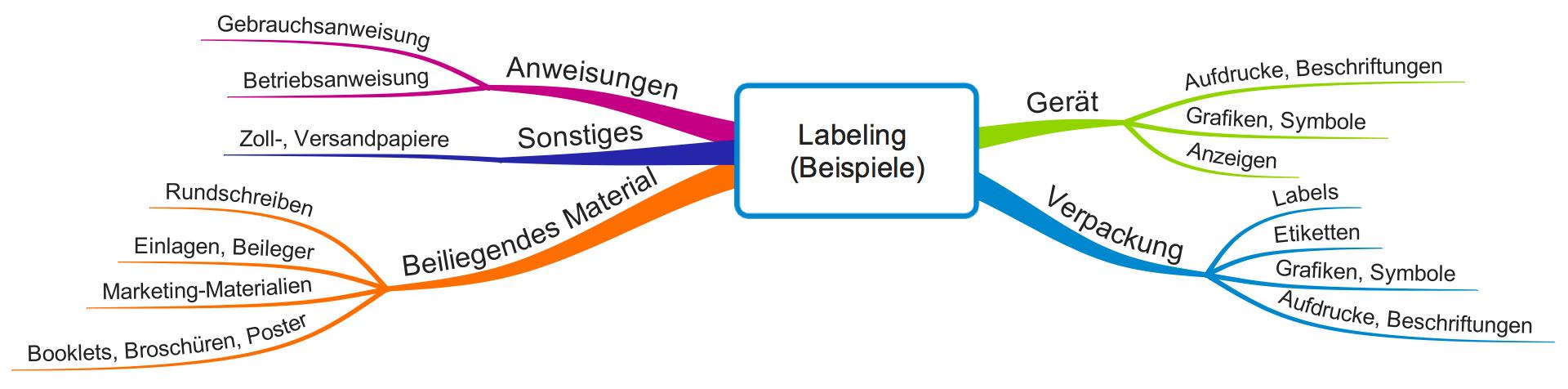
An das Labeling stellen sowohl die europäischen als auch die US-amerikanischen Regularien Anforderungen. Allerdings verstehen beide Rechtssysteme den Begriff nicht völlig identisch. Selbst die Schreibweisen unterscheiden sich: Labeling in den USA, Labelling in Europa. Erfahren Sie in diesem Artikel, was Sie beim Labeling jeweils beachten müssen. Apropos Schreibeweise: Wir verwenden in diesem Artikel das amerikanische…
Weiterlesen