Unter IT Security (auch IT-Sicherheit oder Informationssicherheit genannt) versteht man die Fähigkeit von IT-Systemen (und den zugehörigen Organisationen), die Vertraulichkeit, Verfügbarkeit und Integrität (von Systemen und Daten) zu gewährleisten.
Inhalt
Diese Seite verschafft einen Überblick und verlinkt auf relevante Fachartikel zu den Themen:
- Ziele der IT Security
- Regulatorische Anforderungen an die IT Security
- Hilfestellung bei der Umsetzung
- Unterstützung
1. Ziele der IT-Security
Mit dem Akronym CIA lassen sich die Ziele der IT-Security einfach merken:
- Confidentiality: Vertraulichkeit von z. B. personenbezogenen Daten
- Integrity: Die Unverfälschtheit von Daten und Systemen
- Availability: Die Verfügbarkeit von Daten und Systemen
Manchmal ergänzt man diese Liste noch um weitere Ziele:
- Accountability: Die Fähigkeit, Tätigkeiten wie die Veränderung von Daten und Systemen einer Person zuzuordnen
- Authenticity: Die Echtheit und Vertrauenswürdigkeit von Daten und Systemen
Im Gesundheitswesen spielt die Safety eine besonders große Rolle. Deren Ziel besteht darin, (körperliche) Schäden von Patienten, Anwendern und Dritten zu vermeiden.
Hinweis
Im Deutschen übersetzt man sowohl Security als auch Safety mit „Sicherheit“, was irreführend sein kann.
2. Regulatorische Anforderungen an die IT Security
Weiterführende Informationen
Beachten Sie den Beitrag zur IT-Sicherheit im Gesundheitswesen, der auf die speziellen Herausforderungen und regulatorischen Anforderungen an die IT-Sicherheit im Gesundheitswesen bzw. in der Medizintechnik eingeht.
In Europa sind u. a. die folgenden Gesetze zu beachten:
- EU-Medizinprodukteverordnungen MDR und IVDR
- EU Datenschutzgrundverordnung DSGVO
- Digitale-Versorgung-Gesetz (DVG) und die DiGAV
- NIS-2
Außerdem steht die Norm IEC 81001-5-1 kurz vor ihrer Harmonisierung.
In den USA sind beispielsweise relevant:
Ein weiterer Artikel betrachtet die Security Patches aus regulatorischer Sicht, ein weiterer die Rolle der Software Bill of Materials SBOM.
Hilfreich sind die Überlegungen zur IT Security bei Legacy Devices. und zur Integration eine IT-Sicherheitsmanagementsystems nach ISO 27001 mit dem Qualitätsmanagementssystem.
3. Hilfestellung bei der Umsetzung
a) Leitfäden
Der Leitfaden des Johner Instituts zur IT Security dient Herstellern als Checkliste. Die Anforderungen lassen sich gut prüfen, weil sie gemäß dem Software-Lebenszyklus organisiert und als binär beantwortbare Kriterien formuliert sind.
b) Normen
Viele Normen haben den Anspruch, Best Practices zu formulieren. Diese sollten Hersteller berücksichtigen, um die IT Security nach dem Stand der Technik zu gewährleisten.
- IEC 81001-5-1: Die harmonisierte Norm für sichere Health Software
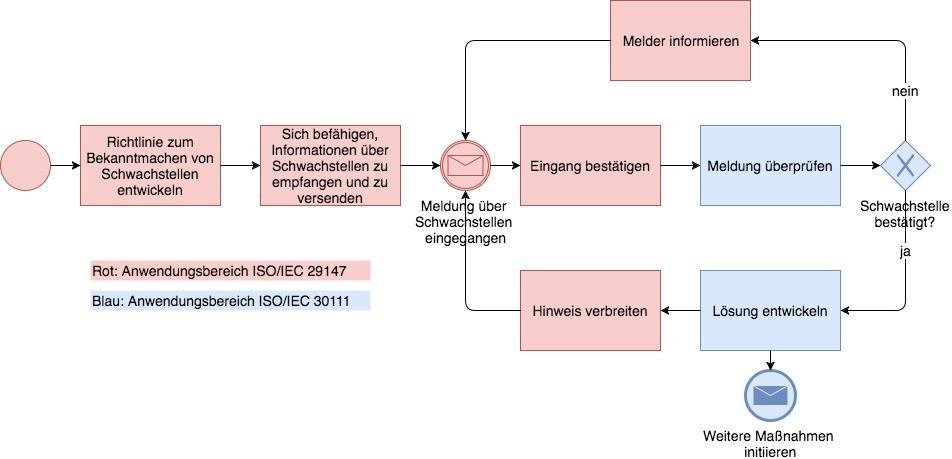
- ISO 29147: Wie Hersteller IT-Schwachstellen offenlegen sollten
- IEC 60601-4-5: Die Norm zur IT-Sicherheit auch für Standalone-Software?
- ISO 27001: IT-Sicherheitsmanagement für alle Medizinproduktehersteller?
- IEC 62443-4-1: IT-Sicherheit als Teil des Produktlebenszyklus
- UL 2900 – Weshalb Sie den IT-Security-Standard kennen, aber niemals kaufen sollten
- ISO/IEC 15408: IT-Sicherheit von (Medizin-)Produkten bewerten
c) Methoden
Die Normen referenzieren Methoden, die zur Stärkung der IT-Sicherheit beitragen. Diese werden in den folgenden Artikel vorgestellt:
d) Spezifische Kontexte
Weitere Artikel adressieren bestimmte technische und organisatorische Kontexte:
4. Unterstützung
Haben Sie noch Fragen, beispielsweise zur IT-Sicherheit? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Johner Institut unterstützt Sie gerne, damit Sie die IT Security Ihrer Produkte und Organisation gewährleisten und unnötigen Ärger zu vermeiden:
- Das Seminar IT Security verschafft einen soliden Einstieg speziell für Medizinproduktehersteller.
- Die Security-Expert:innen helfen beim Gestalten sicherer Medizinprodukte, u. a. beim Threat Modeling und beim Risikomanagement.
- Unsere Expert:innen prüfen die IT-Sicherheit, z. B. durch Penetrations- und Fuzz-Tests.
- Unsere Expert:innen prüfen die Nachweise der IT-Sicherheit in technischen Dokumentationen und Zulassungsakten auf Vollständigkeit und Gesetzeskonformität. Das erspart unnötige Verzögerungen bei Zulassungen.
Melden Sie sich gerne! Das Team des Johner Instituts freut sich, helfen zu dürfen!
ISO 29147 – noch nie gehört? Dabei ist diese Norm gerade für Hersteller von Medizinprodukten sehr hilfreich: Sie sollten sich die ISO 29147 zunutze machen, auch um regulatorische Anforderungen zu erfüllen. Welche Anforderungen das sind und wie Sie die ISO 29147 dabei einbeziehen können, lesen Sie in diesem Beitrag.
Details
Der Health Insurance Portability and Accountability Act (HIPAA) ist ein US-amerikanisches Gesetz, das Anforderungen an den Umgang mit geschützten Gesundheitsdaten stellt. Institutionen, die in den USA diese Daten erheben oder verarbeiten, sowie deren Unterauftraggeber müssen den HIPAA befolgen, um Sanktionen zu vermeiden. Besonders für europäische Firmen ist der HIPAA ein nur schwer verständliches und kaum…
Details
Wie gefährdet die IT-Sicherheit im Gesundheitswesen ist, wissen wir nicht erst seit Februar 2016: Damals wurden die IT-Infrastrukturen vieler Kliniken durch einen einfachen Virenangriff stillgelegt. Daher achten die Behörden strenger darauf, dass nicht nur Kliniken, sondern auch Hersteller die IT-Sicherheit ihrer (Medizin-)Produkte gewährleisten. In diesem Artikel erhalten Sie einen Überblick darüber, was die IT-Sicherheit im…
Details
Das Digitale-Versorgung-Gesetz (DVG) bietet Herstellern digitaler Medizinprodukte eine neue Möglichkeit, Geld zu verdienen. Die Kostenerstattung soll schneller und einfacher erfolgen als herkömmliche Verfahren, z. B. die bisherige Aufnahme in den Hilfsmittelkatalog.
Details
Die dritte Ausgabe der ISO 14971 steht seit Dezember 2019 bereit. Die neue Version der ISO 14971 wurde als ISO 14971:2019 publiziert. Sie ist eine evolutionäre Weiterentwicklung der ISO 14971:2007 und bricht nicht mit den bisherigen Konzepten. Hersteller sollten sich mit den neuen und geänderten Anforderungen dieser Norm vertraut machen. Noch im Dezember…
Details
Das Threat Modeling ist für Sie ein „Pflichtthema“, wenn Sie Medizinprodukte herstellen, die Software enthalten oder die Software sind. Denn das Threat Modeling ist ein strukturierter Prozess zur systematischen Analyse von IT-Sicherheitsrisiken, den Auditoren als den „Stand der Technik“ voraussetzen.
Das Common Vulnerability Scoring System CVSS dient in der IT Security nicht nur der Klassifizierung des Schweregrads von Software-Schwachstellen. Dieses CVSS-Framework wird auch genutzt, um diese Schwachstellen zu charakterisieren und einheitlich zu einzuschätzen. Lernen Sie dieses Common Vulnerability Scoring System CVSS verstehen und damit die Meldungen der NIST. Diese Meldungen sollten Sie als Hersteller (z.B.…
Details
Die Normenfamilie IEC 60601 ist eigentlich nur für medizinisch elektrische Geräte anzuwenden. Doch die IEC/TR 60601-4-5 bildet eine Ausnahme: Dieser Technical Report zur IT-Sicherheit hat alle Medizinprodukte im „Scope“, die in IT-Netzwerke eingebunden sind. Das betrifft auch Software as a Medical Device. Erfahren Sie, welche Anforderungen die IEC/TR 60601-4-5 an Hersteller und Betreiber stellt. Diese…
Details
Das Bundesdatenschutzgesetz fordert die Anonymisierung und Pseudonymisierung von personenbezogenen Daten. Was sich hinter den beiden Begriffen verbirgt und wie Sie die gesetzlichen Anforderungen erfüllen, erläutert dieser Artikel. Update: HIPAA Forderungen berücksichtigt
Details
Gemeinsam mit dem TÜV SÜD, dem TÜV Nord und mit Unterstützung von Dr. Heidenreich (Siemens) hat das Johner Institut am 21.11. einen Leitfaden zur IT-Sicherheit speziell für Medizinproduktehersteller veröffentlicht.