Als grundlegende Sicherheits- und Leistungsanforderungen bezeichnen die EU-Medizinprodukteverordnungen (MDR und IVDR) die Anforderungen, die jedes Medizinprodukt erfüllen muss. Auf Englisch heißen diese general safety and performance requirements, weshalb sie mit GSPR abgekürzt werden.
Die frühere Medizinprodukterichtlinie (MDD) sprach von den „grundlegenden Anforderungen“.
Inhalt
Sie finden auf dieser Seite Verweise auf relevante Fachartikel.
- Beispiele für grundlegende Sicherheits- und Leistungsanforderungen
- Nachweis der grundlegenden Sicherheits- und Leistungsanforderungen
- Unterschiede zwischen den Anforderungen der MDR und der MDD
- Unterstützung beim Nachweis dieser Anforderungen
1. Beispiele für grundlegende Sicherheits- und Leistungsanforderungen
MDR und IVDR listen die grundlegenden Sicherheits- und Leistungsanforderungen in ihren jeweiligen Anhängen I. Beispiele für GSPR sind:
Hinweis
Die grundlegenden Sicherheits- und Leistungsanforderungen hängen nicht von der Klasse der Medizinprodukte ab.
2. Nachweis der grundlegenden Anforderungen
Den Nachweis, dass die Medizinprodukte diese grundlegenden Anforderungen erfüllen, erbringen die Hersteller im Rahmen eines Konformitätsbewertungsverfahrens selbst. Abhängig von diesem Konformitätsbewertungsverfahren müssen sie Benannte Stellen einbeziehen und können sie externe Prüfungen einbeziehen, müssen das aber nicht.
Meist nutzen die Hersteller harmonisierte Normen, um die Konformität mit den grundlegenden Sicherheits- und Leistungsanforderungen vermuten zu lassen.
Die MDR und IVDR fordern zudem die Einhaltung sogenannter gemeinsamer Spezifikationen (common specifications).
Tipp
Als Hersteller müssen Sie die Konformität sehr präzise und Satz für Satz nachweisen. Nutzen Sie dafür Checklisten wie die MDR-Checkliste.
3. Unterschiede zwischen MDD/IVDD und MDR/IVDR
Die MDR und IVDR formulieren die Anforderungen nicht nur granularer als die MDD bzw. IVDD, sondern sie hat diese auch erweitert. Zudem trennen die MDR und IVDR zwischen den „grundlegenden Sicherheits- und Leistungsanforderungen“ (Anhang I) und den Anforderungen und deren Nachweis in der Technischen Dokumentation (Anhang II).
Die MDR stellt im Vergleich zur MDD zusätzlich explizit Anforderungen an:
- IT-Sicherheit
- Produkte, die Arzneimittel enthalten
- Produkte, die Gewebe menschlichen oder tierischen Ursprungs enthalten
- Entsorgung
- Aktive implantierbare Produkte (die nicht im „Scope“ der MDD waren)
- Produkte, die durch Laien genutzt werden sollen
- Labeling
5. Unterstützung
Haben Sie noch Fragen zu den grundlegenden Anforderungen an Medizinprodukte? Dann nutzen Sie das kostenfreie Micro-Consulting.
Das Johner Institut unterstützt Medizinproduktehersteller dabei,
- die Anforderungen nachzuweisen mit einer schlanken Technischen Dokumentation,
- diese Nachweise vor dem Review durch eine Benannte Stelle zu prüfen, um Probleme bei der „Zulassung“ zu vermeiden,
- das QM-System auf Audits vorzubereiten.
Melden Sie sich! Das Team des Johner Institut freut sich auf Sie!
Die Parametrisierung von Software – man spricht in dem Kontext auch von Parametrierung, Customizing oder Konfiguration – führt regelmäßig zu Diskussionen z.B. über die Verantwortlichkeit und über die Abgrenzung zur Eigenherstellung. Dieser Artikel gibt Herstellern und deren Kunden wichtige Hinweise, auf was sie bei der Parametrisierung achten sollten und wie sie die üblichen Fallen vermeiden…
Weiterlesen
Der IEC TR 62366-2 ist ein „Technical Report“, den Medizinproduktehersteller als „Gebrauchsanweisung“ für die IEC 62366-1 nutzen können. Der Technical Report gibt konkrete Handlungsleitung beim Usability Engineering, um die Anforderungen der IEC 62366-1 zu erfüllen. Dieser Artikel verschafft Ihnen einen Überblick über den mehr als hundertseitigen IEC TR 62366-2.
Weiterlesen
Unangekündigte Audits sind stichprobenhafte Prüfungen von Qualitätsmanagement-Systemen durch benannte Stellen mit den folgenden Zielen: Herausfinden, ob Medizinproduktehersteller konform mit ihrem QM-System (z.B. gemäß ISO 13485) arbeiten Abweichungen schnell identifizieren und darauf reagieren können Betrugsversuche zuverlässiger aufdecken Inzwischen liegen erste Erfahrungen mit unangekündigten Audits vor. Update: Änderungen durch die MDR.
Weiterlesen
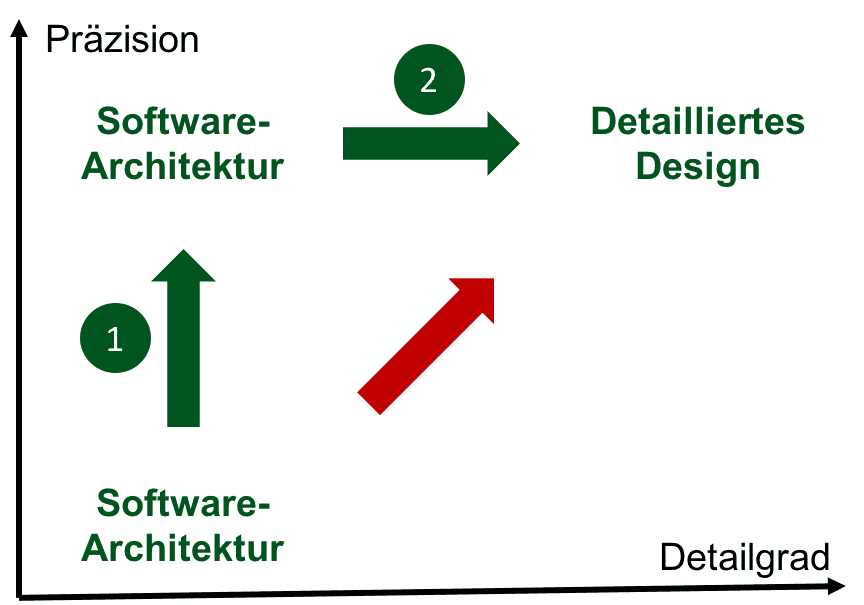
Ein „detailliertes Design“ fordern sowohl die IEC 62304 als auch die FDA, jedoch ohne diesen Begriff präzise zu definieren. Lesen Sie hier, wie Sie die regulatorischen Anforderungen schnell und „auditsicher“ erfüllen können. Inhaltsübersicht Detailliertes Design: Begriffsdefinition » Regulatorische Anforderungen » Die 4 wichtigsten Praxis-Tipps »
Weiterlesen
Medizinprodukte mit Messfunktion sind etwas Besonderes. Wichtig (u.a.): Messfunktion beeinflusst die Klassifizierung. Doch nicht alles, was misst, hat eine Messfunktion. Bei der Einordnung hilft die MEDDEV 2.1./5.
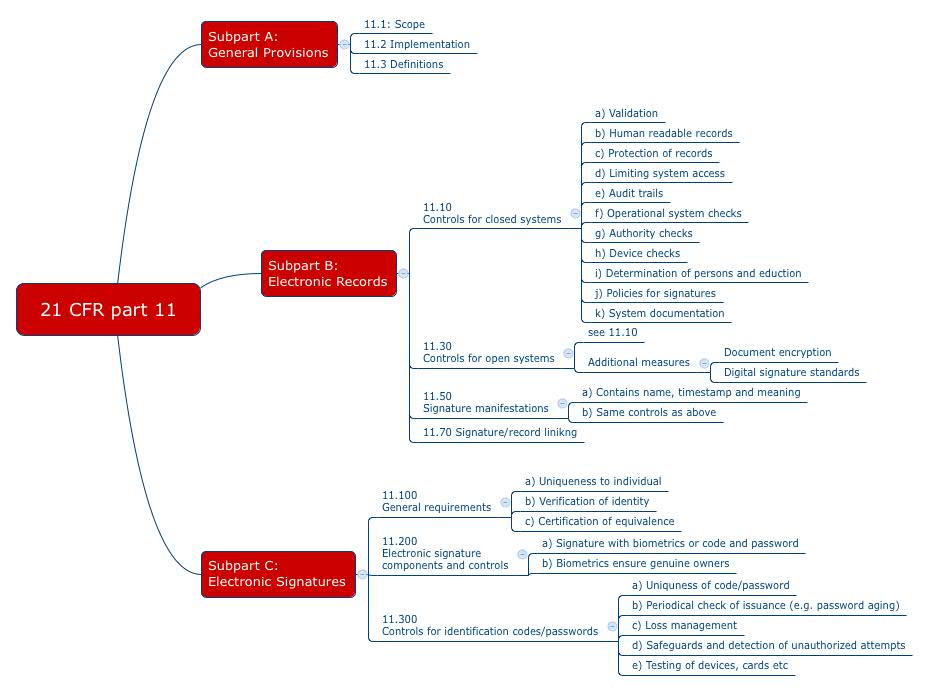
Mit dem 21 CFR part 11 formuliert die FDA Anforderungen an die elektronischen Aufzeichnungen und Unterschriften, die sich auch an Medizinproduktehersteller richten. Viele Firmen drucken alles auf Papier aus und unterschreiben dann mit Hand, um diese Anforderungen des „part 11“ zu umgehen. Ist das wirklich notwendig?
Weiterlesen
Scripting ist eine Form des Programmierens, bei dem Skriptsprachen wie Python, PHP, JavaScript und VB Script zum Einsatz kommen, also Programmiersprachen, bei denen der Code nicht kompiliert, sondern von einem Interpreter interpretiert wird. Das Scripting bei Medizinprodukten birgt einige regulatorische Fallen, die Sie unbedingt kennen und vermeiden sollten. Dieser Beitrag gibt Ihnen Tipps dazu.
Weiterlesen