Das Software-Testing zählt neben den Code-Reviews zur Software-Verifizierung. Gesetze und Normen stellen Anforderungen an die Art und den Umfang des Software-Testings.
Inhalt
Diese Seite verschafft Ihnen einen schnellen Überblick über das Software-Testing und verlinkt für weitergehende Informationen auf Fachartikel.
- Software-Testing: Die Grundlagen
- Regulatorische Anforderungen
- Sieben Praxistipps
- Unterstützung
1. Software-Testing: Die Grundlagen
a) Software-Testing als Teil der Software-Qualitätssicherung
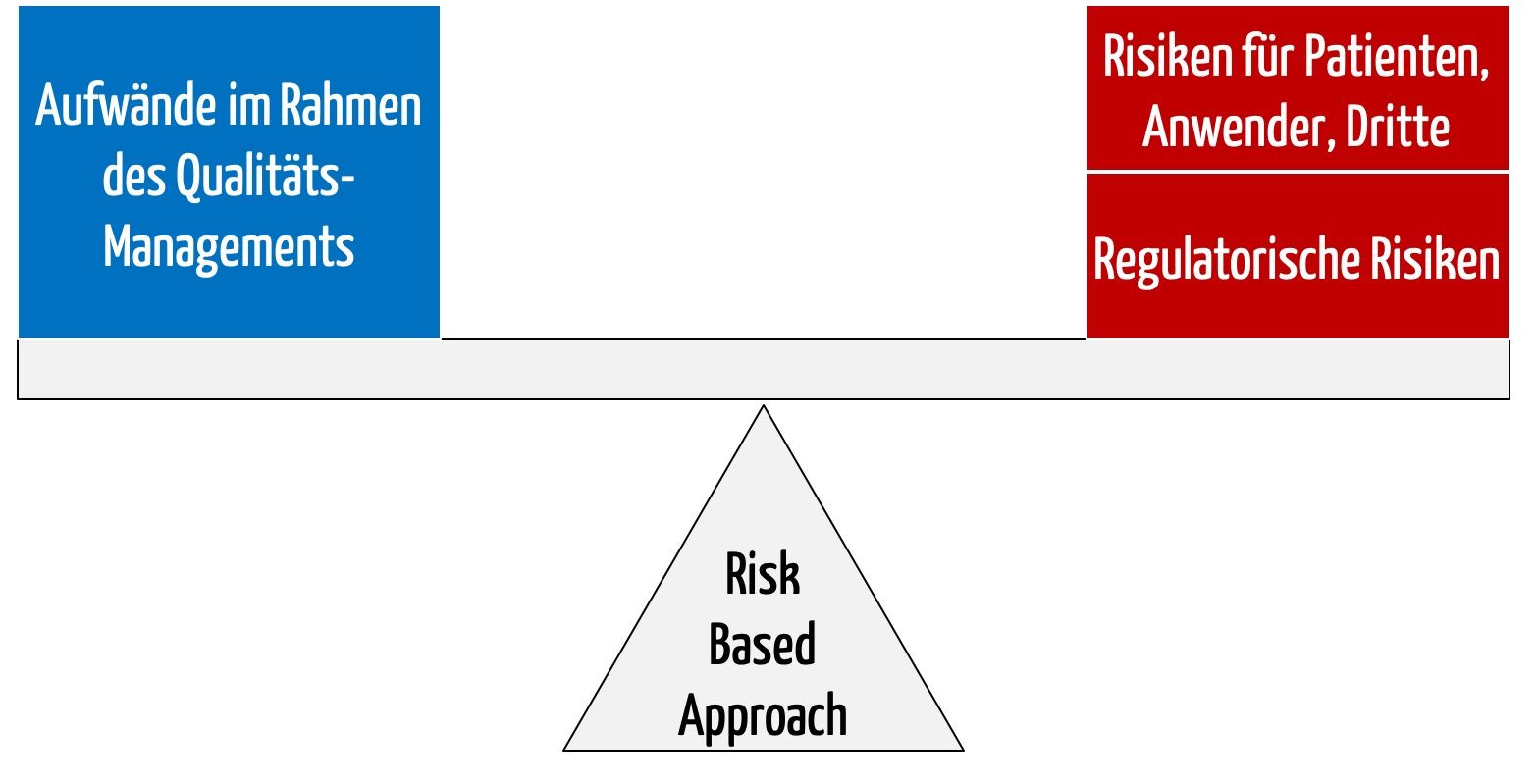
Das Ziel des Testens von Software besteht darin, Fehler in der Software zu finden. Damit ist das Software-Testing ein Teil der analytischen Qualitätssicherung (s. Abb. 1).
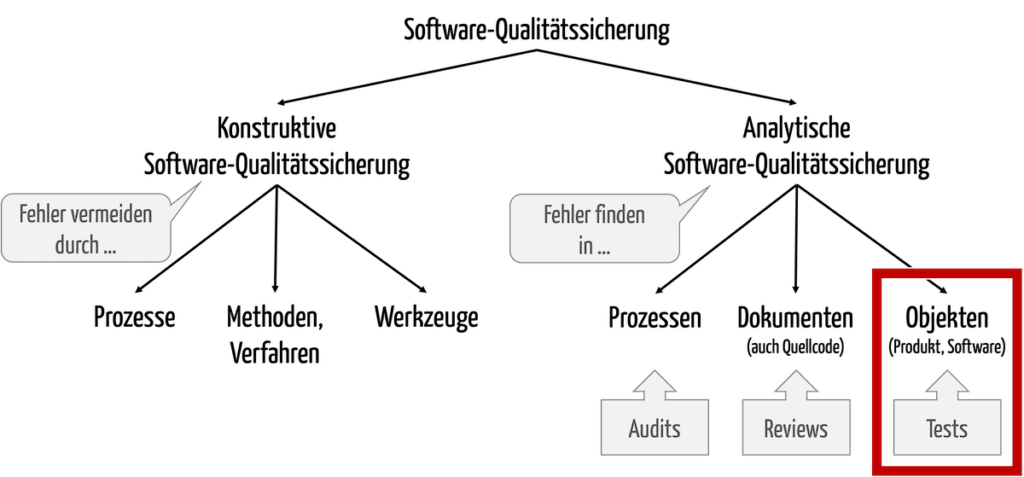
Abb. 1: Software-Tests sind ein Teil der analytischen Qualitätssicherung.
Vorsicht!
Es weder möglich noch erlaubt, die Software-Qualität nur mit Testen zu erreichen.
Zur konstruktiven Qualitätssicherung zählen
- Prozesse, z. B. Entwicklungsprozesse
- Methoden und Verfahren, z. B. das Requirements-Engineering, das Modellieren mit UML und das Ableiten von Testfällen mit Äquivalenzklassen
- Werkzeuge wie ALM-Werkzeuge, Entwicklungsumgebungen, Modellierungs- und Testwerkzeuge
Auf der Meta-Ebene gibt es Gesetze und Normen sowie Schulungs- und Weiterbildungsmaßnahmen, die sich u. a. auf die drei oben genannten Aspekte beziehen.
Die analytische Qualitätssicherung versucht, mithilfe von verschiedenen Prozessen, Methoden und Werkzeugen Fehler in verschiedenen Testobjekten zu finden. Man unterscheidet:
b) Taxonomie der Software-Testmethoden
Software-Tests lassen sich nach vielen Kriterien sortieren (s. Abb. 2).
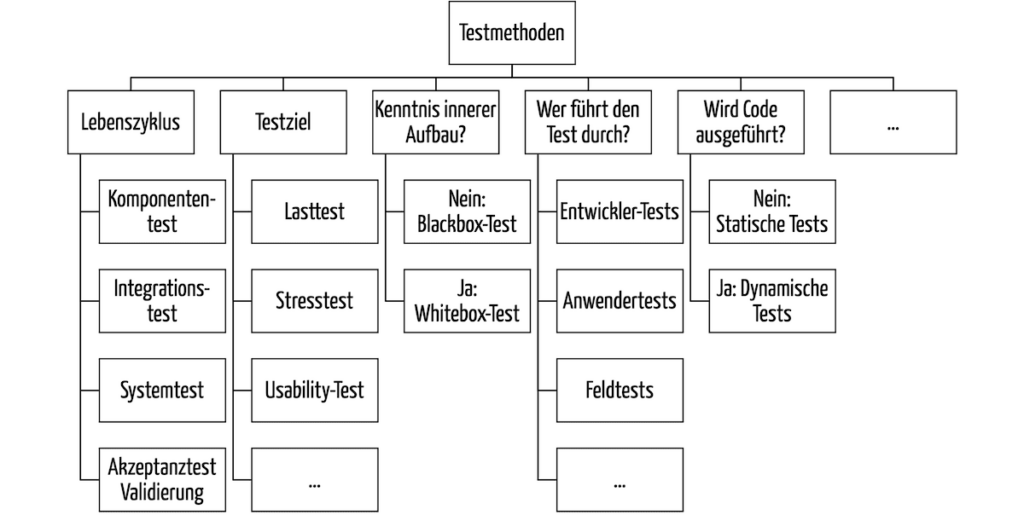
Abb. 2: Taxonomie der Methoden beim Software-Testing
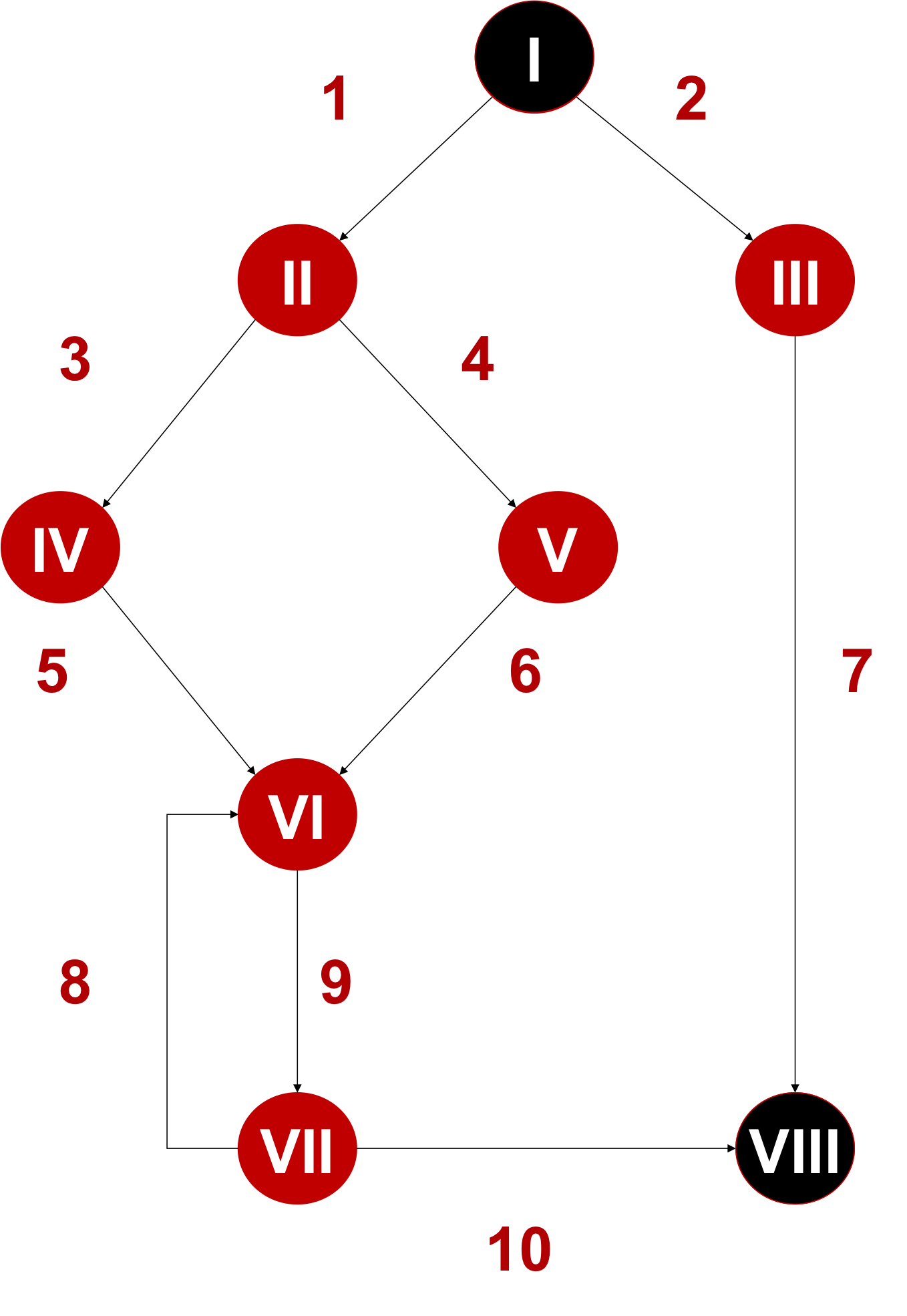
Die IEC 62304 unterteilt ihre Anforderungen nach den Lebenszyklus-Phasen (s. Abb. 3).
2. Regulatorische Anforderungen
a) Europa
MDR, IVDR
Die MDR und IVDR verlangen Software-Lebenszyklus-Prozesse nach Stand der Technik (s. MDR, Anhang I, Abschnitt 17.2) und die Dokumentation der „Verifizierung und Validierung der Software“ (s. Anhang II, Abschnitt 6.1.b).
IEC 62304
Die für diese EU-Verordnungen harmonisierte Norm IEC 62304 fordert das Software-Testing in folgenden Kapiteln:
Bei der Software-Freigabe (Kapitel 5.8) müssen die Hersteller überprüfen, ob die Software-Tests so durchgeführt wurden, wie im Softwareentwicklungsplan beschrieben.
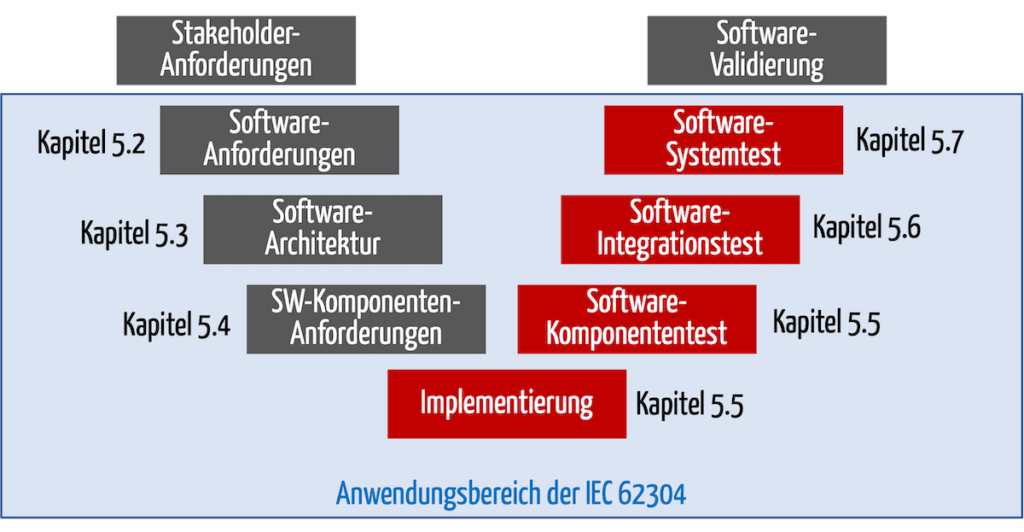
Abb. 3: Die IEC 62304 fordert in den Kapitel 5.5 bis 5.7 die Verifizierung der Software durch u. a. Software-Tests.
Bei Legacy-Software erlaubt die Norm Ausnahmen.
IEC 82304
Die Software-Validierung fällt nicht in den Anwendungsbereich der IEC 62304, sondern den der IEC 82304-1. Allerdings sind deren Anforderungen sehr unspezifisch.
Wichtige Methoden zur Validierung von Software sind die klinische Bewertung und die Usability-Validierung, typischerweise in Form einer summativen Evaluation bzw. eines Usability-Tests.
b) FDA
Die FDA erkennt die IEC 62304 als „recognized standard“ an. Aber die relevantesten Vorgaben an die Software-Architektur formuliert die Behörde in ihrer Leitlinie General Prinicples of Software Validation.
Die Leitlinie Content of the premarket submission gibt vor, welche Unterlagen Hersteller einreichen müssen. Darin macht die FDA auch Vorgaben für das Software-Testing.
c) Sonstiges
Hersteller, die die Anforderungen der FDA und der EU an das Software-Testing erfüllen, dürften weitgehend auch konform mit Anforderungen anderer Märkte sein.
Manchmal hilft es, weitere Normen zu beachten. Dazu zählen:
3. Sieben Tipps zum Software-Testing
Tipp 1: Bei Unit-Tests auch die Units testen
Entwickler verstehen unter dem Unit-Testing etwas anderes als Auditoren: Für die Ersteren sind Unit-Tests die Tests der granularen Einheiten, also z. B. der Methoden und Klassen. Hingegen müssen aus regulatorischer Sicht die Unit-Tests die Software-Einheiten testen, die größere Komponenten darstellen können.
Lesen Sie mehr dazu in diesem Artikel.
Tipp 2: Die richtigen Methoden wählen
Je nach Testziel sollten die Hersteller die passenden Methoden wählen. Ein Fuzz-Test hat eine andere Zielsetzung als ein Penetration-Test.
Nutzen Sie Blackbox-Testverfahren. Damit kann man nicht nur bei Software-Systemtests systematisch diejenigen Testfälle ermitteln, die die höchste Wahrscheinlichkeit haben, Fehler zu finden.
Tipp 3: Die Testabdeckung quantifizieren
Tests können nur dann Fehler finden, wenn der Testcode die zu testende Software tatsächlich durchläuft. Mit Werkzeugen lässt sich der Code-Coverage automatisiert bestimmen. Diese Metrik sollten Hersteller für sich festlegen.
Tipp 4: Alle Tests als Regressionstests nutzen
Jeder zusätzliche Test erhöht die Wahrscheinlichkeit, dass Fehler rechtzeitig gefunden und beseitigt werden. Deshalb hat es sich bewährt, nach Änderungen alle Tests als Regressionstests zu wiederholen. Nicht nur während der Entwicklung, sondern auch während der Software-Wartung.
Tipp 5: Nicht nur in der Entwicklung testen
Wenn Hersteller es den Anwendern erlauben, die Software anzupassen (etwa durch die Parametrierung der Software oder gar eigene Scripts), dann sollten diese Anpassungen ebenfalls durch Software-Tests überprüft werden.
Tipp 6: Mit Beta-Tests vorsichtig sein
Beta-Tests haben das Ziel, ein Produkt (hier eine Software) vor dem offiziellen Release einem ausgewählten Anwenderkreis zur Verfügung zu stellen, um Feedback zum Produkt zu erhalten.
Medizinproduktehersteller müssen sich bewusst sein, dass solch ein Beta-Test bereits eine gesetzeswidrige Inverkehrbringung des Produkts darstellen kann.
Tipp 7: Kompetenz sicherstellen
Software-Testing ist eine Kompetenz, die Hersteller festlegen und gewährleisten müssen. Dazu verpflichtet sie u. a. die ISO 13485; und zwar spezifisch für jedes Entwicklungsprojekt.
4. Unterstützung
Nutzen Sie die Unterstützung des Johner Instituts:
- Mit dem Auditgarant lernen Sie anhand von Videotrainings, wie Sie Schritt für Schritt eine schlanke und IEC 62304 konforme „Software-Akte“ selbst erstellen. Ein vollständiger Satz an Templates nimmt Ihnen dabei viel Arbeit ab.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihr Produkt schnell in den Markt kommt.