Handelswaren im Medizinproduktebereich können für Händler zur regulatorischen Falle werden: Die Grenze zwischen Händler und Hersteller nach MDR bzw. IVDR ist schmaler, als viele denken – mit potenziell kostspieligen rechtlichen Konsequenzen.
1. Handelsware im Sinne der MDR/IVDR
MDR und IVDR enthalten keine explizite Definition des Begriffs „Handelsware“.
Unter Handelsware versteht man Medizinprodukte, die
- bereits CE-gekennzeichnet sind,
- vom Händler oder Hersteller zugekauft und in unverändertem Originalzustand weitervertrieben werden.
Das heißt, die Händler agieren als reiner Durchgangsposten in der Lieferkette. Damit behält das Produkt seinen ursprünglichen Hersteller und dessen Verantwortlichkeiten.
2. Abgrenzungen
2.1 Abgrenzung zur eigenen Handelsmarke
Ein (Medizin-)Produkt wird zur Handelsware, wenn
- es der Händler bezieht und unverändert weitergibt,
- keine Modifikationen an Produkt oder Verpackung vornimmt,
- die Original-Kennzeichnung erhalten bleibt und
- der Händler höchstens hinzufügt:
- eigene Kontaktdaten als Händler
- zusätzliche Vertriebsinformationen (außerhalb der Originalverpackung).
Händler können Handelsware mit einem eigenen Handelsnamen bzw. unter einer eigenen Handelsmarke weiter vertreiben, wenn dies schriftlich mit dem Hersteller vereinbart wurde und der Hersteller als solcher weiterhin auf der Produktkennzeichnung angegeben wird. Die Verantwortung zur Einhaltung der regulatorischen Anforderungen verbleibt also beim Hersteller.
Hingegen ist das Produkt KEINE Handelsware mehr in den folgenden Fällen:
- Private-Label: Eigener Handelsname bzw. eigene Handelsmarke auf fremdem Produkt, Originalhersteller nicht ersichtlich
- Änderung der Zweckbestimmung
- Modifikationen jeglicher Art am Produkt oder an der Verpackung mit Einfluss auf die Konformität des Produkts
In diesen Fällen wird der Händler zum Hersteller mit allen Herstellerpflichten!
Die MDR definiert, wann Modifikationen am Produkt nicht als eine Tätigkeit angesehen werden, die die Konformität des Produkts beeinträchtigt. Lesen Sie dazu mehr im Fachartikel zu den Anforderungen an Händler (die auch Hersteller betreffen).
Sonderfall: Systeme und Behandlungseinheiten
Händler, die mehrere Produkte zu einem Set kombinieren, werden zu einem Hersteller von Systemen und Behandlungseinheiten und fallen unter Artikel 22 der MDR.
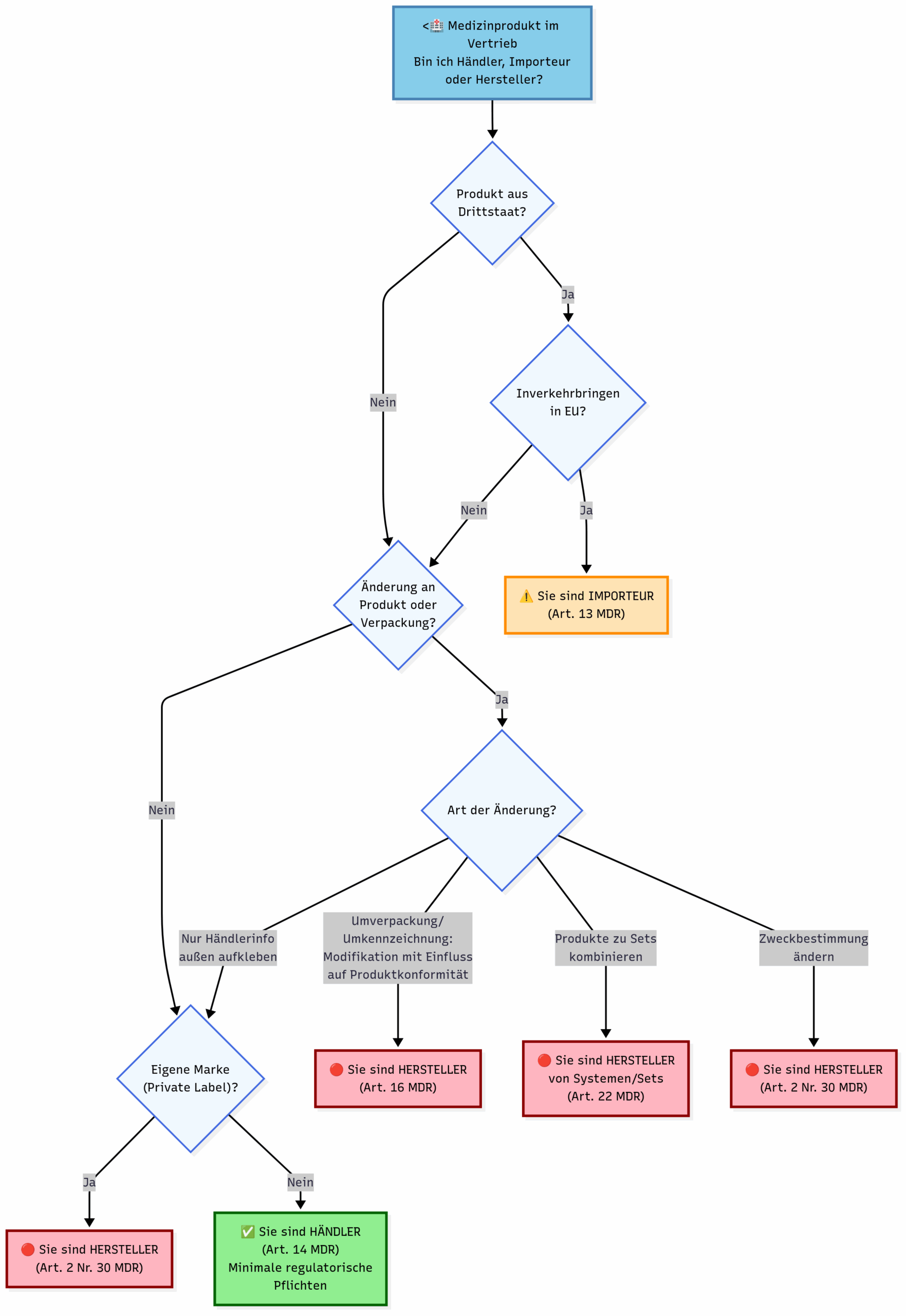
2.2 Abgrenzung der Tätigkeiten
Die Tätigkeiten beim Handel mit Medizinprodukten entscheiden über die anwendbaren gesetzlichen Pflichten, die der Händler erfüllen muss.
| Tätigkeit | Händler vertreibt das Produkt unter dem Namen bzw. der Marke des Herstellers oder unter seinem Handelsnamen bzw. seiner Handelsmarke, wenn mit dem Hersteller so vereinbart | Händler vertreibt das Produkt unter seinem eigenen Namen, Handelsnamen oder seiner eigenen Marke Händler verändert die Zweckbestimmung Händler modifiziert das Produkt bzw. die Verpackung, sodass die Konformität des Produkts beeinträchtigt wird |
| Sichtbarkeit | Original-Hersteller bleibt auf Produkt Kontaktdaten des Händlers auf der Kennzeichnung und/oder nur in Lieferdokumentation | Name des Händlers auf dem Produkt Originalhersteller nicht sichtbar |
| Verantwortlichkeit | Hersteller behält volle Verantwortung | Händler übernimmt Herstellerverantwortung und Produkthaftung |
| Regulatorische Pflichten | Minimal (siehe unten) | Vollständige Herstellerpflichten gemäß Artikel 10 einschließlich Technische Dokumentation QM-System nach ISO 13485 Eigene CE-Kennzeichnung Registrierung in EUDAMED |
Der Fachartikel zu den PLM-OEM-Konstellationen grenzt diese beiden Fälle noch genauer ab.
3. Gesetzliche Pflichten
3.1 Anforderungen an Händler von Handelsware
Die MDR und IVDR formulieren die Anforderungen jeweils im Artikel 14 (Pflichten der Händler). Zu diesen Pflichten zählen:
- Konformitätsprüfung beim Bezug:
- CE-Kennzeichnung vorhanden
- EU-Konformitätserklärung verfügbar
- UDI-Kennzeichnung (sofern erforderlich)
- Gebrauchsanweisung in erforderlichen Sprachen
- Lager- und Transportbedingungen gemäß Herstellervorgaben
- Stichprobenprüfungen auf ordnungsgemäßen Zustand
- Aufbewahrung von Lieferanten-/Kundendaten (mind. 10 Jahre)
- Meldepflichten bei Vorkommnissen an Hersteller und Behörden
- Keine eigene Registrierung in EUDAMED als Händler erforderlich
Der Händler muss zudem dazu beitragen, ein angemessenes Niveau der Rückverfolgbarkeit in der Produktlieferkette zu erreichen. Dafür muss er der zuständigen Behörde gegenüber angeben können:
- Alle Wirtschaftsakteure, von denen er ein Produkt bezogen und direkt abgegeben hat
- Alle Gesundheitseinrichtungen oder Angehörige der Gesundheitsberufe, an die er ein Produkt direkt abgegeben hat
3.2 Anforderungen an Importeure von Handelsware
Beim Umgang mit Handelswaren müssen zwei Rollen unterschieden werden:
Händler (Art. 2 Nr. 34 MDR):
- Produkt bereits in der EU in Verkehr gebracht
- Keine Änderungen am Produkt / an der Verpackung
- Reiner Weitervertrieb
- Beispiel: Sanitätshaus kauft bei deutschem Großhändler.
Importeur (Art. 2 Nr. 33 MDR):
- Inverkehrbringen in EU
- Produkt kommt aus Drittstaat
- Importeur muss auf dem Produkt namentlich genannt werden
- Beispiel: Direktimport aus USA/China
Dieser Artikel verschafft eine Übersicht über die Pflichten und Aufgaben von Importeuren.
4. Besonderheiten Software als Medizinprodukt
Standalone-Software als Handelsware ist selten geworden. Denn die Hersteller vermarkten und betreiben immer öfter die Software direkt.
Dennoch ist ein reiner Händler-Status weiterhin möglich:
- Reiner Vertrieb von Lizenzen bzw. Nutzungsrechten (z. B. durch Aktivierungscodes)
- Vertrieb von unveränderter Software auf Datenträgern
Die Grenze zum Hersteller kann in den folgenden Fällen leicht überschritten werden:
- Vertrieb via Download → Inverkehrbringung
- Hosting → Bereitstellung
- Updates/Patches → Produktänderung
5. Fazit und Zusammenfassung
Die gesetzlichen Vorgaben an den Vertrieb von Handelswaren sind überschaubar. Allerdings müssen die Händler diese Vorgaben nicht nur beachten, sondern auch sicherstellen, dass sie die Grenze zum Hersteller oder Importeur nicht überschreiten.
Das Johner Institut beantwortet Fragen aller Wirtschaftsakteure (Händler, Hersteller, Importeure) und unterstützt sie dabei, die regulatorischen Anforderungen zu erfüllen. Melden Sie sich.



Sehr geehrte Frau Dr. Reinhold,
vielen Dank für Ihren Artikel. Aus meiner Sicht lässt dieser aber viele Fragen unbeantwortet, die sich bei näherer Beschäftigung mit dem Thema sofort aufdrängen.
Hier nur einige Beispiele:
Stichprobenprüfung – ja oder nein:
Wie Sie richtig beschreiben, erlaubt die MDR/IVDR eine Stichprobenprüfung. Das deutsche MPDG sieht aber in §92 Absatz (1) Ziffer 3 eine „Freiheitsstrafe bis zu drei Jahren oder Geldstrafe“ vor für den Fall, dass man „ein gefälschtes Produkt … auf Lager hält, zur Abgabe anbietet, … oder auf dem Markt bereitstellt.“ Da stellt sich natürlich die Frage, wie risikoaffin man sein darf, um trotz solch drastischer Strafandrohung noch mit Stichproben zu arbeiten, die ja naturgemäß einen gewissen Durchschlupf haben.
Stichprobenprüfung – Verfahren:
Ich hätte mir ebenfalls ein paar Hinweise hinsichtlich des Vorgehens bei der Stichprobenprüfung gewünscht:
Kann/soll man hier z.B. einen „Stichprobenplan nach ISO 2859 Teil I, Allgemeines Prüfniveau II“ anwenden, oder etwas anderes?
Wie berücksichtigt man die Risikoklasse der zu überprüfenden Produkte bei der Stichprobenprüfung?
Wie geht man damit um, dass zur Überprüfung der CE-Kennzeichnung und/oder der Sprachfassung der beigefügten Gebrauchsanweisung die Produktverpackung unter Umständen geöffnet werden muss, das Produkt also nach erfolgter Prüfung nicht mehr als „fabrikneu“ verkauft werden kann?
Produkte, die auch Medizinprodukte sind:
Bestimmte Produkte müssen mehrere Richtlinien erfüllen. Beispiel Fieberthermometer mit Bluetooth, das neben der MDR auch noch die RED erfüllen muss. Dadurch ergeben sich zusätzliche Prüfanforderungen, die zu beachten sind. Darauf wird aber in dem Artikel überhaupt nicht eingegangen, obwohl solche Kombi-Produkte heutzutage vermutlich recht häufig sein dürften.
Dropshipping:
Viele Händler betreiben Dropshipping, lassen also Produkte vom Großhändler direkt zum Endkunden liefern. Dadurch bekommt der Händler die Produkte aber nie zu sehen, kann diese also auch nicht überprüfen. Wie sollten die entsprechenden Verträge zwischen Händler und Großhändler ausgestaltet sein, damit der Händler hier Rechtssicherheit hat?
Zeitliche Aspekte:
Die MDR schreibt in Artikel 14 (IVDR gleichlautend): „(2) Bevor sie ein Produkt auf dem Markt bereitstellen, überprüfen die Händler …“
Das beschreibt also eine Warenausgangsprüfung. Prozessual werden aber viele Händler eher eine Wareneingangsprüfung durchführen. Liegen Produkte nach dieser Wareneingangsprüfung längere Zeit beim Händler auf Lager, können unter Umständen bereits überprüfte Aspekte wieder ungültig werden, weil sich z.B. die Rechtslage geändert hat oder der Importeur zwischenzeitlich ein anderer ist. Auch hierzu wären ein paar Hinweise in dem Artikel hilfreich gewesen.
Ich könnte hier noch zahlreiche weitere Fragestellungen aufwerfen. Das würde aber den Rahmen eines solchen Kommentars sprengen.
Im Sinne Ihrer Leser hielte es daher für hilfreich, den Artikel in einer künftigen Fassung mit etwas mehr Detailtiefe auszugestalten. Vielen Dank.
Mit freundlichen Grüßen
Jörg Schmidt
Lieber Herr Schmidt,
vielen Dank für Ihr ausführliches Feedback zu meinem Artikel. Sie haben vollkommen recht, dass die MDR in Bezug auf die konkrete Umsetzung der Händlerpflichten nach Artikel 14 viele Detailfragen offenlässt und dadurch in der Praxis erheblicher Klärungsbedarf entsteht. Mit dem Beitrag wollte ich bewusst nur einen Überblick und eine erste Orientierung zur Abgrenzung von Medizinprodukten als reine Handelsware geben. Eine vollumfängliche Beantwortung aller von Ihnen angesprochenen Punkte würde den Rahmen sprengen und ist auch Teil einer individuellen Beratung unserer Kunden, in der in aller Regel unternehmensspezifische Prozesse und die Risikoklassen der betreffenden Produkte berücksichtigt werden. Wenn Sie die von Ihnen angesprochenen Fragen und Themen gerne mit uns im Detail besprechen möchten, dann Kommen Sie dafür gerne auf uns zu. Wir freuen uns auf Ihre Kontaktaufnahme.
Herzliche Grüße
Manuela Reinhold