Standalone-Software (eigenständige Software) bezeichnet die EU-Medizinprodukteverordnung „Produkte in Form einer Software“. Allerdings ist diese Verordnung nur bei einem Teil der Standalone-Software anwendbar.
Inhalt
Diese Seite verschafft einen kurzen Überblick und referenziert Fachartikel für weitere Hintergrundinformationen.
- Taxonomie
- Regulatorische Anforderungen an Standalone-Software
- Fünf Herausforderungen und Lösungsansätze
- Unterstützung
1. Taxonomie der Software-Produkte
a) Definition
Standalone-Software-Anwendungen sind eigenständige Produkte, die ohne Hardware in den Markt gebracht werden, sei es als Download (z. B. über einen App Store) oder auf einem physischen Datenträger (z. B. Flashdrive).
b) Abgrenzung
Standalone-Software, die für das Gesundheitswesen gedacht ist, ist nicht deckungsgleich mit Health-Software. Sie ist auch nicht deckungsgleich mit Medical Device Software (s. Abb. 1).

Abb. 1: Die Standalone-Software für das Gesundheitswesen ist eine Teilmenge der Health-Software (alle vier Quadranten).
c) Beispiele
Beispiele für Standalone-Software sind:
2. Regulatorische Anforderungen
a) Standalone-Software – ein Medizinprodukt?
Hersteller müssen klären, ob ihre Standalone-Software als Medizinprodukt zählt. Wann dies der Fall ist, beleuchtet der Artikel zur Qualifizierung und Klassifizierung von Software als Medizinprodukt.
b) Verordnungen, Gesetze, Normen
Falls die Standalone-Software als Medizinprodukt zählt („qualifiziert“), muss sie die gesetzlichen und normativen Anforderungen erfüllen. Diese unterscheiden sich nicht von den Anforderungen an Software, die Teil eines Medizinprodukts ist.
- In Europa sind die Medizinprodukteverordnungen (MDR, IVDR) relevant. Diese enthalten allgemeine Vorschriften. Grundlegende Anforderungen an Software stellt dieser Fachartikel vor.
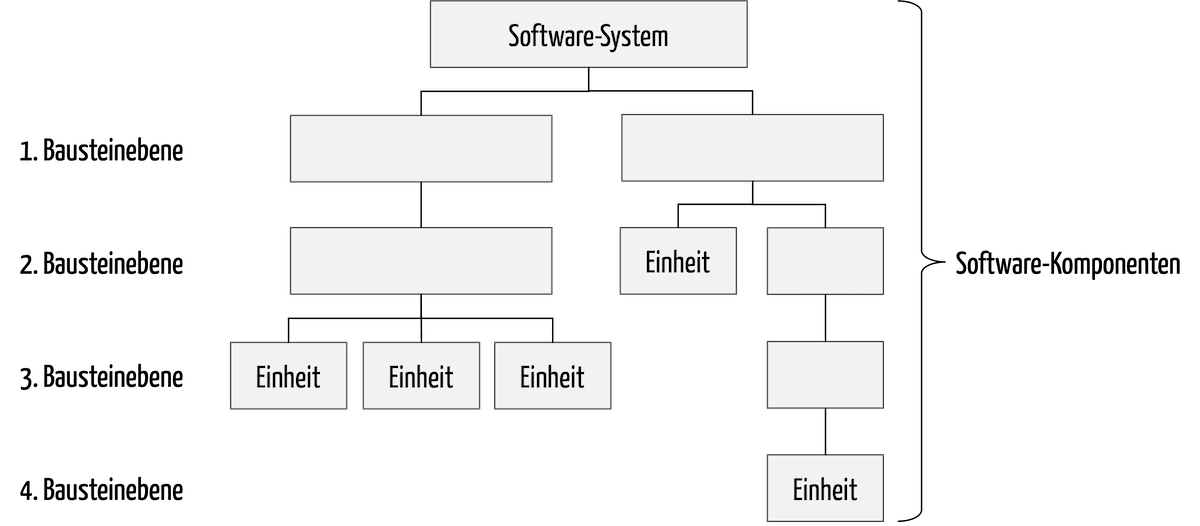
- Die IEC 62304 definiert die Lebenszyklusprozesse für Software von Medizinprodukten.
- Die IEC 82304-1 ist bei jeder Health-Software und damit jeder Standalone-Software im Gesundheitswesen anwendbar. Sie fordert Konformität mit den Anforderungen der IEC 62304.
- Auch die FDA stellt in ihren Guidance-Dokumenten spezifische Anforderungen an medizinische Software.
3. Fünf Herausforderungen und Lösungsansätze
Herausforderung 1: Abgrenzung der Standalone-Software
Insbesondere bei webbasierten Medizinprodukten tun sich die Hersteller schwer mit der Festlegung, welcher Teil zum Medizinprodukt zählt und welcher zur Laufzeitumgebung. Gehört beispielsweise der Applikationsserver dazu?
Es ist wichtig, diese Festlegung explizit zu dokumentieren.

Abb. 2: Webbasierte Medizinprodukte bestehen aus vielen Ebenen. Ein Teil zählt zur Software (Medizinprodukt), ein Teil zu dessen Laufzeitumgebung. SOUP sind Teil des Medizinprodukts.
Herausforderung 2: Inverkehrbringung
Wenn die Software über App Stores bereitgestellt wird, stellt sich die Frage, wann die Inverkehrbringung erfolgt. Beim Upload in den Store? Beim Freischalten durch den Betreiber? Oder erst beim Download?
Dieser Artikel zur Inverkehrbringung gibt Antworten.
Herausforderung 3: Software-Testing
Die Laufzeitumgebungen, auf denen die Standalone-Software installiert wird, unterscheiden sich. Kaum ein Rechner gleicht dem anderen. Das gilt sowohl für Notebooks und Server als auch für Smartphones. So gibt es Tausende von Android-basierten Endgeräten.
Dies macht es den Herstellern schwer, das korrekte Funktionieren ihrer Software auf diesen Endgeräten zu überprüfen. Daher müssen sie diese einschränken oder risikobasiert testen.
Herausforderung 4: Tatsächliche Nutzung
Diese Vielfalt betrifft nicht nur die technische Umgebung, sondern auch die Nutzungsumgebungen und Nutzer. Wie sollen die Hersteller gewährleisten, dass tatsächlich nur die in der Zweckbestimmung vorgesehenen Nutzer die Geräte nutzen? Wie sollen sie antizipieren, unter welchen Umständen (z. B. beim Fahren, nachts, während des Sports) ihre Produkte genutzt werden?
Hier ist eine systematische Post-Market Surveillance unerlässlich, um die tatsächliche Nutzung zu verfolgen und ggf. darauf zu reagieren.
Herausforderung 5: Latenz der „Zulassung“
Im Gegensatz zu vielen physischen Produkten muss und kann Software in kurzen Entwicklungszyklen auf den Markt gebracht werden. Dies ist schon deshalb notwendig, weil Security-Patches aufgespielt werden müssen.
Dem gegenüber stehen allerdings langwierige Verfahren der Zulassungs- und Konformitätsbewertung.
Das Johner Institut digitalisiert die regulatorischen Prozesse und arbeitet an einer Real-Time Regulation.
4. Unterstützung für Software-Hersteller
Nutzen Sie die Unterstützung des Johner Instituts:
- Die Videotrainings des Auditgarant helfen Ihnen, Schritt für Schritt eine schlanke und IEC-62304-konforme „Software-Akte“ zu erstellen. Zusätzlich nimmt Ihnen ein vollständiger Satz an Templates viel Arbeit ab.
Melden Sie sich gleich, damit wir die nächsten Schritte besprechen können. So stellen Sie sicher, dass die „Zulassung“ sicher gelingt und Ihre Software bzw. Ihre Produkte schnell in den Markt kommen.