Medizinproduktehersteller sind gesetzlich verpflichtet, Risiken zu eliminieren oder zumindest zu minimieren, die durch mangelnde Gebrauchstauglichkeit (Usability) ihrer Produkte entstehen.
Beim Nachweis der gesetzlichen Anforderungen hilft die Norm IEC 62366-1. Sie trägt den Titel „Anwendung der Gebrauchstauglichkeit auf Medizinprodukte“.
Inhalt
Die folgenden Fachartikel helfen beim Einstieg in das Thema Gebrauchstauglichkeit und bei der Umsetzung:
- Artikel zur Einführung
- Artikel zu den regulatorischen Anforderungen (EU, FDA, IEC 62366-1)
- Artikel zu den Aktivitäten im Usability-Prozess
- Möglichkeiten der Unterstützung
1. Artikel zur Einführung ins Usability Engineering bei Medizinprodukten
Das Verständnis des Begriffs „Usability“ und der Abgrenzung von „User Experience“ ist notwendig, um die gesetzlichen Anforderungen besser zu verstehen.
Folgender Beitrag hilft, die Begriffe „Use Scenario“, „User Story“ und „User Task” zu unterscheiden.
Die FAQ zur Gebrauchstauglichkeit bei Medizinprodukten beantworten weitere Fragen.
2. Artikel zu den regulatorischen Anforderungen
Die Gesetze und Normen stellen Anforderungen an den Nachweis der Gebrauchstauglichkeit und Sicherheit der Medizinprodukte.
a) Anforderungen der EU ans Usability Engineering bei Medizinprodukten
Hersteller, die ihre Produkte in der EU vermarkten wollen, müssen die Anforderungen der MDR an die Gebrauchstauglichkeit (analog IVDR) erfüllen.
b) Anforderungen der Usability-Normen für Medizinprodukte
Für den Konformitätsnachweis sollten die Hersteller die Anforderungen der IEC 62366-1 erfüllen. Hilfestellung dabei gibt der Technical Report IEC TR 62366-2, der gewissermaßen die Gebrauchsanweisung zur IEC 62366-1 liefert.
Die neueren Versionen dieser Normen arbeiten mit dem Konzept des User Interfaces of Unknown Provenance (UOUP). Das erspart besonders Herstellern von Legacy-Produkten unnötige Arbeit.
In einigen Partikularnormen zur IEC 60601-1 finden sich weitere Anforderungen an die Gebrauchstauglichkeit, darunter solche an die Hauptbedienfunktionen der Medizinprodukte.
Für die Hersteller von ME-Geräten ist im Kontext der Usability auch die IEC 60601-1-8 relevant. Hingegen hat die IEC 60601-1-6 keine Relevanz mehr.
Der Usability-Engineering-Prozess ist Teil des Entwicklungsprozesses. Ein Artikel beschreibt das Zusammenspiel dieses Prozess und dem Entwicklungsprozess gemäß ISO 13485.
c) Anforderungen der FDA ans Usability Engineering
Die FDA erkennt die IEC 62366-1 als „Consensus Standard“ an, formuliert ihre Anforderungen an die Usability jedoch in verschiedenen Leitlinien.
Ein Beitrag stellt diese Leitlinien und deren Zusammenspiel vor, ein weiterer beschreibt den Human Factors Engineering Prozess.
Insbesondere für Hersteller, die ihre Produkte in beiden Märkten vermarkten wollen, ist der Artikel zur FDA- und IEC-62366-1-konformen Gebrauchstauglichkeitsakte relevant.
d) Sonstige Märkte, Übergreifendes
Auch diese Artikel sind hilfreich:
3. Artikel zu Aktivitäten im Usability-Prozess
a) Requirements Engineering
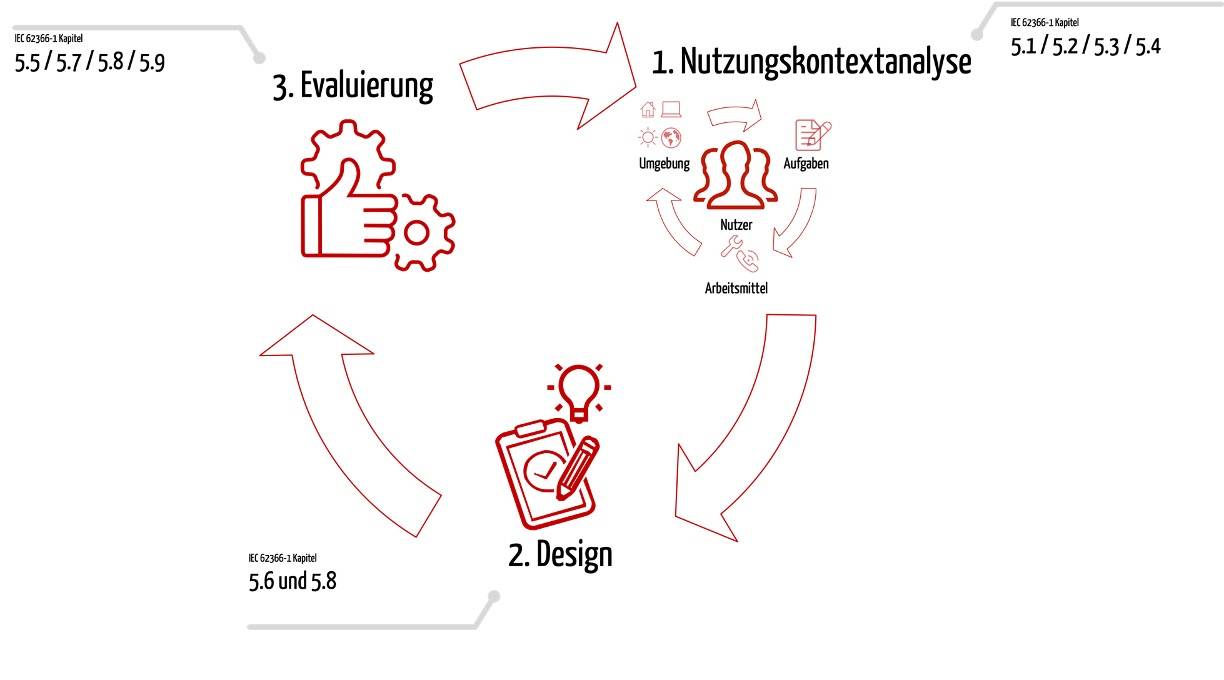
Einer der ersten Schritte im Usability Engineering (einem Teil des Requirements Engineerings) ist die Festlegung und Charakterisierung der Nutzergruppen. Dazu gilt es zu unterscheiden zwischen primären und sekundären Nutzern.
Beide Typen an Benutzergruppen lassen sich mit Personas beschreiben.
Sind die Stakeholder bekannt und beschrieben, beginnt das Erheben der Stakeholder-Anforderungen sowie der Nutzungsanforderungen. Dabei sollten die Hersteller User Requests und User Requirements nicht verwechseln. Eine weitere Falle birgt das Arbeiten mit Lastenheften und Pflichtenheften.
Beachten Sie auch den Übersichtsartikel zum systematischen Erheben von Anforderungen.
b) Umgang mit Gebrauchstauglichkeits-Risiken bei Medizinprodukten
Der Schwerpunkt der gesetzlichen Vorgaben betrifft die Risiken, die durch Use Errors (nicht zu verwechseln mit User Errors) entstehen.
Dabei müssen die Hersteller den vorhersehbaren Missbrauch betrachten und diesen vom anormalen Gebrauch unterscheiden.
Hilfreich bei der Risikoanalyse ist auch das PCA-Modell (Perception, Cognition, Action).
c) Gestaltung von User Interfaces und Gebrauchsanweisungen für Medizinprodukte
Sowohl die Stakeholder-Anforderungen als auch die Risikoanalyse haben einen Einfluss auf die gesetzeskonforme Spezifikation des User Interfaces. Je nach Nutzerprofil müssen die Hersteller auch die Accessibility (Barrierefreiheit) ihrer Produkte sicherstellen und nachweisen.
Tipp
Die DiGAV verlang den Nachweis der Barrierefreiheit. Dies lässt sich nahtlos in den Usability-Engineering-Prozess integrieren.
Beim Prozess bis zur Gestaltung der User Interfaces kommen mehrere Methoden zum Einsatz:
Die verlinkten Artikel stellen die Methoden vor und geben Tipps zu deren Anwendung.
d) Labeling und den Gebrauchsanweisungen
Die Gebrauchsanweisungen zählen zum „User Interface“. Die Norm fordert explizit, dass Informationen zur Sicherheit evaluiert werden. Beachten Sie daher die folgenden Artikel:
e) Bewertung der Gebrauchstauglichkeit (u. a. Usability-Tests) von Medizinprodukten
Die Prüfung bzw. Bewertung nennt man im Kontext der Gebrauchstauglichkeit die „Evaluation“. Dabei unterscheidet man:
- Formative (entwicklungsbegleitende) Evaluation
- Summative (entwicklungsabschließende) Evaluation
Methoden der formativen Evaluation
Einen guten Einstieg bietet der Artikel Formative Bewertung: Was die FDA und IEC 62366 verlangen. Details beschreiben die folgenden Artikel:
Methoden der summativen Evaluation
Die summative Evaluation erfolgt im Rahmen eines Usability-Tests. Dieser Artikel zur summativen Evaluation beschreibt, auf welche Punkte Sie dabei achten müssen.
Die summative Evaluation entspricht einer Usability-Validierung, die konform mit den Anforderungen der IEC 62366-1 und FDA erfolgen sollte.
Beachten Sie, dass ältere Versionen der Norm zwischen Verifizierung und Validierung der Gebrauchstauglichkeit unterscheiden.
Weiterführende Informationen
Weitere Tipps geben die folgenden Artikel
4. Hilfe des Johner Instituts
Die Expertinnen und Experten des Johner Instituts unterstützen Sie in allen Phasen Ihres Usability-Engineering-Prozesses: